细胞培养上游强化工艺的应用
郭玉娟 裴新 郑小明 金冰 杨嫄嫄 查鑫华 张晓东 季宇
自1986年第一个生物治疗药物上市以来,生物制药行业的生产工艺一直在快速发展[1]。到2023年,全球市场规模预计将达到2850亿美元。目前,细胞培养工艺仍以分批补料(Fed-batch)工艺为主,原因为Fed-batch工艺相对简单和相对简单的可放大性。通过细胞系工程、培养基开发和工艺控制改进,实现了更高的比生产率、较高的活细胞密度(viable cell density,VCD)、延长培养时间,已将表达量从每升几十毫克提高到>3 g/L,成本大幅降低[2]。
单克隆抗体(monoclonal antibodies,mAb)的生产成本仍然远高于小分子,并且需要增加产量来满足市场需求。因此,降低mAb 生产成本、减少供应短缺、提高生产力和产量是生物制造行业面临的最重要挑战[3]。强化工艺(process intensification,PI)是上游工艺中倍受关注的新技术。强化工艺是连续进行培养基置换,使用截留设备将细胞保留在生物反应器中,使细胞维持稳定的状态。强化工艺能达到较高的细胞密度及蛋白产量。本文将讨论强化工艺在生物制药上游工艺开发中的应用,包括N-1种子培养步骤以及N生产培养步骤。
1 强化工艺概述
强化工艺采用创新技术和方法来实现工艺改进,从而显著降低制造成本。在生物制药上游工艺方面,传统的上游工艺开发路线包括从最早的种子复苏、摇瓶扩增、种子罐扩增到生产罐。因此,整个路线可以分为种子阶段和生产阶段。强化工艺可应用于N-1种子培养阶段以及N生产培养阶段。前者可以实现高密度种子培养,后者可以进行Perfusion、高密度接种培养、浓缩补料批培养(concentrated Fed-batch,CFB)等。
2 N-1种子阶段
2.1 N-1 Perfusion N-1 Perfusion指在N-1种子生物反应器培养阶段使用细胞截留装置将细胞截留在反应器内,同时进行培养基置换,使细胞维持在营养成分充足且较少代谢废弃物的健康环境中,从而在短时间内(通常5~7 d)达到较高密度[(20~100)×106cells/ml],同时维持较高活率[4]。传统Fed-batch接种密度通常在(0.4~2.0)×106cells/ml左右,由于接种密度较低,培养前期主要是细胞生长阶段,这种非生产性生长阶段延长细胞培养运行时间,降低生产率[5]。Padawer等[6]通过高密度接种(8.0×106cells/ml),培养8 d即可达到与低密度(0.5×106cells/ml)接种培养14 d相同的蛋白产量。此外,由于N-1灌流种子培养细胞密度较高,1个N-1种子反应器可同时接种至多个N阶段传统低密度Fed-batch培养,从而减小N-1阶段设备规模[7]。基于以上优势,N-1 Perfusion强化工艺被越来越广泛应用[8]。
2.2 N-1高密度细胞库 高密度细胞库也是近年来新发展的一个强化工艺技术。传统的种子扩增流程通常是在几个连续的批培养中进行的,包括在摇瓶或摇管中经过几次细胞扩增培养,每个扩增步骤通常需要3 d左右的时间,然后再接种到种子生物反应器中。这个过程通常需要3周的时间,需要耗费很多人力和时间成本,增加污染的风险。
高密度细胞库的建立可以克服这些不足。高密度细胞库的运用通常与N-1 Perfusion相结合,种子培养以Perfusion模式扩增。结合WAVE生物反应器培养和Perfusion培养这两种细胞培养技术,可以缩短细胞从冻存管到N-1生物反应器的整个种子扩增的过程。在减少操作时间的同时可以实现更短的种子扩增时间和更高的细胞密度。高密度细胞库每支体积含4.5 ml[9],细胞密度一般为(50~100)×106cells/ml。高密度细胞库可以直接接种到生物反应器中,省去了中间种子扩增步骤。见图1。Tao等[10]的研究中,使用高密度细胞库(45×107cells/瓶)直接接种到20 L的WAVE袋中,结果显示,使用高密度细胞库可以省去摇瓶扩增步骤,工时可以减少9 d。高密度细胞库是强化种子扩增步骤的一个简单高效的途径,可以在不影响生物工艺性能的情况下提高细胞培养工艺的效率。
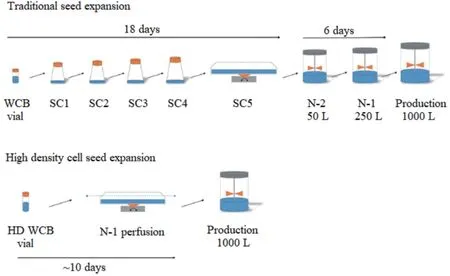
图1 传统扩增工艺与强化过程
3 N阶段
3.1 灌流工艺 N阶段Perfusion是将反应器中培养基不断置换,移除代谢副产物同时补充新的营养物质,细胞被截留在反应器中。此外,根据培养需求定量排出细胞,维持稳定的生长环境。Perfusion可以达到比Fed-batch更高的细胞密度,具有单位体积产量高、占地面积小等优势。灌流工艺已成功运用于表达产物不稳定和表达量较低产品的生产。
与Fed-batch培养相比,Perfusion工艺细胞VCD比Fed-batch高2~5倍[11],并能在较长时间内保持较高密度,获得更高的体积生产率,糖基化图谱和电荷异质性比较一致。Perfusion工艺可以减少蛋白聚集和不完整碎片,批间异质性更低。从经济方面进行比较,培养基对总成本的影响会随着灌流速率(perfusion rate,PR)的提高而显著降低。在Perfusion中,通过优化培养基,降低单位细胞的灌流速率(CSPR),提高细胞特定生产率(QP)值,最终反应器产率提高230%,总培养基成本从17 $/g降低至10.1 $/g[12]。灌流工艺传统习惯用于生产不稳定产品比如凝血因子和酶制品,然而也可用于mAb的生产,以下汇总了12种采用灌流工艺进行生产商业治疗生物制品药物[13]。见表1。
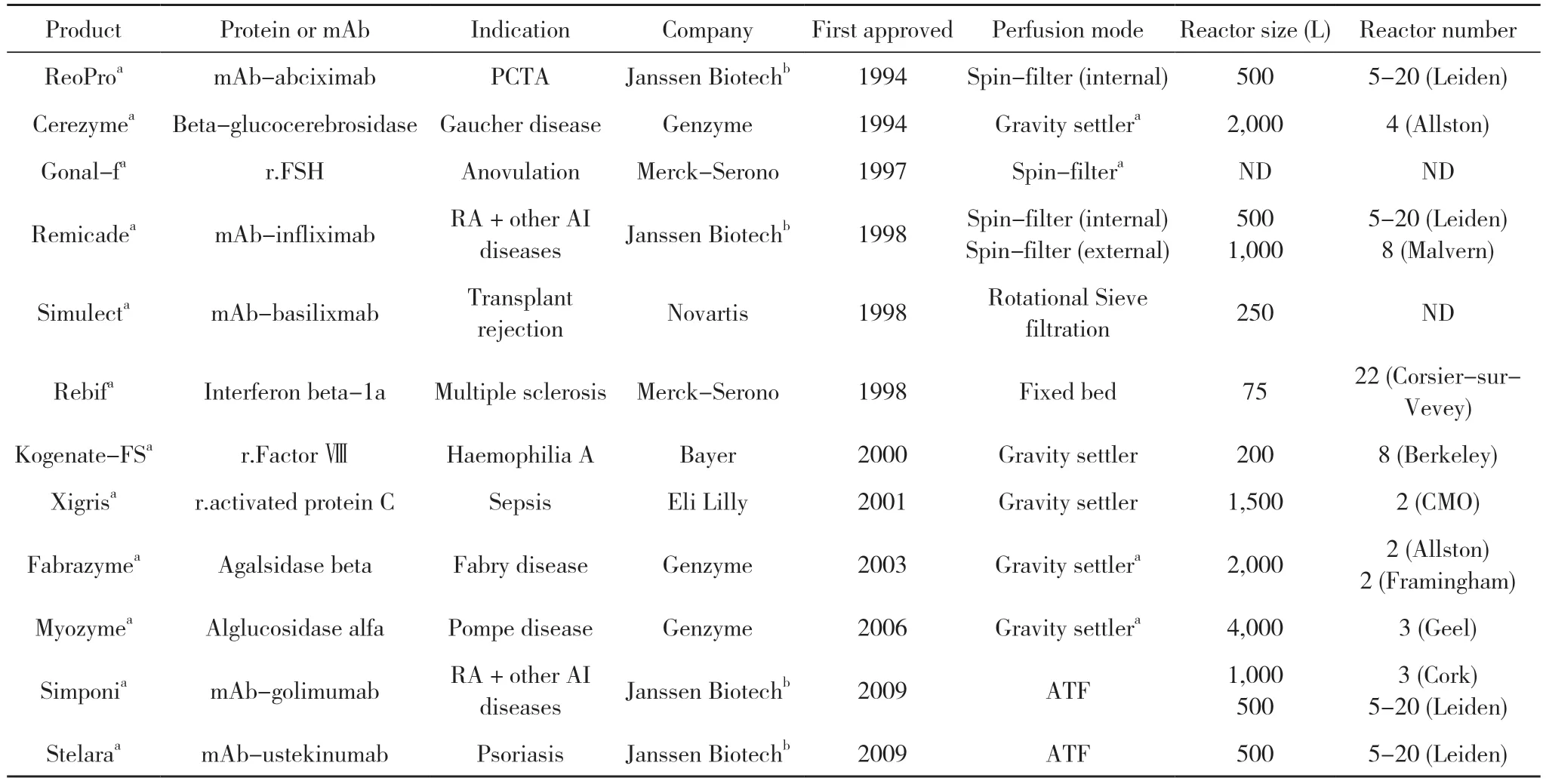
表1 采用灌流工艺进行生产的商业治疗生物制品药物
3.2 高密度接种Fed-batch (HSD) 高密度接种Fedbatch的N-1阶段一般采用Perfusion方式得到较高细胞密度,以满足高接种密度的要求。一般高密度接种的细胞密度为2×106cells/ml以上,可减少生产阶段时间,以更短的Fed-batch生产周期达到相同产量[14]。这一强化工艺模式主要有两个优势:①对培养基用量需求较少;②对现有工艺设备改动较少,只需改动N-1阶段设备即可[3]。有研究显示,对比传统的Fed-batch工艺,N-1 perfusion衔接高密度接种Fed-batch,可以显著增加表达量[15]。
高密度接种Fed-batch可以缩短单批次培养时间达到同样的产量要求,增加每年的生产批次,大大提升了设备利用率,继而使产能得到提高。在Yang等[5]的研究中,对两株CHO细胞株进行高密度接种Fedbatch工艺优化,利用N-1 perfusion得到40×106cell/ml 的高密度种子,以初始密度10×106cells/ml接种N阶段Fed-batch,12 d即达到原工艺17 d的表达量(5 g/L),产能提高30%,且产品质量与原工艺保持一致,并且其中一株克隆产品质量更得到改善。Stepper等[16]对比传统工艺,采用超高密度接种Fed-batch后,6 d即达到原工艺11 d的表达量,生产周期缩短45%。以相同年产量计算,传统工艺需要生产147批,采用高密度接种Fed-batch强化工艺后只需生产49批,产能从 2.1 kg/d提高到3.9 kg/d。有研究[17]将传统工艺流程与强化工艺流程进行对比,具体见图2。
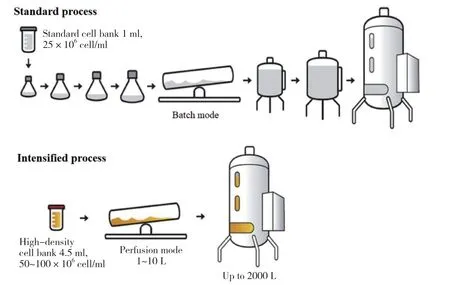
图2 传统工艺流程与强化工艺流程对比
在进行高密度接种Fed-batch工艺优化时,应充分考虑到细胞生长代谢和蛋白质量的变化。高密度接种Fed-batch,细胞对数增长期缩短,较早到达平台期,可能会出现提前进入衰亡期,因此细胞生长代谢与传统工艺存在一定差异。Xu等[18]以(3~16)×106cells/ml初始密度进行接种,对比原工艺Peak VCD提高1.8~2.4倍,最终表达量提高至4~8倍。根据细胞株及原工艺不同,采用高密度接种Fed-batch强化工艺后,由于细胞密度和活率、平台期维持时间与传统工艺可能存在差异,所以可能造成蛋白质量的变化。Padawer等[6]的研究,同样发现采用高密度接种Fed-batch强化工艺后,蛋白的酸碱异构发生改变;以5×106cells/ml初始密度进行接种,以表达量达到原工艺水平时收获日蛋白质量对比,糖基化结果没有显著差异,但是酸性峰比例下降12%~20%。
3.3 CFB工艺 CFB工艺一般是使用50 KD孔径的中空纤维柱,通过1个动力系统使反应器内培养液流经柱子的同时排出废液,而细胞和蛋白被截留在反应器内,同时会往反应器内补充新鲜培养基。培养液循环于反应器与中空纤维柱的方法主要分为交替切向流(alternating tangential flow,ATF)和切向流过滤(tangential flow filtration,TFF),其中ATF应用较多。见图3。
早期关于CFB的研究是使用WAVE生物反应器,John等[19]在WAVE生物反应器中使用CHO细胞生产免疫球蛋白G(immunoglobulin G,IgG)的研究中应用了ATF系统来开发CFB工艺,通过优化PR,从0.8~1.2 VVD 提高到0.8~2.5 VVD,VCD可达到34.5×106cells/ml,最终蛋白浓度为3.8 g/L,相比于传统补料培养(traditional fed-batch,TFB),最高VCD和表达量分别提高了6倍和10倍。Clincke等[20]同样进行了在WAVE生物反应器中开发CFB工艺的研究,其团队分别用ATF系统和TFF系统做了对比研究,得到了蛋白产量(ATF,第 11天,1.80 g/L;TFF,第12天,2.98 g/L)。受限于当时细胞株及培养基开发不太成熟,以及WAVE生物反应器中氧气传质效率不够等原因,早期研究中Titer均比较低。
Yang等[21]在5 L Applikon生物反应器中结合ATF系统对CFB工艺参数的优化进行了研究,最初在1×培养基,0.1 CSPR的条件下,培养至第10天时ATF柱即发生了堵塞现象,导致培养终止。经过优化后将灌流培养基浓缩配制为2×培养基,以0.05 CSPR的PR重新进行实验,但是由于VCD过高(接近200× 106cells/ml)ATF柱很快也出现了堵塞,但对比之下,同时期的Titer远高于之前工艺,为了防止这一现象在培养至第8天时将培养温度由35℃降为31℃,最高VCD得以控制在120×106cells/ml左右,培养周期相应也得到延长。在蛋白质量的变化上,该团队发现,相比于TFB,CFB工艺产出的蛋白存在聚体增多、电荷异质性方面酸峰降低的质量数据变化。优化后的工艺在另一细胞株上验证,最终结果见表2。

表2 不同工艺的质量结果对比
3.4 细胞截留技术 细胞截留技术能使细胞和产品或培养基分离,去除代谢废物,同时不断进行新鲜培养基的置换,从而达到较高的细胞密度和细胞活率,延长培养时间。理想的细胞截留技术应具备较高的细胞截留效率和灌流能力,较低的流速和较短的反应器外停留时间,能够维持较高的细胞密度和细胞活率、较长时间的运行性能稳定及较低的失败风险等。
该技术原理主要包括根据密度的沉降分离(倾斜式沉降、离心机分离、超声波分离、水力涡旋器等)和根据细胞孔径大小的膜分离(切向流膜分离、中空纤维膜分离等),每种技术各有其优缺点。沉降分离是利用细胞与培养基的密度不同进行分离。其优点是可以避免膜堵塞的问题,降低剪切力引起的细胞损伤,能够实现长时间的Perfusion。但是采用这种灌流装置,细胞密度的峰值较低。Searles等[22]报道细胞密度的峰值只能达到(20~30)×106cells/ml,如果超过这个细胞密度截留效率会显著降低。Kim等[23]的实验表明,连续离心Perfusion细胞密度是30×106cells/ml,能维持>30 d的培养。超声分离进行Perfusion细胞密度的峰值一般是(10~20)×106cells/ml,目前也有文献[24]报道细胞密度的峰值能达到40×106cells/ml。2007年Pinto等[25]报告水力旋流表现出较高的分离效率,分离效率能达到99%,但细胞密度较低。Bettinardi等[26]研究显示使用水力旋流进行截留,细胞密度也能达到 50×106cells/ml。
另一种细胞截留技术是膜分离技术,包括中空纤维过滤、交叉流过滤、漩涡流过滤及旋转过滤等。膜分离截留技术最大的挑战是死细胞,细胞碎片以及添加的消泡剂等会导致膜堵塞。目前常见的中空纤维过滤包括TFF和ATF。TFF是采用切向流技术,通过蠕动泵使过滤方向与液体流动方向相互垂直,从而减少膜堵塞风险。不同研究小组[27,28]实验结果显示,TFF细胞密度峰值能达到(60~70)×106cells/ml,培养时间>25 d。ATF是通过隔膜泵提供动力使得培养液在经过中空纤维TFF实现细胞拦截,一次循环可以同时反冲膜,所以能有效防止膜的阻塞。ATF可以实现较高的培养基置换速率和低剪切力,能够维持较高的细胞密度及活力。Kim等[23]研究发现使用ATF Perfusion,细胞密度的峰值能达到130×106cells/ml。Xu等[29]报道ATF Perfusion细胞密度维持在40×106cells/ml,培养时间能维持40 d,同时产品的表达量和质量能保持一致。
4 小结
强化工艺的优点可以总结为更快(缩短生产周期)、更省(提高厂房利用率、在线过程分析技术可降低运营成本、自动化的引入可减少人为犯错成本)及更好(稳定卓越的产品质量、更高的产能)。然而,在成功进行商业生产之前,仍然存在一些必须克服的挑战,包括:如何降低巨大的成本压力,如何通过风险控制让变化可控。可以预期,随着研究工作的深入,下一代生物工艺实现工艺强化,降本增效,向连续流方向发展。

