吉林省两株猪源化脓隐秘杆菌比较基因组学分析
赵 丹,卢殿杰,于文慧,庄科勤,徐菁岐,董文龙
吉林农业科技学院动物科技学院,吉林吉林市 132109
化脓隐秘杆菌原称化脓棒状杆菌、化脓放线菌,从隶属于隐秘杆菌属,于1997年命名为化脓隐秘杆菌[1]。该菌革兰氏染色阳性,无鞭毛,无牙孢,无荚膜;在20~40 ℃范围皆可生长,而37 ℃最适宜[2];在普通琼脂培养基上形成针尖大小的菌落,在血琼脂培养基上可形成β-溶血环,需氧厌氧条件下均可生长,且厌氧环境相比需氧来说该菌长速更快[3],主要见于牛、羊、猪等易感动物的黏膜和皮肤,是动物黏膜上的共生体,寄生于多种动物的乳腺、泌尿生殖道、呼吸道、胃肠道黏膜[4,5],并且其存在于动物大部分的局部感染和全身感染中。化脓隐秘杆菌可感染患病动物的肺、心内膜、子宫等内脏组织,引起肺炎、心内膜炎、子宫内膜炎等疾病的化脓性病变[6]。其中一定量的感染是内源性的,可引起乳腺炎及孕期牛的流产,给畜牧业造成重大经济损失。同时,据相关研究表明,化脓隐秘杆菌不仅对动物具有一定致病性,对人也是如此[7],且目前尚无防治该细菌感染的有效疫苗,防治主要依靠传统的抗菌药。但抗菌药滥用导致一些病原菌产生了耐药性,甚至出现多重耐药性,使抗菌药治疗效果减弱,治疗和养殖成本增多[8]。
全基因组测序是微生物研究常用的方法之一,主要通过PacBio RS II等技术将菌株的全部基因片段进行测序。微生物基因组测序的研究主要围绕病原微生物和模式微生物进行,通常所说的微生物包括细菌、古细菌、真核微生物和病毒,
它们的基因组通常都比较小,基因组序列与结构功能信息能更快速及时地得到,从而更好地揭示其物种的遗传学、生物学特性。随着基因组学、比较基因组学以及筛选差异基因技术的发展与应用,它们的基因组通常都比较小,基因组序列与结构功能信息能及时得到,全基因组核酸测序逐渐成为了值得信赖的鉴定方法[9]。通过全基因组测序,可以对菌株的所有遗传信息进行分析鉴定,对特殊的基因组进行比较分析,从而得出各种基因型微生物的特性。
近几年,关于化脓隐秘杆菌的研究逐渐增多。该菌株特性之一是易造成动物源化脓性感染,但目前关于受此感染影响下进行的化脓全基因组测序基因比较的报道较少。基于以上情况,本研究从吉林省不同地区的猪场感染化脓病灶处分离获得2株化脓隐秘杆菌,从两株菌株的亲缘关系入手,进行了一系列比较基因组学分析。
1 材料与方法
1.1 化脓隐秘杆菌的来源
本实验中的菌株分别来自于吉林市某猪场和四平市某猪场的感染化脓隐秘杆菌病死猪患病处分离的两株菌,在此分别命名为TP13、TP14。
1.2 菌株MIC测定
以化脓隐秘杆菌标准株ATCC19411为质控菌株,选用以下多种抗菌药物(环丙沙星、庆大霉素、阿米卡星、红霉素、恩诺沙星、多西环素、磺胺间甲氧嘧啶、氟苯尼考、头孢噻呋、四环素和克林霉素),通过琼脂扩散法测定菌株TP13和菌株TP14的 MIC 值[10]。
1.3 化脓隐秘杆菌全基因组测序
本试验的全基因组测序及比较基因组学分析委托北京百迈克生物科技有限公司完成。首先提取高质量基因组DNA,采用Nanodrop、Qubit和0.35%的琼脂糖-凝胶进行纯度、浓度和完整性检验,并采用BluePippin全自动DNA收集技术对大片段DNA进行收集,进行文件建库。然后将原始资料进行统计、质量控制,并进行基因组组装、校正和优化,而后分析测序基因组组分、图谱等内容,最终得到基因组相关信息。
1.4 化脓隐秘杆菌基因组组分分析
使用软件Prodigal、RepeatMasker、tRNAscan-SE和 Infernal1.1、GenBlastA和 GeneWise、CRT、IslandPath-DIMOB、PhiSpy分别对菌株TP13与菌株TP14的编码基因、重复序列、非编码RNA、假基因、CRISPR序列、基因岛和前噬菌体进行预测。
1.5 基因组功能注释
将菌株TP13和菌株TP14预测得到的基因 蛋 白 质 序 列 与UniPort(Swiss-prot和TrEMBL)、GO(Gene Ontology)、Nr(Non-Redundant Protein Sequence Database)、eggNOG、Pfam、CAZy(Carbohydrate-active enzymes database)、TCDB(Membrane Transport Protein)、KEGG(Kyoto Encyclopedia of Genes and Genomes)、CARD(Comprehensive Antibiotic Research Database)、VFDB(Virulence Factors Database)、PHI-base(Pathogen Host Interactions Database)等功能数据库进行比对分析。
1.6 比较基因组学分析
在全基因测序的研究基础上,将菌株TP13和菌株TP14的全基因组测序结果中的蛋白序列和参考基因组的蛋白序列进行家族分类,统计出测序菌株和参考菌株的特有基因,之后对于基因家族特有基因分析,并将其结果制成Venn图。采用软件MCScanX将测序样品与每一个参考基因组都成对绘制共线性图,以获得各基因组之间的共线性关系,以便近一步对基因的共线性分析。同时再利用PAML软件计算Ka/Ks,分析Ka/Ks比值大于1的快速进化基因情况。
2 结果与分析
2.1 MIC试验结果
分别对菌株TP13和菌株TP14进行抗菌药物敏感性试验,发现菌株TP13与菌株TP14的耐药表型一致,均对红霉素、四环素、克林霉素、强力霉素表现为耐药(表1)。

表1 TP13和TP14对抗菌药物的敏感性试验结果
2.2 全基因组测序及分析
根据全基因组测序结果比对分析,TP13的总碱基数有906 647 070个。经近一步过滤接头、低质量及短片段的reads后,一共得到了883 856 007个碱基,其基因组长度为2 382 247 bp。组装矫正后,得到了一个Contig,长度为2 382 247 bp,呈循环状。GC含量为59.36%,编码基因有2 125个,基因序列总长度为2 154 018 bp,重复序列含量占25%,非编码一共有63个,假基因数有0个,基因岛有4个,前噬菌体数为3,CRISP序列有4个。
TP14的总碱基数为712 462 382个。经过clean reads后,得到了690 331 224个碱基,基因组的非连续长度为2 384 675 bp。组装后得到了一个Contig,长度为2 384 675 bp,属于染色体,呈循环状。GC含量为59.36%,编码基因有2124个,基因序列总长度为2 154 834 bp,重复含量占24%,非编码基因一共含有63个,假基因数有0个,基因岛有4个,前噬菌体数为2,CRISP序列有4个 (表 2)。
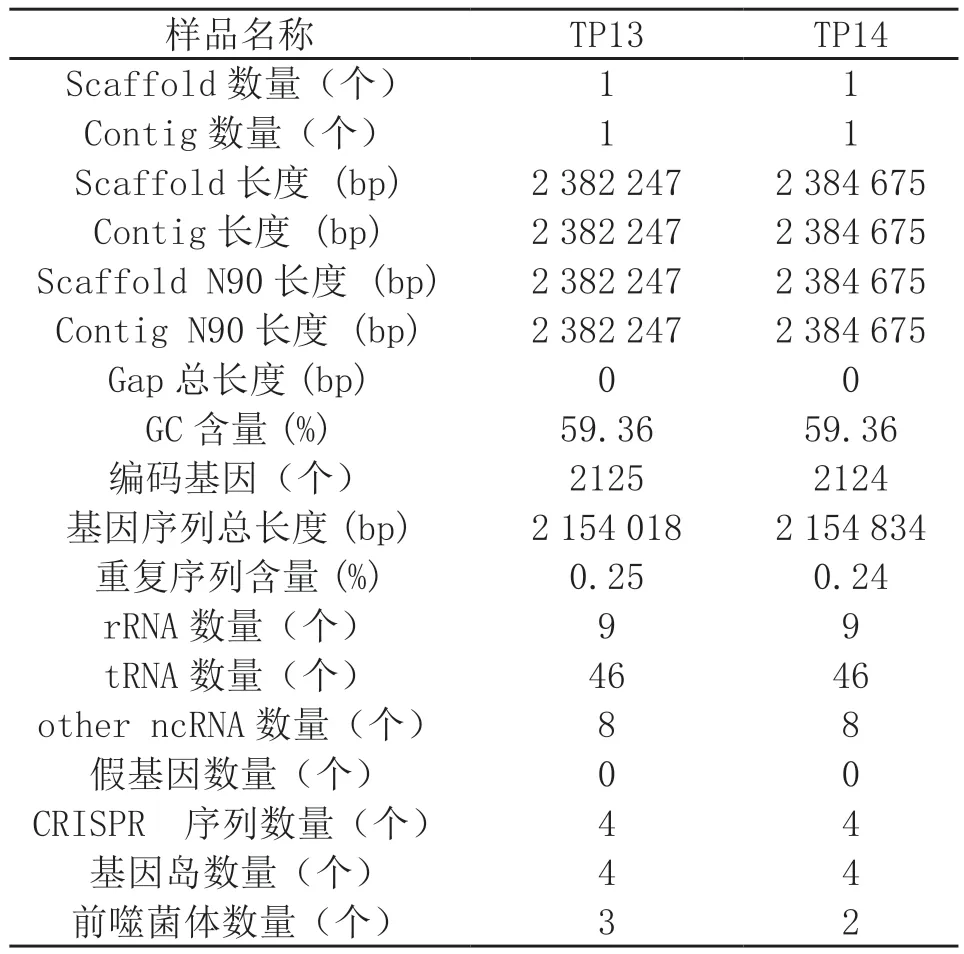
表2 TP13与TP14全基因组测序结果统计
2.3 基因功能注释
将菌株TP13和TP14的全基因组测序结果与多种功能数据库进行比对后发现:菌株TP13和菌株TP14均有85个碳水化合物酶类基因,573种转运蛋白,3个抗生素抗性基因(tet(33)、ErmX、tetW)。将菌株TP13与菌株TP14进行相互对比后发现,其不同之处主要在于病原与宿主互作因子与致病因子的数量,菌株TP13具有674个病原与宿主互作因子,334个致病因子,而菌株TP14有675个病原与宿主互作因子,333个致病因子(表3)。
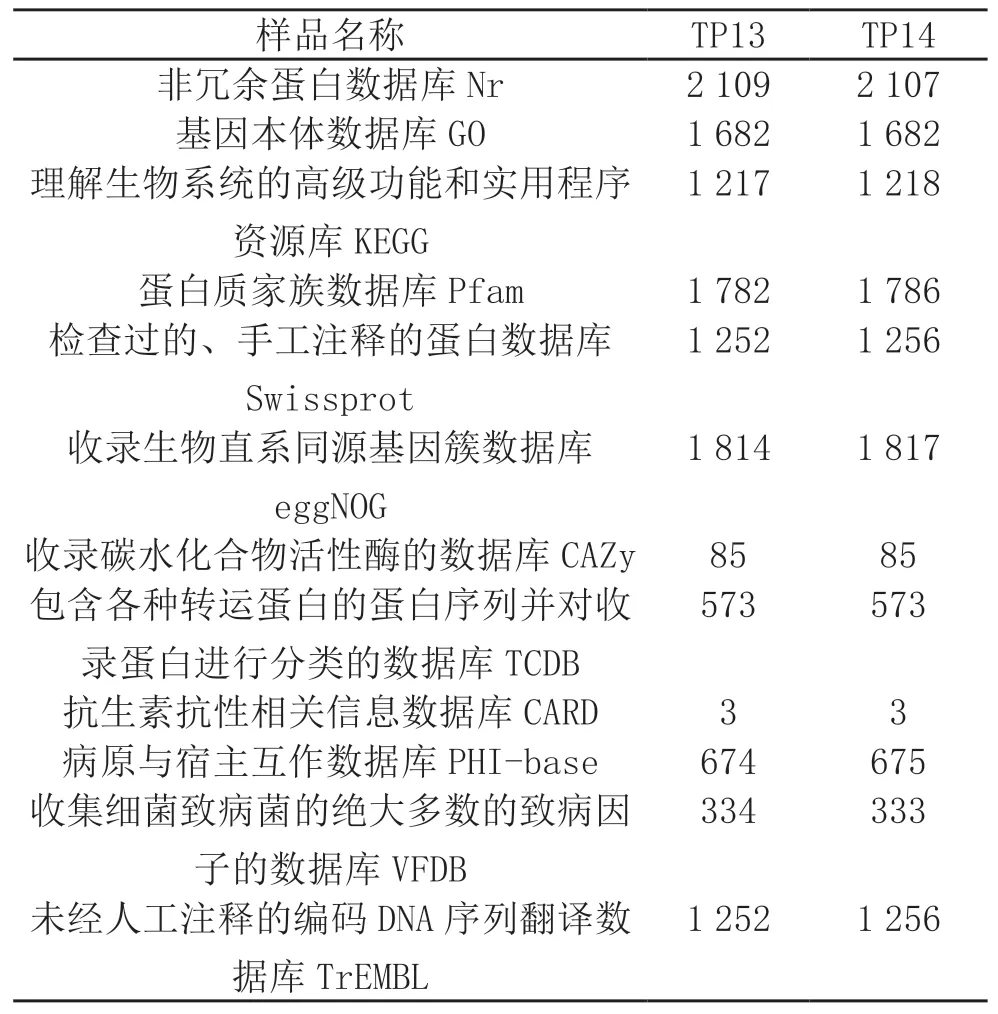
表3 TP13与TP14基因功能注释结果
2.4 比较基因组学分析
2.4.1 Venn图分析:通过OrthoMCL软件制作TP13与TP14的韦恩图,对于参与家族聚类的基因来说,菌株TP13基因家族有2 120个,菌株TP14基因家族有2 119个,其中有2 094个基因家族是重叠的,其基因家族共有率高达约99.95%。而菌株TP13具有1个特有家族,表明菌株TP13与菌株TP14可能是由同一化脓隐秘杆菌进化而来,是2株亲缘较为接近的化脓隐秘杆菌。
2.4.2 基因的共线性:将菌株TP13与菌株TP14的蛋白序列分别与每一个参考基因组的蛋白序列进行BLAST比对,然后根据同源基因在基因组序列上的位置信息,得到核酸水平上的共线性关系。用软件MCScanX对测序样品与各参考基因组都成对绘制共线性图。发现菌株TP13和菌株TP14存在大量同源性基因,共线性关系显著。由此说明菌株TP13与菌株TP14确实具有共线性。
2.4.3 快速进化基因检测:Ka是指非同义替换点替换次数,Ks是指同义替换位点替换次数,Ka/Ks表示非同位替换点替换次数与同义替换位点替换次数之间的比值。此比值能够判定在此蛋白编码基因上是否存在选择性的压力。而具体分析比值内容可参考核苷酸变异,没有引起氨基酸变化的核苷酸变异被称为同义性突变,反之则为非同义突变,同义突变不受自然选择,而非同义突变受自然选择作用。当Ka/Ks>1时,被认为有正选择效应(positive selection);若Ka/Ks=1,则认为存在中性选择(neutral evolution);而Ka/Ks<1,则认为有纯化选择作用。下列表格中是菌株TP13与TP14的Ka/Ks值,大部分的Ka/Ks均小于1,说明菌株TP13与TP14大部分都受纯化选择作用,存在极少部分Ka/Ks值大于1,说明还是有少数基因受环境因素有正选择效应(表4)。

表4 TP13和TP14 Ka/Ks值
3 讨论
化脓隐秘杆菌是一种对反刍家畜和猪都有很大影响的共生条件性病原,也能使野生动物[11]发生感染,例如化脓隐秘杆菌能导致白尾鹿的颅内化脓性脑膜炎,而白尾鹿又是化脓隐秘杆菌的保藏宿主,对家畜有潜在的危害。在运输、寒冷、断奶及其他异常条件刺激时,动物的免疫力会降低,而体内的化脓隐秘杆菌或已经处于隐性感染情况下的化脓隐秘杆菌大量增殖,则会增加疾病的发生或恶化。化脓隐秘杆菌通常也是动物体内的正常菌群组成之一,常寄生于上呼吸道和消化道黏膜,主要引起猪、牛、羊等经济型动物多器官和黏膜发生化脓性感染,严重感染可引起多重器官衰竭,最后形成脓毒败血症而导致动物死亡[12]。化脓隐秘杆菌的毒性取决于多种毒力因子,不同的毒力因子之间存在着协同效应,并且细菌可以在不同宿主中差异表达各种毒力基因而引发不同的感染症状。目前已发现的化脓隐秘杆菌毒力因子有化脓隐秘杆菌溶血素[13]、胶原结合蛋白(CbpA)[14]、神经氨酸酶(Nan)[15]及菌毛合成蛋白(Fim)[16]等。这些毒力因子对化脓隐秘杆菌在不同宿主体内的栖居状态和引发各种感染过程均发挥了重要作用。
近年来,由于抗生素的不合理使用甚至滥用,导致越来越多的耐药菌株出现,并在区域内造成大规模耐药菌株的流行现象,多地的化脓隐秘杆菌均对β-内酰胺类、大环内酯类、四环素类药物出现了不同程度的耐药现象。在治疗过程中,由于药物到达病灶部位的药量有限,因此在化脓隐秘杆菌治疗中,抗生素常常不起作用,并且化脓隐秘杆菌可持续存在于易感动物体内,患病常呈散发,无明显的季节性,但由其引发的奶牛乳房炎有明显的季节性。化脓隐秘杆菌的耐药机制有很多种,其中一种是由耐药基因介导而引起的耐药特性,本研究所分离菌株TP13与菌株TP14均携带tet(33)、ErmX、tetW 3种耐药基因,这与赵敬翠等人研究结果相似,菌株对四环素类抗菌药物的耐药特性多由四环素耐药基因所介导[17]。赵克雷等研究发现了化脓隐秘杆菌耐药性的产生是受其耐药基因的表达、突变、转移和传递所致,同时也通过质粒、整合子-基因盒系统等可移动元件从外界得到了耐药基因,发现了灭活酶的产生、生物被膜的形成、主动排外机制均能使化脓隐秘杆菌产生耐药性。而本研究在参考以上观点的基础上,重点对吉林省不同地区耐药表型相似的猪源化脓隐秘杆菌进行全基因组测序与比较基因组学分析的研究,证实了菌株TP13与菌株TP14是源于不同地区发现但亲缘关系相近的化脓隐秘杆菌。由此进一步推测化脓隐秘杆菌菌株的亲缘性产生的原因,大概率是受现实条件下对家畜动物运输买卖影响,由动物的异地流动,导致了其携带病菌的转移流行,最终使菌株在不同生存环境下进一步进化变异,产生了发源地不同但亲缘性相近的流行菌株。这一研究发现,或可表明亲缘性对探讨各类菌株流行与变化所发挥的重要作用。而借助亲缘性这一角度,深入了解不同菌株存在的相似的流行与进化特性,便能帮助我们从病菌本源入手,观察菌株本体特质,追踪病菌流行轨迹,总结动物染病发病规律,从而为更好应对不同地区的各类动物疾病提供更多可行性的解决方法。
——以多重共线性内容为例