柴胡皂苷A通过调节ERK/NF-κB信号通路减轻小鼠玫瑰痤疮样炎症反应
王莹,王丽,徐俊涛,肖莉
玫瑰痤疮是一种慢性炎症性皮肤病,全球患病率超过5%[1],其临床特征是红斑、毛细血管扩张、丘疹或脓疱,辛辣食物、饮料以及生理和心理刺激都可能会引发或加重该疾病[2]。玫瑰痤疮的治疗方法多种多样,包括抗生素、类维生素A、糖皮质激素和基于光照的疗法[3]。但应用维A酸或壬二酸可能会引起干燥和明显的烧灼感,长期使用抗生素可能会产生耐药性,口服异维A酸可诱使胎儿器官发生障碍和骨质减少。因此,需要开发具有较少副作用的新药物来治疗玫瑰痤疮[4]。柴胡皂苷A(saikosaponin A,SSA)是从柴胡中分离出来的具有生物活性的物质,其具有抗病毒、抗癌、保肝、免疫调节和抗炎等活性[5]。据报道,SSA通过抑制炎症反应来减轻特应性皮炎小鼠皮肤损伤[6],而SSA能否减轻小鼠玫瑰痤疮样炎症反应尚不明确。相关研究显示,抑制细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)/核因子κB(nuclear factor-κB,NF-κB)信号通路可有效减少过度炎症及随后的特应性皮炎样病变[7]。抑制NF-κB可减轻丙酸杆菌诱导的痤疮小鼠炎症反应[8]。表明ERK/NF-κB信号通路可能是治疗炎症性相关疾病的潜在靶点。而SSA能否通过调控ERK/NF-κB信号通路抑制玫瑰痤疮小鼠炎症反应尚不清楚。因此,本研究主要探究SSA对玫瑰痤疮小鼠炎症反应的影响以及其作用机制。
1 材料与方法
1.1实验动物 84只,7周龄,体重为20~22 g的SPF雌性BALB/c小鼠获自广东维通利华实验动物技术有限公司,生产许可证号为SCXK(粤)2022-0063。本研究中进行的所有动物实验均经本院动物伦理委员会批准,符合有关动物护理和使用的机构指南。
1.2主要试剂 柴胡皂苷A(规格:20 mg,纯度98%)购自成都曼思特生物公司;盐酸多西环素(doxycycline hyclate,DH)购自北京普非生物公司;重组小鼠表皮生长因子(rmEGF)购自上海淳麦生物公司;小鼠白细胞介素-6(interleukin-6,IL-6)、S100钙结合蛋白A9(S100 calcium binding protein A9,S100A9)、肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)ELISA试剂盒购自上海赫果生物公司;兔源一抗血小板内皮细胞黏附分子1(platelet endothelial cell adhesion molecule 1,CD31)、ERK1/2、NF-κB p65、p-ERK1/2、p-NF-κB p65、GAPDH及辣根过氧化物酶(HRP)标记的羊抗兔二抗均购自英国Abcam公司。
1.3玫瑰痤疮小鼠模型的构建[9]将小鼠适应性喂养一周后,剃除小鼠背部3 cm×3 cm范围处毛发,并向该处注射320 μmol/L LL-37,每次注射40 μL,每隔12 h注射1次,共注射4次。
1.4动物分组及给药 按照随机数字表法将小鼠随机分为Ct组、Model组、低剂量SSA组(SSA-L组)、高剂量SSA组(SSA-H组)、DH组、rmEGF组(ERK激动剂)、SSA-H+rmEGF组,每组12只。除Ct组外,其他组小鼠均需按照1.3所述方法构建玫瑰痤疮模型,Ct组小鼠背部注射4次等量的PBS。造模24 h后,进行给药处理,SSA-L组、SSA-H组[10]、DH组[11]小鼠分别灌胃37.5 mg/kg SSA、75 mg/kg SSA、30 mg/kg DH,且均需尾静脉注射等体积的生理盐水;rmEGF组[12]小鼠需尾静脉注射15 μg/kg rmEGF,且需灌胃等量的生理盐水;SSA-H+rmEGF组小鼠需灌胃75 mg/kg SSA且需尾静脉注射15 μg/kg rmEGF;Ct组、Model组小鼠均需灌胃等量的生理盐水且尾静脉注射等量的生理盐水。每天给药一次,共给药8周。
1.5标本收集 选取每组全部大鼠进行背部注射部位皮肤红斑面积及红斑程度评分的测定;上述检测结束后,处死小鼠,收集背部注射部位皮肤,分为两部分(每部分包含6只小鼠背部注射部位皮肤),一部分固定于4%多聚甲醛中用于HE染色、甲苯胺蓝染色、免疫荧光染色,另一部分冻存于-80 ℃中用于ELISA和Western blot实验。
1.6皮肤红斑面积及红斑程度评分的测定 观察各组小鼠背部注射部位皮肤皮损变化,并进行红斑程度评分,无红斑记为0分,隐约可见红斑记为1分,呈现出边界模糊的淡红斑记为2分,表现为边界清晰的红斑记为3分,红斑颜色深且边界清晰记为4分。利用Image J软件测定皮肤红斑面积。
1.7HE染色检测小鼠背部注射部位皮肤病理损伤程度 小鼠皮肤组织用4%多聚甲醛固定,石蜡包埋,切成5 μm厚的切片,然后进行HE染色,并在光学显微镜下观察小鼠背部注射部位皮肤病理损伤程度。
1.8甲苯胺蓝染色检测小鼠背部注射部位皮肤肥大细胞浸润情况 小鼠皮肤组织用4%多聚甲醛固定,石蜡包埋,切成5 μm厚的切片,然后进行甲苯胺蓝染色,并在光学显微镜下观察呈蓝紫色的肥大细胞数变化。
1.9免疫荧光染色检测CD31表达 将组织切片用柠檬酸处理用于抗原修复,并与一抗CD31在4 ℃孵育过夜。然后将组织切片与Alexa Fluor®488标记的二抗在室温下放置40 min。使用荧光显微镜捕获图像并使用Image J分析软件进行分析。其中DAPI 用于染色细胞核,CD31用于标记血管内皮细胞。
1.10ELISA实验检测IL-6、S100A9、TNF-α表达 严格按照试剂盒说明书检测小鼠背部注射部位皮肤中IL-6、S100A9、TNF-α表达。
1.11Western blot实验检测p-ERK1/2、p-NF-κB p65蛋白表达 使用RIPA裂解缓冲液从小鼠背部注射部位皮肤匀浆中分离总蛋白质,将蛋白质进行定量、电泳、转膜、封闭后,将膜与一抗ERK1/2(1∶1 000)、NF-κB p65(1∶2 000)、p-ERK1/2(1∶2 000)、p-NF-κB p65(1∶2 000)、GAPDH(1∶1 000)在4 ℃下过夜孵育,用二抗洗涤膜并在室温下孵育2 h。洗涤后,使用ECL试剂对膜进行显影。通过Image J软件分析蛋白灰度值。
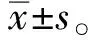
2 结果
2.1SSA对各组小鼠背部注射部位皮肤红斑面积及红斑程度评分的影响 Ct组小鼠背部注射部位皮肤正常;Model组小鼠背部注射部位皮肤表现出明显的红斑。与Ct组比较,Model组红斑面积及红斑程度评分升高(LSD-t=44.94、88.76,P<0.05);与Model组比较,SSA-L组、SSA-H组、DH组小鼠背部注射部位皮肤红斑有所改善,红斑面积及红斑程度评分降低(LSD-t=13.68、34.20、35.17;18.78、64.01、64.58,P<0.05),rmEGF组小鼠背部注射部位皮肤红斑严重,红斑面积及红斑程度评分升高(LSD-t=15.63、22.76,P<0.05);与SSA-H组比较,SSA-H+rmEGF组小鼠背部注射部位皮肤红斑严重,红斑面积及红斑程度评分升高(LSD-t=13.68、29.02,P<0.05),见图1和表1。

图1 各组小鼠背部注射部位皮肤损伤情况

表1 SSA对各组小鼠背部注射部位皮肤红斑面积及红斑程度评分的影响
2.2SSA对各组小鼠背部注射部位皮肤病理损伤的影响 Ct组小鼠皮肤组织结构正常,无炎性细胞浸润;Model组小鼠皮肤屏障受损,表皮破溃,表层有大量炎性渗出细胞;与Model组比较,SSA-L组、SSA-H组、DH组小鼠皮肤组织病理损伤减轻,rmEGF组小鼠皮损更为严重,深层结缔组织有损伤;与SSA-H组比较,SSA-H+rmEGF组小鼠皮肤组织病理损伤加剧,见图2。
2.3SSA对各组小鼠背部注射部位皮肤肥大细胞浸润的影响 与Ct组(1.25±0.02)个/视野比较,Model组肥大细胞数(12.27±1.05)个/视野增多(LSD-t=28.66,P<0.05);与Model组比较,SSA-L组、SSA-H组、DH组肥大细胞数(9.13±0.72)个/视野、(3.62±0.15)个/视野、(3.57±0.14)个/视野减少(LSD-t=8.17、22.50、22.63,P<0.05),rmEGF组(16.69±1.18)个/视野增多(LSD-t=11.50,P<0.05);与SSA-H组比较,SSA-H+rmEGF组肥大细胞数(6.78±0.22)个/视野增多(LSD-t=8.22,P<0.05),见图3。

图3 甲苯胺蓝染色检测小鼠背部注射部位皮肤肥大细胞浸润情况 (×200)
2.4SSA对各组小鼠背部注射部位皮肤中毛细血管分布的影响 与Ct组(12.22±1.05)个/视野比较,Model组CD31阳性毛细血管数(33.36±1.57)个/视野增多,且呈现出明显的扩张状态(LSD-t=27.39,P<0.05);与Model组比较,SSA-L组、SSA-H组、DH组CD31阳性毛细血管数(26.67±1.21)个/视野、(15.59±1.24)个/视野、(15.63±1.18)个/视野减少(LSD-t=8.67、23.02、22.97,P<0.05),毛细血管变细,rmEGF组(38.82±1.66)个/视野增多,且表现出扩张状态(LSD-t=7.07,P<0.05);与SSA-H组比较,SSA-H+rmEGF组CD31阳性毛细血管数(21.15±1.34)个/视野增多,毛细血管扩张(LSD-t=7.20,P<0.05),见图4。
2.5SSA对各组小鼠背部注射部位皮肤中炎性因子IL-6、S100A9、TNF-α表达的影响 与Ct组比较,Model组IL-6、S100A9、TNF-α表达升高(LSD-t=25.30、20.88、20.68,P<0.05);与Model组比较,SSA-L组、SSA-H组、DH组IL-6(LSD-t=8.17、22.36、22.49,P<0.05)、S100A9(LSD-t=7.40、17.28、17.57,P<0.05)、TNF-α(LSD-t=6.40、18.65、18.72,P<0.05)表达均降低,rmEGF组IL-6、S100A9、TNF-α表达升高(LSD-t=9.03、13.53、8.62,P<0.05);与SSA-H组比较,SSA-H+rmEGF组IL-6、S100A9、TNF-α表达升高(LSD-t=6.26、6.20、7.73,P<0.05),见图5。

图4 免疫荧光染色检测小鼠背部注射部位皮肤中CD31的表达 (×200)

Note: Compared with Ct group,aP<0.05; compared with Model group, bP<0.05; compared with SSA-L group, cP<0.05; compared with SSA-H group, dP<0.05.
2.6SSA对各组小鼠背部注射部位皮肤中ERK/NF-κB信号通路相关蛋白表达的影响 与Ct组比较,Model组p-ERK1/2、p-NF-κB p65蛋白表达升高(LSD-t=21.65、28.45,P<0.05);与Model组比较,SSA-L组、SSA-H组、DH组p-ERK1/2、p-NF-κB p65蛋白表达降低(LSD-t=5.20、17.75、18.62;10.39、24.38、23.93,P<0.05),rmEGF组p-ERK1/2、p-NF-κB p65蛋白表达升高(LSD-t=5.20、5.87,P<0.05);与SSA-H组比较,SSA-H+rmEGF组p-ERK1/2、p-NF-κB p65蛋白表达升高(LSD-t=8.66、10.39,P<0.05),见图6。

Note:1 indicated Ct; 2 indicated Model; 3 indicated SSA-L; 4 indicated SSA-H; 5 indicated DH; 6 indicated rmEGF; 7 indicated SSA-H+rmEGF; compared with Ct group,aP<0.05; compared with Model group, bP<0.05; compared with SSA-L group, cP<0.05; compared with SSA-H group, dP<0.05.
3 讨论
玫瑰痤疮是临床常见的慢性炎症性皮肤病,其影响全球约5.5%的人口,并可能导致毁容、影响情绪和生活质量下降等[13]。传统的玫瑰痤疮治疗方法,如抗生素、类维生素A等均不能取得满意的疗效[14]。抗菌肽LL37因其在玫瑰痤疮患者皮肤和LL37诱导的玫瑰痤疮表型的小鼠模型中的高表达而被认为是玫瑰痤疮发生的一种关键分子,并且已被广泛接受的是,可以进行皮内注射LL37以建立玫瑰痤疮小鼠模型[15-16]。本研究利用上述方式构建玫瑰痤疮小鼠模型,结果显示,Model组小鼠背部注射部位皮肤表现出明显的红斑表型,与Ct 组比较,Model组红斑面积及红斑程度评分升高,提示玫瑰痤疮小鼠模型构建成功。S100A9作为一种关键的炎症介质,其在玫瑰痤疮中上调表达[13];IL-6、TNF-α作为常见用于衡量机体炎症水平的因子,已有研究表明,抑制IL-6、TNF-α表达可减弱玫瑰痤疮样表型和炎症反应[17]。本研究显示,Model组小鼠皮肤组织增厚,有大量炎性细胞、肥大细胞浸润,表明Model组小鼠炎症反应加剧。尽管玫瑰痤疮的病理生理学机制尚不清楚,但多种因素,如新血管生成增加与其发病机制有关[18]。本研究显示,与Ct组比较,Model组血管生成的关键标志物CD31阳性毛细血管数增多,且呈现出明显的扩张状态,表明Model组小鼠存在毛细血管扩张及增多现象。提示LL37进入表皮后,引起了IL-6、S100A9、TNF-α等炎性因子增多,激活了肥大细胞,长期的炎性刺激导致了毛细血管的增生与扩张,进而加剧了皮肤的炎症反应。因此,抑制炎症反应及血管生成可能是治疗玫瑰痤疮的有效策略之一。
SSA是柴胡最有效的成分之一,具有较强的抗炎作用[19]。据报道,SSA可抑制大鼠急性脊髓损伤早期组织和血清中TNF-α、IL-6水平[20];SSA可改善过敏性鼻炎小鼠鼻部炎症[21];SSA通过抑制肿瘤血管生成来抑制结直肠肿瘤的生长[22];SSA可抑制坐骨神经损伤大鼠炎症反应及瘢痕形成[23]。以上研究表明SSA具有抑制炎症反应及血管生成的作用。而关于SSA对玫瑰痤疮小鼠炎症反应及血管生成的影响尚未见报道。本研究显示,SSA可抑制玫瑰痤疮小鼠炎症反应、毛细血管增生及扩张,且SSA剂量越高,抑制作用越明显。盐酸多西环素(DH)是临床上治疗玫瑰痤疮常用药物[24],本研究选择此药物为阳性治疗药物,结果发现,SSA-H组与DH组比较,对应指标变化差异无统计学意义,提示SSA可能是玫瑰痤疮的潜在治疗药物。
激活的ERK1/2通过激活NF-κB来刺激细胞分泌炎性细胞因子进而加重机体的炎症反应[25]。已有研究表明,抑制ERK/NF-κB通路可减轻慢性肾脏病大鼠肾脏炎性细胞浸润[26];抑制ERK/NF-κB通路可抑制胶质母细胞瘤形成过程中的血管生成[27];激活NF-κB可促进玫瑰痤疮的发生与发展[28]。以上研究证实了ERK/NF-κB通路的促炎及促血管生成作用,该通路可能成为治疗玫瑰痤疮的关键突破口之一,本研究结果与其一致。本研究发现,与Ct 组比较,Model组p-ERK1/2、p-NF-κB p65蛋白表达升高;与Model组比较,rmEGF组p-ERK1/2、p-NF-κB p65蛋白表达升高,提示ERK/NF-κB通路可能参与了玫瑰痤疮小鼠炎症反应、毛细血管增生及扩张过程。SSA可降低玫瑰痤疮小鼠皮肤中p-ERK1/2、p-NF-κB p65蛋白的表达,且SSA剂量越高,降低作用越明显,提示SSA可能通过抑制ERK/NF-κB通路减轻玫瑰痤疮小鼠炎症反应。为了验证该猜想,本研究在高剂量SSA作用的基础上再加上ERK激动剂rmEGF处理Model组小鼠,结果显示,rmEGF减弱了高剂量SSA对玫瑰痤疮小鼠炎症反应的抑制作用。证实猜想是正确的,即SSA可能通过抑制ERK/NF-κB通路减轻玫瑰痤疮小鼠炎症反应。
综上所述,SSA可能通过抑制ERK/NF-κB通路减轻玫瑰痤疮小鼠炎症反应。该研究结果强调了SSA可作为LL37诱导的皮肤炎症疾病的有前途的药物。然而,本研究尚存在不足之处,SSA对玫瑰痤疮小鼠炎症反应的抑制作用可能还涉及其他通路,本研究尚未涉及,这将是后续研究的重点。

