玉米秸秆溶解性有机质分级组分的分子光谱
周向军,赵燕娥
(1.天水师范学院生物工程与技术学院,甘肃 天水 741001;2.甘肃省农业固体废弃物资源化利用重点实验室,甘肃 天水 741001)
农作物秸秆废弃物是一种数量极大的可再生生物质资源,富含碳水化合物、纤维素和半纤维素类等有机物。秸秆还田后不仅可以改善土壤孔隙结构,提高土壤有机质含量和微生物活性等,而且其释放的溶解性有机质(DOM)还会对土壤有机质的结构组成等产生影响[1]。DOM 是指具有多种官能团且能通过0.45 μm滤膜的一类非均质水溶性有机化合物[2]。DOM 作为秸秆的重要有机组分之一,不仅可为土壤微生物提供碳源和能量来源,而且还可作为各种环境污染物的重要载体,对其迁移转化和最终归趋等环境行为产生重要影响。Chen 等[3]对不同腐解阶段水稻秸秆的DOM 进行表征,结果表明,DOM 的结构和官能团具有高度异质性,芳香性基团为DOM 中最为稳定的部分。余旭芳等[4]对小麦秸秆堆肥过程中DOM 的结构和组成进行研究,结果表明,堆肥前期DOM 降解较为迅速,类蛋白发生显著降解,类腐殖质逐渐成为DOM 的主要组分。韦梦雪等[5]对川西平原水稻/油菜秸秆DOM 的光谱特征进行研究,结果表明,腐解过程中DOM 组分的光谱学特性差异明显,其中,芳香性组分主要是在腐解的前10 d 内释放,难降解性组分则是在腐解后期被释放。曹莹菲等[6]对玉米/大豆秸秆腐解过程的结构变化进行表征,结果表明,随着腐解时间的延长,糖类、酰胺类和脂肪族类等易分解化合物首先被直接分解,而芳香类等难降解化合物则是先形成羧酸酯类或脂肪族类后再逐渐被分解,但整体上秸秆还田后将倾向于转化为类胡敏酸物质。李艳等[7]通过三维荧光光谱和平行因子分析法,研究了秸秆和牛粪发酵过程中DOM 的荧光光谱特征,结果显示,牛粪与秸秆体积比为6∶4 时,堆肥过程中腐殖化效率最高。张海洋等[8]对水环境中水稻和小麦秸秆DOM 的组成和光化学特性进行研究,结果表明,秸秆DOM 释放过程可分为物理淋溶、易分解组分降解和难分解组分降解3 个阶段,并指出了今后秸秆源DOM 在生态环境领域的重点研究方向。
虽然已有学者对秸秆源DOM 进行了相关研究,但大多局限于DOM 混合组分的化学组成和结构特性等,缺少DOM 分级组分的光谱学特性和荧光组分解析等研究。而阐明DOM 分级组分的光谱学特性和荧光组分等,对深入了解秸秆DOM 在农田土壤系统中的腐解过程等具有重要意义。玉米秸秆DOM 组分的结构复杂多样,在不同腐解阶段释放的疏水酸性组分(HOA)、疏水碱性组分(HOB)、亲水性组分(HIM)、酸不溶组分(AIM)和疏水中性组分(HON)的光谱学特性及荧光组分尚不明确。近年来发展的DAX-8树脂法及光谱学技术为分离与解析DOM 组分的化学结构提供了一种可能,也有助于评估DOM 组分对抗生素的吸附行为等[9]。DAX-8 树脂具有选择性强、效率高等优点[10],是DOM 分级分离的有效手段之一。光谱分析可以获得DOM 的分子结构特性,与传统的化学分析以及色谱、质谱和核磁共振等分析手段相比,具有简便快捷、灵敏度高、选择性强、不破坏样品等优点,可迅速实现DOM 组分的定性表征和定量分析[11]。其中,紫外光谱用于分析和揭示DOM 中不饱和化合物的结构组成和性质[12];三维荧光光谱可通过普通寻峰法获得DOM 的荧光组分等[13];同步荧光光谱虽然容易受到拉曼散射的影响,但是能获得较清晰、独特的波谱信息和结构信息[14]。本研究利用DAX-8 树脂分级分离得到玉米秸秆不同腐解阶段的5 种DOM 组分,并采用紫外光谱、三维荧光光谱和同步荧光光谱进行光谱分析及荧光组分解析,以期为秸秆还田后用于降低抗生素类新兴污染物的迁移等提供理论基础。
1 材料与方法
1.1 试验材料
1.1.1 玉米秸秆 玉米秸秆取自天水市郊区农田。将秸秆在阴凉处风干,粉碎后过20 目筛,粒径约1 mm,备用。
1.1.2 试剂 甲醇、HCl、NaOH 等试剂,均为国产分析纯;Supelite DAX-8 树脂,购自Sigma 公司。
1.1.3 仪器 主要仪器有UV-2600 紫外分光光度计〔岛津(中国)有限公司〕、F-7000 荧光分光光度计〔日立(中国)有限公司〕、Centrifuge 5810R 离心机(德国艾本德公司)和YZ1515x 蠕动泵(兰格恒流泵有限公司)。
1.2 试验方法
1.2.1 腐解菌液的制备 2021 年7 月28 日在天水市秦州区农田,采用五点取样法采集黄绵土,弃去杂物后过20 目筛,密封后低温保存,备用。
称取15.00 g 新鲜土壤3 份置于锥形瓶中,加入蒸馏水100 mL,在25 ℃下振荡5 h。取上清液4 000 r/min离心10 min,上清液即为腐解菌液。
1.2.2 玉米秸秆的腐解 称取玉米秸秆粉5.00 g 置于锥形瓶中,加入石英砂30 g、蒸馏水50 mL 和腐解菌液8 mL,用保鲜膜封口,顶部用针扎孔。在25 ℃下120 r/min 恒温避光振荡。分别在第0、5、10、15、25、35 和50 天取样,取样量均为15 mL,取样后及时补充相应体积的蒸馏水。在15 mL 样液中加入蒸馏水15 mL,混匀后用8 层纱布过滤,然后8 000 r/min 离心10 min,上清液经0.45 μm 滤膜过滤后即为DOM[15]。
1.2.3 DOM 组分的提取
1.2.3.1 DAX-8 树脂预处理。将DAX-8 树脂用0.1 mol/L NaOH 浸泡24 h,期间换液5 次,用蒸馏水清洗3 次,每次30 min。加入少量甲醇,65 ℃索氏抽提24 h,用蒸馏水清洗10 次。依次用8 倍柱体积的0.1 mol/L NaOH 淋洗柱子、100 mL 蒸馏水过柱、3 倍柱体积的0.1 mol/L HCl 洗柱、200 mL 蒸馏水淋洗过柱,重复3 次[16]。DAX-8 树脂使用3 次后需进行再生处理。
1.2.3.2 DOM 分级分离。利用恒流泵和层析柱,将DOM 样品在1 mL/min 下上样,用40 mL 蒸馏水淋洗。用10 mL 0.01 mol/L HCl 和30 mL 0.01 mol/L HCl 反洗,收集液为HOB。将非吸附成分调至pH 值2.0,4 000 r/min 离心10 min,将沉淀物用0.1 mol/L NaOH 溶解,即为AIM;将上清液过柱后利用20 mL 0.01 mol/L HCl 淋洗,收集液为HIM;用10 mL 0.1 mol/L NaOH 和30 mL 蒸馏水反洗,收集反洗液为HOA。将DAX-8 树脂用甲醇浸泡过夜,即为HON。每个阶段过柱后,均依次用40 mL 0.1 mol/L NaOH、超纯水、0.01 mol/L HCl、超纯水淋洗层析柱[17]。
1.2.4 DOM 组分的解析
1.2.4.1 紫外光谱。利用紫外分光光度计进行测定。当波长<250 nm 时,DOM 组分易受硝酸盐、亚硝酸盐和溴化物等无机离子的干扰,同时还受大量生色团重叠吸收现象的影响[18],其紫外光谱不易识别。本研究以超纯水为空白进行调零,同时在250~600 nm 波长范围内测定5 种DOM 组分的紫外光谱,波长间隔为0.5 nm。
1.2.4.2 同步荧光光谱。利用荧光分光光度计进行测定。设定条件:光源为150 W 氙灯,PMT 电压700 V,固定波长差(Δλ)为60 nm,扫描速度1 200 nm/min。以超纯水为空白进行调零,同时在250~500 nm 波长范围内扫描5 种DOM 组分的同光荧光光谱。
1.2.4.3 三维荧光光谱。利用荧光分光光度计进行测定。设定条件:Ex 为220~400 nm,Em 为250~550 nm,波长步长10 nm,狭缝5 nm,扫描速度1 200 nm/min,光电倍增管电压700 V。样品稀释以避免高浓度DOM组分内滤效应的干扰,同时以超纯水做空白调零并去除拉曼散射[19]。
2 结果与分析
2.1 DOM 的紫外光谱及特性指标
2.1.1 DOM 的紫外光谱 基于DOM 的疏水性和电荷特性,利用DAX-8 树脂将不同腐解阶段玉米秸秆的DOM 进行分级分离,得到HOA、HOB、HIM、AIM和HON 计5 种组分。从不同腐解阶段5 种DOM 分级组分的紫外光谱(图1~7)可以看出,除腐解第0 天的HOA 组分出现双峰外,其余阶段5 种DOM 组分的紫外吸收值几乎均随波长的增加而降低,表明HOA组分中具有较为丰富的共轭化合物;5 种DOM 组分在500~600 nm 显著降低并进入平台期,表明多芳环类物质含量相对较低;不同腐解阶段同一DOM 组分的吸收光谱形状较为相似,表明相同DOM 组分主要化学官能团较为接近。腐解第0 天时,HOA 组分在300~307 nm 和323~335 nm 存在吸收峰,归属为含不饱和基团较多的类胡敏酸物质[19];腐解第5 天时,HOA 组分仅在278~290 nm 出现新吸收峰,归属为木质素及其衍生物的特征性吸收[20];随后,该峰逐渐减弱甚至趋于消失,表明木质素及其衍生物被不断分解并生成了难降解性的芳香类化合物。HOA 组分的吸收值均高于其它4 种组分,表明DOM 组分中大分子芳香类化合物主要来自HOA。腐解的50 d 内,HON 组分的最大吸收峰基本位于273~283 nm,但峰形存在一定程度的变化,其中腐解第0~5 天时吸收峰较窄、腐解第10~50 天时吸收峰较宽,表明腐解中后期HON 组分进一步被衍生而复杂化。腐解第0 天时,HIM 和HOB组分在262~273 nm 有较弱的吸收峰,归属为含C=C和芳环类化合物;但随后,该吸收峰几乎完全消失,表明2 种组分被进一步降解或转化。腐解第0~5 天时,AIM 组分无明显的吸收峰;但随后,在275~285 nm 出现极弱的吸收峰。

图1 腐解第0 天时不同DOM 组分的紫外光谱Fig.1 UV spectra of different DOM fractions after 0 day of decomposition

图2 腐解第5 天时不同DOM 组分的紫外光谱Fig.2 UV spectra of different DOM fractions after 5 days of decomposition
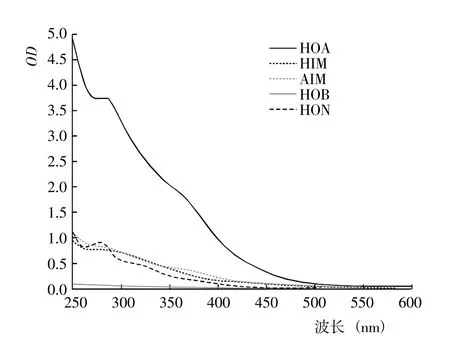
图3 腐解第10 天时不同DOM 组分的紫外光谱Fig.3 UV spectra of of different DOM fractions after 10 days of decomposition

图4 腐解第15 天时不同DOM 组分的紫外光谱Fig.4 UV spectra of different DOM fractions after 15 days of decomposition
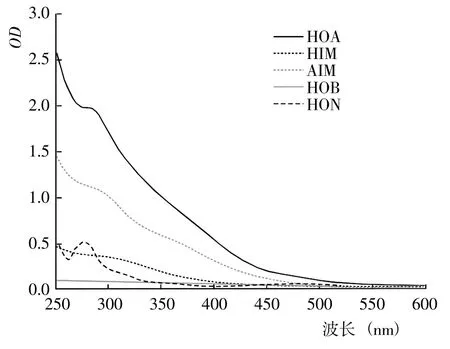
图5 腐解第25 天时不同DOM 组分的紫外光谱Fig.5 UV spectra of different DOM fractions after 25 days of decomposition
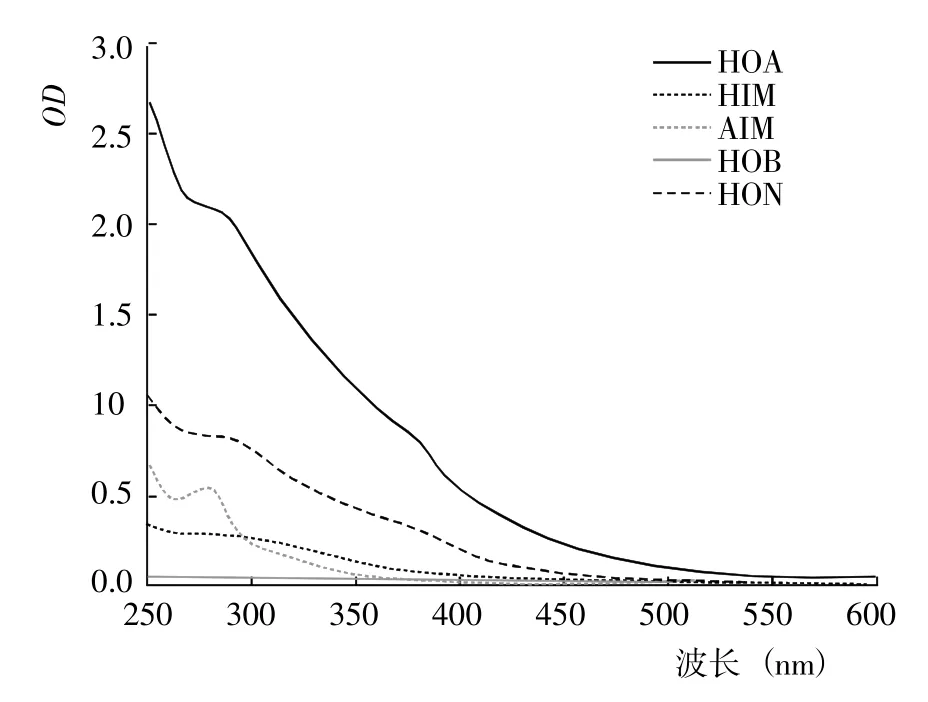
图6 腐解第35 天时不同DOM 组分的紫外光谱Fig.6 UV spectra of different DOM fractions after 35 days of decomposition
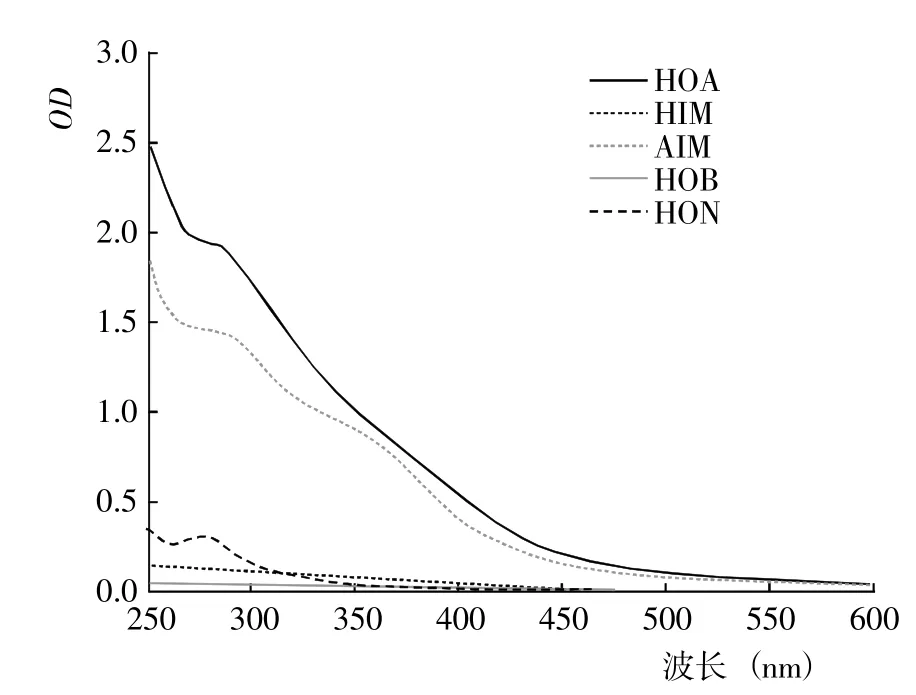
图7 腐解第50 天时不同DOM 组分的紫外光谱Fig.7 UV spectra of different DOM fractions after 50 days of decomposition
2.1.2 DOM 的光谱特性指标E1(E250/E203) 反映了DOM 取代基的状况,与DOM 芳环中-C=O、-COOH、-OH 和-COOR 等的取代数量呈正相关[21],与脂肪链的取代数量呈负相关;E2(E250/E365)与芳香性程度呈负相关[22];E3(E240/E420) 与团聚化程度呈负相关[23];E4(E300/E400)与腐殖化程度呈负相关[24]。
随着腐解时间的延长,5 种DOM 组分的光谱特性指标值变化规律不尽相同(表1)。对E1而言,HOA组分的E1呈先增加后降低并趋于稳定的变化趋势,且均高于腐解第0 天时的指标值;HON 组分的E1呈逐渐降低趋势,且均低于腐解第0 天时的指标值;AIM组分的E1呈先增加后趋于稳定的趋势变化,且均高于腐解第0 天时的指标值;HOB 和HIM 组分的E1呈波动变化趋势。对E2而言,HOA 组分的E2呈先增加后趋于稳定的趋势变化;HOB 和HON 组分的E2呈波动变化趋势;AIM 和HIM 组分的E2基本呈先降低后趋于稳定的趋势变化。对E3和E4而言,HOA、AIM 和HIM 组分的E3和E4均基本呈先降低后趋于稳定的趋势变化;HOB 和HON 组分的E3和E4均呈波动变化趋势。综上所述,HOA、AIM 和HIM 组分的芳环取代基以C=O、COOH、OH 或酯基为主,HON 组分以脂肪链为主,HOB 组分则两者兼有;HOA 组分的芳香性先降低后趋于稳定,HOB 和HON 组分处于动态趋势,AIM 和HIM 组分则先增加后趋于稳定;HOA、AIM 和HIM 组分的团聚化、腐殖化程度先增加后趋于稳定,HOB 和HON 组分则呈动态变化。
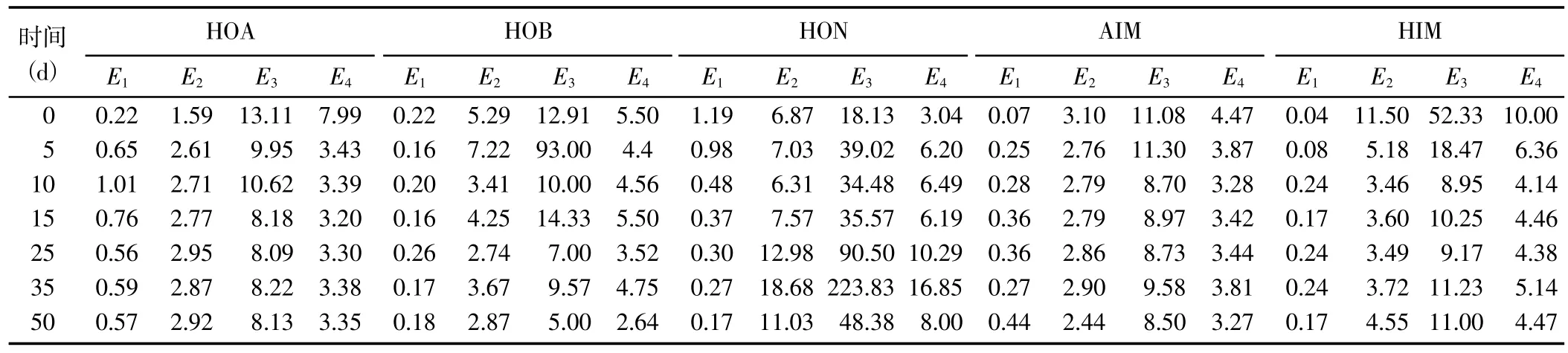
表1 腐解过程中不同DOM 组分光谱特性指标的变化Table 1 Changes in spectral characteristics of different DOM fractions during the decomposition
2.2 DOM 的三维荧光光谱
荧光峰更多反映的是DOM 组分在组成和结构上的差异。DOM 的荧光发色团通常具有π 电子共轭体系,其化学结构、空间构型和化学环境的不同,均会对三维荧光光谱会产生一定的影响[25]。根据荧光峰位置和前人研究[26,27],DOM 分级组分的三维荧光光谱分为5 个区域:类酪氨酸蛋白质(Ex/Em=220~250 nm/280~330 nm)、类色氨酸蛋白质(Ex/Em=220~250 nm/330~380 nm)、类富里酸(Ex/Em=220~250 nm/380~550 nm)、可溶性微生物代谢产物(Ex/Em=250~400 nm/280~380 nm)和类胡敏酸(Ex/Em=>250 nm/380~600 nm)。
经分析,HIM 组分未检测到明显的三维荧光峰。从腐解过程中不同DOM 分级组分的荧光峰类型(表2)可以看出,腐解15 d 后,4 种DOM 组分几乎均以类胡敏酸为主,表明腐解中后期DOM 逐渐团聚化并形成分子量较大的胡敏酸类物质。腐解第0 天时,HOA 组分以类胡敏酸为主;腐解5 d 后,HOA 组分被土壤微生物分解转变为类富里酸物质;随后,类富里酸或其分解产物与其它组分发生团聚作用,进一步形成比较稳定的类胡敏酸物质。腐解第0 天时,HOB组分以类胡敏酸和类富里酸为主;随后,类富里酸被土壤微生物降解生成可溶性微生物代谢产物,当腐解至第10~25 天时类胡敏酸和可溶性微生物代谢产物被进一步降解,HOB 组分的荧光峰消失,当腐解至第35~50 天时类富里酸和类胡敏酸先形成后又消失。腐解第0~5 天时HON 组分以可溶性微生物代谢产物为主,腐解至第10~50 天时HON 组分以类胡敏酸为主,这与HON 组分在上述2 个腐解阶段中紫外吸收峰形先窄后宽的结果相一致。腐解第0~10 天时,AIM 组分未检测到明显的荧光峰;之后,AIM 组分以类胡敏酸为主。
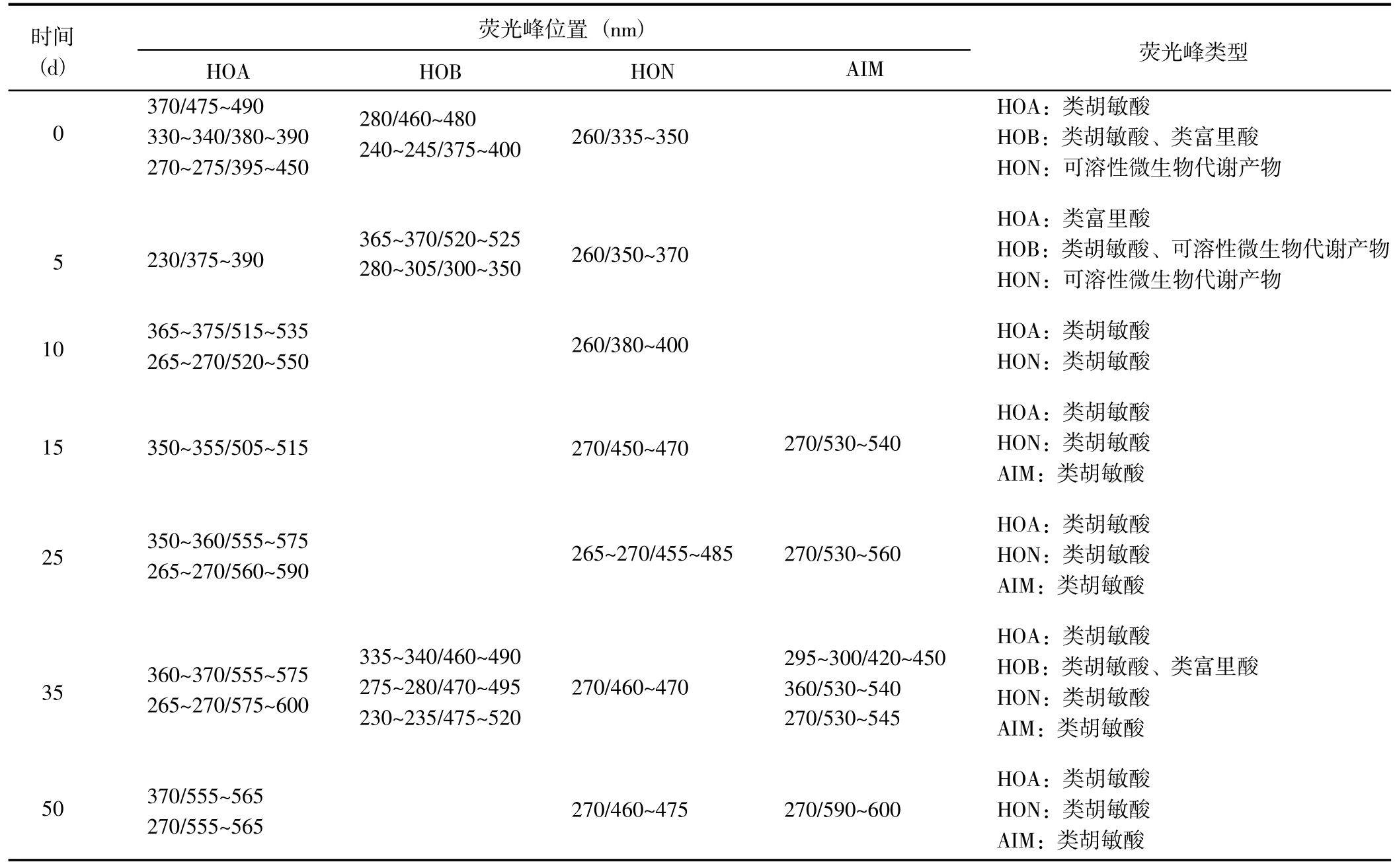
表2 腐解过程中不同DOM 组分荧光峰位置(λEx/λEm)和荧光类型的变化Table 2 Changes of fluorescence peak position (λEx/λEm) and type of different DOM fractions during decomposition
2.3 DOM 的同步荧光光谱
与传统的荧光光谱相比,同步荧光光谱的峰形、峰宽和峰位等均可随激发波长和发射波长的偏差大小而发生变化,因而选择合适的波长差就能提供较多的DOM 结构信息。研究表明,当波长差约为60 nm 时,大多数荧光峰能够得以呈现[28],因此本试验选择波长差为60 nm 进行同步荧光光谱的测定。根据Liu 等[29]的观点,发射波长260~300 nm 归属为类蛋白质物质,主要为类酪氨酸和类色氨酸物质;300~355 nm 归属为微生物源类腐殖质,与微生物代谢活动有关;355~420 nm 归属为类富里酸,通常含3~4 个苯环结构或更高共轭度的多环芳烃;420~550 nm 归属为类胡敏酸,通常含5~7 个苯环结构的多环芳烃。
从5 种DOM 组分的同步荧光光谱结果(图8~12)可以看出,HIM、AIM 和HOB 组分几乎均在285~295 nm出现荧光峰,HOA、HIM 和AIM 组分几乎均在505~513 nm 存在荧光峰。腐解第0 天时,HOA 组分的荧光峰位于340~345 nm、425~429 nm 和505~513 nm,归属为微生物源类腐殖质和类胡敏酸物质;之后,340~345 nm 的荧光峰逐渐蓝移至349~351 nm,而425~429 nm 的荧光峰则先红移至456~465 nm,随后蓝移至431~453 nm 并形成较宽的荧光峰。腐解第0 天时,HIM 组分的荧光峰位于338~341 nm 和394~404 nm,归属为微生物源类腐殖质和类富里酸;之后,338~341nm的荧光峰轻微红移至339~343 nm,而394~404 nm 的荧光峰则几乎变化不大。腐解第0天时,AIM 组分的荧光峰位于341~344 nm 和394~400 nm,归属为微生物源类腐殖质和类富里酸;之后,341~344 nm 和394~400 nm的荧光峰分别逐渐红移至344~349 nm 和436~444 nm。表明随腐解进行,AIM 组分逐渐形成分子量更大、共轭性更强的腐殖质类物质。腐解第0 天时,HOB 组分的荧光峰主要位于337~342 nm 和420~433 nm,归属为微生物源类腐殖质和类胡敏酸物质;之后,337~342 nm和418~433 nm 的荧光峰发生不同程度的红移。研究还发现,腐解第5 天和第35天时,HOB 组分分别在502~512 nm 和397~401 nm 出现新荧光峰,归属为类富里酸和类胡敏酸物质。腐解第0 天时,HON 组分的荧光峰位于316~320 nm,归属为微生物源类腐殖质;之后,荧光强度逐渐降低,荧光峰位置逐渐红移至355~358 nm,说明HON 组分逐渐形成类胡敏酸物质。
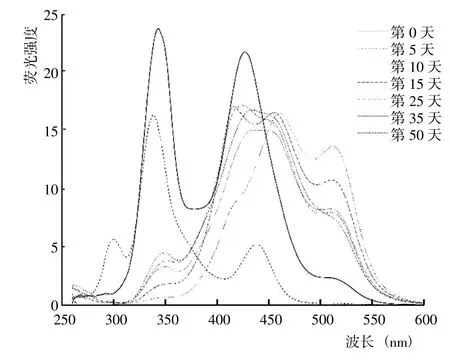
图8 腐解过程中HOA 组分同步荧光光谱的变化Fig.8 Changes of synchronized fluorescence spectrum from HOA fractions during decomposition
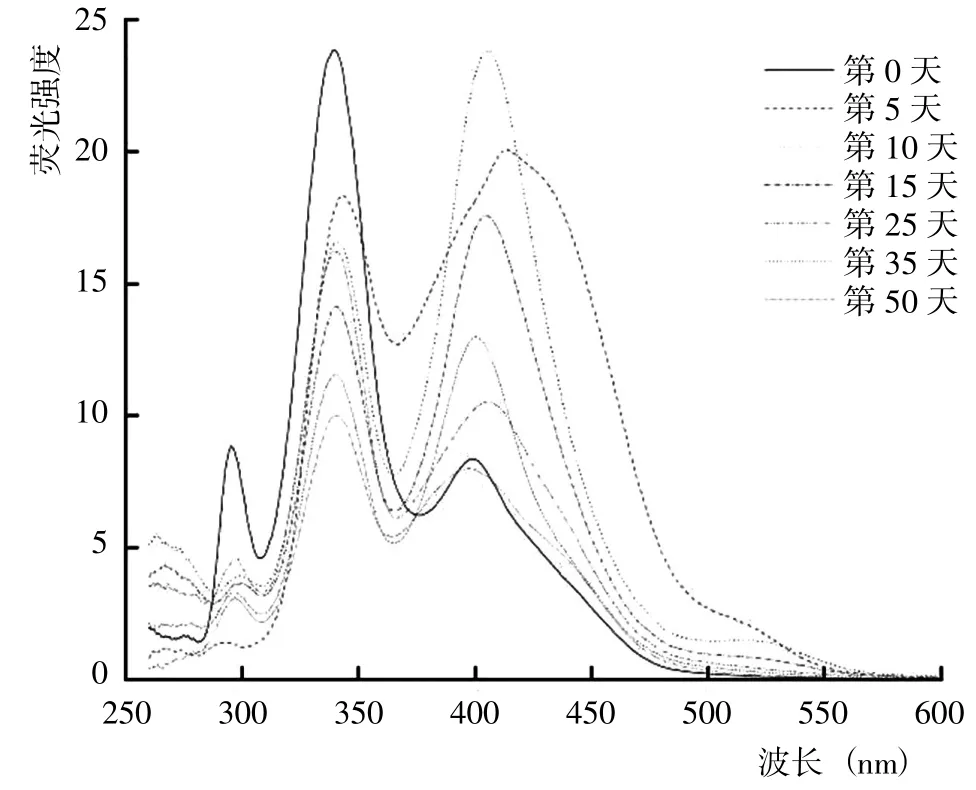
图9 腐解过程中HIM 组分同步荧光光谱的变化Fig.9 Changes of synchronized fluorescence spectrum from HIM fractions during decomposition

图10 腐解过程中AIM 组分同步荧光光谱的变化Fig.10 Changes of synchronized fluorescence spectrum from AIM fractions during decomposition
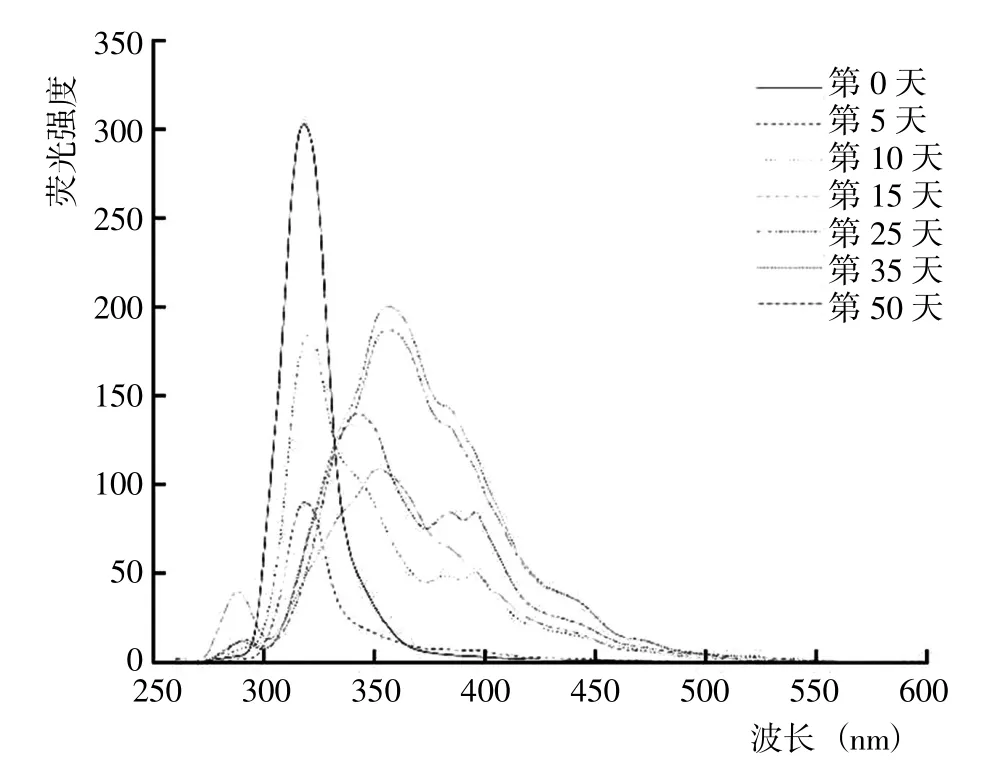
图11 腐解过程中HON 组分同步荧光光谱的变化Fig.11 Changes of synchronized fluorescence spectrum from HON fractions during decomposition

图12 腐解过程中HOB 组分同步荧光光谱的变化Fig.12 Changes of synchronized fluorescence spectrum from HOB fractions during decomposition
3 结论与讨论
3.1 讨论
本研究结果显示,在不同腐解阶段,5 种DOM 组分在某些波长范围内存在差异,说明DAX-8 树脂法可用于玉米秸秆DOM 的分级分离;同时5 种DOM 组分的吸收光谱较为相似性,表明其含有相似的化学结构和官能团。郭杏妹等[30]研究表明,5 种DOM 组分仅在紫外短波末端出现较强的“末端吸收”,原因与芳环或与芳环共轭的不饱和结构上π 电子流动性增加有关。本研究条件下,除腐解第0 天的HOA 组分外,5 种DOM 组分的紫外吸收值几乎均随波长的增加而降低,这与余旭芳等[4]关于小麦秸秆DOM 组分的紫外光谱相一致。紫外光谱特性发现,HOA、AIM 和HIM 组分芳环取代以C=O、COOH、OH 或酯基为主,HON 组分以脂肪链为主,HOB 组分则两者兼有,说明腐解过程中HOA、AIM 和HIM 组分芳环被氧化程度占优势,HON 组分芳环被还原程度占优势;HOA 组分的芳香性先降低后趋于稳定,HOB 和HON 组分的芳香性则处于动态变化,AIM 和HIM 组分的芳香性先增加后趋于稳定;HOA、AIM、HIM 组分的团聚化和腐殖化程度均表现为先增加后趋于稳定,HOB 和HON 组分的团聚化和腐殖化程度呈波动趋势。
本研究结果显示,与腐解第0 天相比,4 种DOM组分在腐解后期部分荧光峰消失,原因与4 种DOM 组分和其它化合物发生相互作用引起的荧光猝灭有关[31]。腐解10 d 后,4 种DOM 组分的荧光峰类型几乎均以类胡敏酸为主,表明此时其化学组成和结构较为稳定,这也与腐解10 d 后其紫外光谱峰形基本保持不变的结果相一致。研究还发现,与腐解第0 天相比,HOA 的荧光峰先蓝移后红移,HOB 组分的荧光峰既有红移也有蓝移且最终彻底消失,HON 组分的荧光峰明显红移,AIM 组分则在腐解中后期出现类胡敏酸荧光峰。由于C=O、COOH、-OH、-OR 等给电子基团通常使DOM 组分荧光峰发生红移并形成分子量较大的类胡敏酸物质,而芳环共轭双键被破坏或上述官能团减少等因素则使荧光峰发生蓝移,通常转化形成小分子量化合物[32]。因此,可认为HOA、HON 和AIM组分最终倾向于形成分子量较大的类胡敏酸物质。
本研究结果显示,在三维荧光光谱中难以分辨的部分荧光峰可在同步荧光光谱中得以识别,如HOA、HIM 和AIM 组分几乎均在285~295 nm 存在较弱的荧光峰,但其在三维荧光光谱中均未检测到明显的类蛋白质峰;再如,在同步荧光光谱中发现HIM 组分可产生2 个荧光峰,但在三维荧光光谱中未检测到明显的荧光峰。这表明同步荧光光谱可以提供三维荧光光谱难以提供的DOM 结构信息。研究还发现,HOA 组分以及腐解第5 天时的HOB 组分均在505~513 nm 存在较强的荧光峰,表明HOA 组分和腐解第5 天时的HOB 组分均以类胡敏酸物质为主,这也与三维荧光光谱荧光峰类型的结果相一致。
3.2 结论
(1)通过紫外光谱可知,采用DAX-8 树脂可将玉米秸秆DOM 组分进行分级分离,得到HOA、HOB、HIM、HON 和AIM 共5 个组分。HOA、HON 和AIM组分逐渐在280 nm 附近形成吸收峰,HIM 和HOB 组分则无明显的特征性吸收峰。
(2)HOA、AIM 和HIM 组分中芳环被氧化程度逐渐占优,HON 组分中芳环被还原程度逐渐占优。HOA组分的芳香性先降低后趋于稳定,AIM 和HIM 组分与之相反,HOB 和HON 组分的芳香性则处于动态变化。HOA、AIM 和HIM 组分的团聚化、腐殖化程度均表现为先增加后趋于稳定,HOB 和HON 组分的团聚化、腐殖化程度呈波动趋势。
(3)通过三维荧光和同步荧光图谱可知,在玉米秸秆腐解中后期,HOA、HON 和AIM 组分主要向类胡敏酸物质转化,HOB 组分则无明显的变化规律。

