基于miRNA-mRNA调控网络探讨miR-34a-5p靶向Hh通路对LX2细胞增殖的影响
任真,马燕花,王莉,王爱娣,赵秀萍
(甘肃中医药大学 1. 信息工程学院信息工程教研室; 2. 第一临床医学院内科学教研室,兰州 730000)
肝纤维化是多种病因导致的慢性肝脏疾病,其发生机制相对复杂,核心环节为异常活化的肝星状细胞 (hepatic stellate cell,HSC)[1]。刺猬 (hedgehog,Hh) 信号通路在调节肝脏的生长和修复中起关键作用,研究[2]表明Hh信号通路与HSC活化密切相关,其在肝纤维化中表达普遍上调,是肝纤维化发展的决定因素之一。微RNA (microRNA,miRNA) 通过靶向Hh信号通路参与肝纤维化过程和HSC活化[3]。已有研究[4]证明miR-34a可通过靶向长链脂酰CoA合成酶1 (long-chain acyl-CoA synthetase 1,ACSL1) 在HSC表型调控中发挥促肝纤维化功能,参与肝纤维化进程。研究[5]表明在相关酒精诱导的肝纤维化和肝细胞凋亡中miR-34a-5p表达增加。本课题组前期通过生物信息学方法筛选人肝星状LX2细胞中差异表达miRNA靶向Hh信号通路相关靶基因,构建miRNA-mRNA调控网络,获得核心miRNA (miR-34a-5p)。本研究通过细胞实验过表达miR-34a-5p,探讨其对转化生长因子-β1 (transforming growth factor-β1,TGF-β1) 诱导LX2活化的影响,同时运用Hh信号通路抑制剂环靶明脂进行干预,进一步探讨miR-34a-5p的靶向调控作用,为肝纤维化的防治提供理论依据。
1 材料与方法
1.1 细胞、药品与试剂
人肝星状LX2细胞购自中国北纳创联公司。环靶明脂 (4449-51-8) 购自美国MCE公司;凋亡试剂盒FITC-PI (40302ES60) 、Hifair®Ⅱ1st Strand cDNA Synthesis Kit (gDNAdigester plus) (11121ES60) 均购自中国Yeasen公司;引物购自美国ThermoFisher公司;RNAiso plus 购自日本TaKaRa公司;兔来源一抗脑胶质瘤相关癌基因 1 (glioma related oncogene homology 1,Gli1) 、α-平滑肌肌动蛋白 (α-smooth muscle actin,α-SMA) 购自中国华安公司;兔来源一抗脑胶质瘤相关癌基因 2 (glioma related oncogene homology-2,Gli2) 、Ⅰ型胶原 (type Ⅰ collagen,Col-Ⅰ) 以及小鼠来源一抗声波刺猬 (sonic hedgehog,Shh) 均购自美国Affinity公司;兔来源内参一抗β肌动蛋白 (beta-actin,β-actin) 购自英国Abcam公司;辣根过氧化物酶 (horseradish peroxidase,HRP) 标记山羊抗兔二抗IgG、HRP标记山羊抗小鼠二抗IgG、CCK-8 试剂盒 (C0093) 均购自中国碧云天生物技术有限公司。Lipofectamine2000[11668-019 (lot:2125329)]购自美国Invitrogen公司。
1.2 主要仪器
多功能荧光酶标仪 (Varioskan LUX) 购自美国ThermoFisher公司,流式细胞仪 (CytoFLEX) 购自美国Beckman公司,AB Step One plus Real Time PCR System 购自美国Applied Biosystems AB公司,凝胶成像仪稳压DNA电泳仪购于美国Tianneng公司,GDS8000 凝胶扫描系统购自美国UVP公司,Trans-Blot 转膜装置购自美国Bio-Rad公司。倒置荧光显微镜 (ECLIPSE Ti-s) 购自日本Nikon公司。
1.3 miRNA-mRNA 网络构建
基于本课题组前期通过高通量测序和生物信息学分析,获得LX2细胞与Hh信号通路相交差异表达miRNA,并进行miRNA靶基因预测和差异miRNA靶基因京都基因与基因组百科全书 (Kyoto Encyclopedia of Genes and Genomes,KEGG) 和基因本体(Gene Ontology,GO) 富集分析[6]。通过TargetScan数据库 (https://www.targetscan.org/vert_72/) 查询Hh信号通路相对应的靶基因,并将靶基因导入string数据库 (https://cn.string-db.org/) 构建靶蛋白质-蛋白质相互作用网络 (protein-protein interaction networks,PPI)。将PPI导入Cytoscape 3.9.2,并通过cytoHubba插件中的 MNC 和Degree 算法筛选核心基因,进行网络拓扑分析后筛选出核心miRNA和核心靶基因。
1.4 细胞实验
1.4.1 细胞培养:将LX2细胞培养于含10%优质胎牛血清和1%青霉素-链霉素双抗的DMEM培养基中,2~3 d换液1次,细胞80%融合度时传代,按照1 ∶3传代比例进行,于37 ℃,5% CO2及饱和湿度培养箱中培养。
1.4.2 细胞分组与转染:取正常培养的细胞,消化后用完全培养基重悬,接种于10 cm2皿中,待细胞密度达到50%~60%时利用脂质体Lipofectamine 2000进行转染。转染48 h后,倒置荧光显微镜下观察miR-34a-5p荧光表达情况,实时荧光定量聚合酶链反应(quantitative real time polymerase chain reaction,qRTPCR) 检测转染效率并用于后续实验。细胞随机分为正常对照组、TGF-β1诱导组、miR-34a-5p过表达组、mimic-NC组和环靶明脂组。除正常对照组,其余各组加入终浓度为5 ng/mL的TGF-β1处理细胞24 h,环靶明脂组加入终浓度为10 μmol/L的环靶明脂;miR-34a-5p过表达组和mimic-NC组分别加入转染复合物转染6 h后,更换完全培养基。各组细胞培养箱中继续培养3 d。
1.4.3 qRT-PCR检测细胞miR-34a-5p和Shh、Gli1、Gli2、Col-Ⅰ、α-SMAmRNA表达水平:TRIzol法从培养细胞中提取总RNA,用超微量分光光度计测定RNA的质量和浓度。使用Hifair®Ⅱ1st Strand cDNA Synthesis Kit (gDNA digester plus) 试剂盒,将大约5 μL的总RNA逆转录为cDNA;使用Hieff UNICON®Universal Blue Q-PCR SYBR Green Master Mix试剂盒进行Q-PCR。反应体系 (10 μL)为SYBR Green Master Mix 5 μL,上下游引物 (各10 μmol/L) 0.4/0.4 μL,cDNA 1 μL,DEPC处理水加至10 mL。反应程序为95 ℃预变性反应2 min,进行40个循环,包括95 ℃变性10 s,60 ℃退火/延伸30 s。采用2-ΔΔCt法计算miR-34a-5p和Shh、Gli1、Gli2、Col-Ⅰ、α-SMAmRNA的相对表达量,以U6用于miRNA的标准化,而GAPDH用于Shh、Gli1、Gli2、Col-Ⅰ、α-SMA基因的标准化。根据美国国立生物信息中心 (National Center for Biotechnology Information,NCBI) 所公布的基因登录号设计内参和目的基因引物,见表1。

表1 引物序列Tab.1 Primer sequences
1.4.4 CCK-8检测miR-34a-5p对LX2细胞增殖的影响:各组细胞培养结束后,向每孔加入10 μL CCK-8溶液,将培养板放入培养箱内孵育3 h。用酶标仪测定在450 nm处的吸光度 (optical density,OD) 值。设置空白孔。
1.4.5 Anexin V/PI检测miR-34a-5p对LX2细胞凋亡的影响:收集培养3 d后的各组细胞,PBS溶液洗涤,胰酶消化,离心,弃上清,收集细胞,加入195 μL Annexin V-FITC 结合液轻轻重悬细胞。加入5 μL Annexin V-FITC,轻轻混匀。室温避光孵育10 min。1 000g离心5 min,弃上清,加入 190 μL Annexin V-FITC结合液轻轻重悬细胞。加入10 μL碘化丙啶染色液,轻轻混匀,冰浴避光放置。随即进行流式细胞仪检测,Annexin V-FITC为绿色荧光,PI为红色荧光。
1.4.6 Western blotting检测各组Shh、Gli1、Gli2、Col-Ⅰ和α-SMA蛋白表达:使用裂解液的RIPA从LX2细胞中提取总蛋白质,BCA法测蛋白浓度,以40 μg/20 μL对蛋白样品进行8%聚丙烯酰胺凝胶电泳2 h,转膜1.5 h。在室温下用5%脱脂奶粉封闭1 h后,将膜与一抗 (1 ∶1 000) 在4 ℃下孵育过夜12 h,用TBST溶液洗涤一抗5 min,重复3次,然后将膜与适当的二抗(1 ∶1 000) 在室温下孵育1 h,用TBST溶液洗涤二抗5 min,重复4次,最后将ECL曝光液按ECL A液 (鲁米诺)∶ECL B液 (过氧化氢) 1 ∶1混匀后均匀覆盖在整片膜上,反应2 min放入曝光仪曝光检测蛋白质条带。
1.5 统计学分析
采用 SPSS 19.0 软件进行统计分析,计量资料以±s表示;组间比较采用单因素方差分析 (oneway AN0VA),方差齐者 (P> 0.05) 采用LSD检验进行组间比较,方差不齐者 (P< 0.05) 釆用Welch 校正法,组间比较用Dunnett’s T3 法,P< 0.05为差异有统计学意义。
2 结果
2.1 构建miRNA-mRNA调控网络及核心网络分析
共获得22个关键靶基因 (图1)。网络节点数为22,边数为81,平均节点度为7.36,平均局部聚类系数为0.704。基于miRNA 与 mRNA 的调控关系将各基因导入Cytoscape 3.9.2 中构建miRNA -mRNA 互作网络图和候选靶基因PPI网络图,见图2。通过综合评价筛选出3个核心miRNA和5个核心基因,分别为hsa-miR-34a-5p、hsa-miR-497-5p、hsa-miR-222-3p、CSNK1G1、CDON、SPOP、LRP2和ARRB1,见表2。
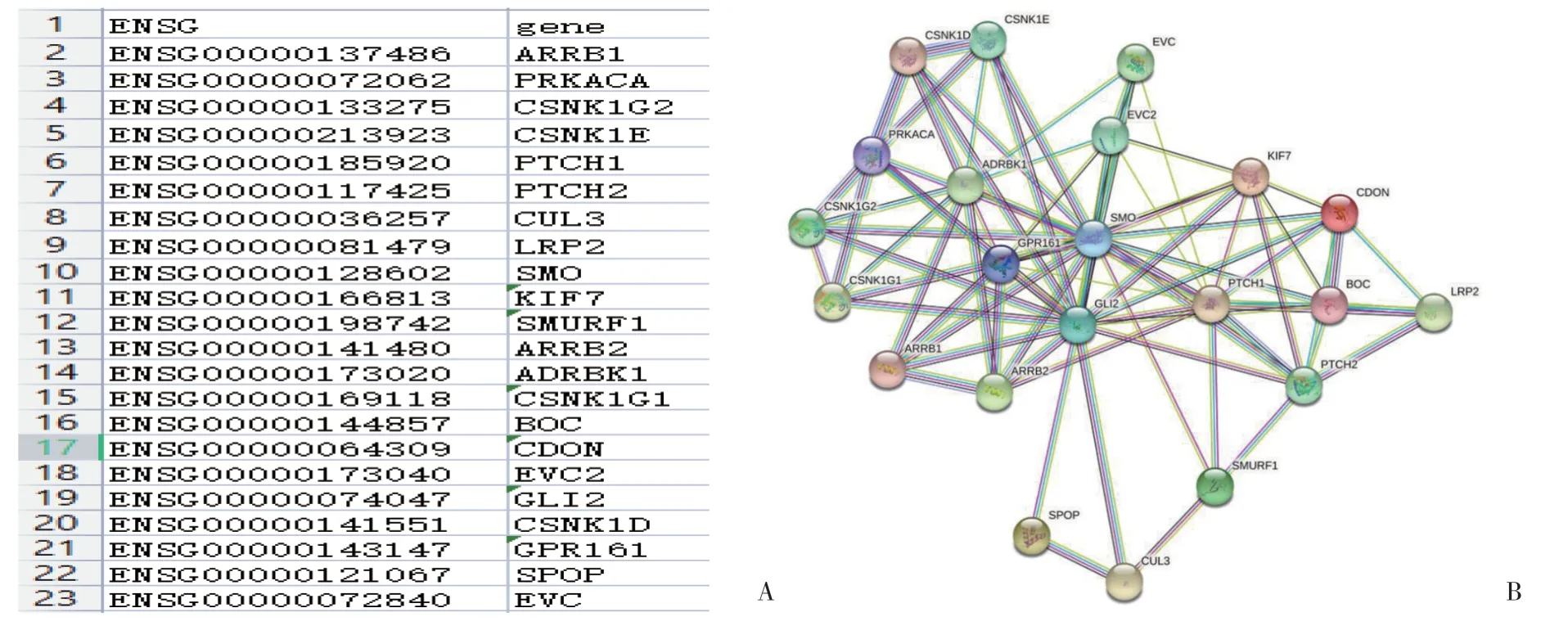
图1 差异miRNA预测靶基因Fig.1 Target genes predicted using differential miRNAs

图2 miRNA-mRNA调控网络及候选靶基因PPI网络Fig.2 miRNA-mRNA regulatory networks and candidate target gene PPI network

表2 核心miRNA和核心基因筛选Tab.2 Core miRNA and core gene screening
2.2 细胞实验验证miR-34a-5p过表达对LX2细胞增殖的影响
2.2.1 LX2细胞miR-34a-5p mimic化学转染的荧光表达及Q-PCR验证:运用化学合成的方法构建miR-34a-5p mimic和miR mimic NC,合成时连接一个FAM荧光基团,用来在荧光倒置显微镜下观察miRNA mimic/NC 的转染效果。LX-2细胞化学转染48 h后于倒置荧光显微镜下观察,结果显示,与正常细胞比较,转染组细胞荧光表达显著,提示转染成功。qRTPCR检测结果也显示,与正常对照组 (1.00±0.00)比较,TGF-β1诱导组miR-34a-5p的表达水平 (5.50±0.12) 显著升高 (P< 0.01)。与TGF-β1诱导组比较,TGF-β1+miR-34a-5p过表达组miR-34a-5p的表达水平 (9.35±0.19) 显著升高 (P< 0.01),而TGF-β1+mimic-NC组miR-34a-5p的表达水平 (5.52±0.12) 无明显变化 (P> 0.05),见图3。

图3 LX2细胞转染荧光图 ×100Fig.3 Transfection fluorescence of LX2 cells ×100
2.2.2 各组细胞活力测定:与正常对照组 (100.00%±0.00%) 比较,TGF-β1诱导组 (113.94%±6.15%) 细胞活力增高 (P< 0.01)。与TGF-β1诱导组比较,miR-34a-5p过表达组 (130.26%±5.70%) 细胞活力增高(P< 0.01),环靶明脂组 (81.19%±4.77%) 细胞活力下降 (P< 0.01),mimic-NC组 (116.58%±6.77%) 细胞活力无明显变化 (P> 0.05)。
2.2.3 各组细胞凋亡率检测结果:与正常对照组(2.96%±0.53%) 比较,TGF-β1诱导组 (3.50%±0.51%)细胞凋亡率无明显变化 (P> 0.05)。与TGF-β1诱导组比较,miR-34a-5p过表达组 (2.49%±0.16%) 细胞凋亡率下降 (P< 0.05);环靶明脂组 (10.58%±0.89%)细胞凋亡率显著增高 (P< 0.01),见图4。

图4 流式细胞术检测各组细胞凋亡率Fig.4 Cell apoptosis rate in each group determined using flow cytometry
2.2.4 各组细胞Shh、Gli1、Gli2、Col-Ⅰ、α-SMAmRNA的表达水平:与正常对照组比较,TGF-β1诱导组Shh、Gli1、Gli2、Col-Ⅰ及α-SMAmRNA表达水平均增高 (P< 0.01)。与TGF-β1诱导组比较,环靶明脂组Shh、Gli1、Gli2、Col-Ⅰ及α-SMAmRNA表达水平均下降 (P< 0.01);miR-34a-5p过表达组Shh、Gli1、Gli2、Col-Ⅰ及α-SMAmRNA表达水平均增高 (P< 0.01);mimic-NC组除ShhmRNA表达水平增高外 (P< 0.05),其余差异均无统计学意义 (P> 0.05),见图5。

图5 各组细胞Shh、Gli1、Gli2、Col-Ⅰ及α-SMA的mRNA表达Fig.5 mRNA expression of Shh,Gli1,Gli2,Col-Ⅰ,and α-SMA in each group
2.2.5 各组细胞Shh、Gli1、Gli2、Col-Ⅰ、α-SMA的蛋白表达量:与正常对照组相比,TGF-β1诱导组Shh、Gli1、Gli2、Col-Ⅰ及α-SMA蛋白表达水平均增高 (P<0.01)。与TGF-β1诱导组比较,环靶明脂组Shh、Gli1、Gli2、Col-Ⅰ及α-SMA蛋白表达水平均下降 (P< 0.01);miR-34a-5p过表达组除Shh蛋白表达无变化外,Gli1、Gli2、Col-Ⅰ及α-SMA蛋白表达水平均增高 (P< 0.05);mimic-NC组各指标无明显变化,差异无统计学意义(P> 0.05),见图6。

图6 各组细胞Shh、Gli1、Gli2、Col-Ⅰ及α-SMA 的蛋白表达Fig.6 Protein expression of Shh,Gli1,Gli2,Col-Ⅰ,and α-SMA in each group
3 讨论
肝纤维化是各种病因引起的慢性肝损伤的重要病理过程,未经干预可逐渐进展为肝硬化、肝细胞癌,甚至肝衰竭。HSC在肝纤维化的发生、发展和逆转过程中起至关重要的作用。当肝脏受到损伤时,HSC活化,生成大量细胞外基质 (extracellular matrix,ECM),促进纤维化的发生。已有研究[7]证实肝纤维化是可逆性过程,阻断HSC活化是防治肝纤维化的重要途径。
研究[2]表明miRNA参与HSC的激活,在肝脏脂质代谢、氧化应激、代谢性炎症、慢性肝损伤、再生和纤维化等病理过程中发挥重要作用。miRNA可通过调节Hh信号通路相关蛋白,参与肝纤维化的发生和发展。各种引起慢性肝损伤的病因可激活Hh信号通路,从而引起HSC活化[8]。活化的HSC可以表达Hh通路Shh、Patch、Smo和Gli等多重组分,使Hh信号通路持续处于一种激活状态,两者相互作用,激活效应不断放大,最终促进了肝纤维化的进程[9]。
人类miR-34a基因位于染色体长臂3区6带 (1p36),miR-34a在脑、心肌、肝脏、肺、前列腺等部位广泛表达,可产生miR-34a-5p和miR-34a-3p 2条miRNA,广泛参与调控细胞周期进程、肿瘤分化、凋亡、黏附、转移等过程。miR-34a-5p与肝脏疾病及其相关纤维化疾病的发生发展密切相关。周兴蓓[11]从慢性乙肝相关肝纤维化患者血清中筛选出差异表达miR-34a-5p。CALVOPINA等 [12]在囊性纤维化相关性肝病中鉴定了一个独特的循环miRNA谱,miR-34a-5p有可能准确区分囊性纤维化儿童的肝病和纤维化严重程度。江波涛等[13]通过生物信息学方法及体内实验证实了miR-34a-5p在糖尿病肝病病变过程中表达上调。HARRISON等[14]通过1项基于血液的生物标志物组的诊断方法,将miR-34a-5p作为非酒精性脂肪性肝炎 (nonalcoholic steatohepatitis,NASH) 相关生物标志物中4个独立的标志之一,为在代谢危险因素和疑似疾病的患者中无创性地排除或排除处于危险的NASH提供了有效途径,有可能大大减少疾病进展风险较低患者不必要的肝活检。
本研究结果显示,经TGF-β1诱导活化的LX2细胞中miR-34a-5p的表达水平显著高于正常人HSC。Hh信号通路特异性Smo抑制剂可使LX2细胞增值活力显著降低,凋亡率显著增加,HSC活化标志蛋白α-SMA和Col-Ⅰ表达均下调,Hh信号通路的关键蛋白Shh、Gli1、Gli2表达均下调,而miR-34a-5p过表达可上调LX2细胞中Gli1和Gli2蛋白表达水平,且细胞增殖活力显著升高,凋亡率显著降低。
综上所述,miR-34a-5p可上调Hh信号通路相关蛋白Gli的表达,进而促进LX2细胞的增殖与活化。后续研究将建立肝纤维化大鼠模型,进一步验证研究结果,为深入了解肝纤维化发病机制及治疗提供新思路。

