氧化钼氮化工艺技术及表征
王 欢,王洪发,王海龙
(1.沈阳科技学院,辽宁沈阳 110000;2.中化环境科技工程有限公司,辽宁沈阳 110000)
近年来,由于催化剂市场MoO3的需求剧增,石油工业常采用高温焙烧钼酸铵法制备MoO3。MoO3的用途比较广泛,可用于制备钼盐、钼合金,制取金属钼及钼化合物的原料、搪瓷釉药颜料及药物等[1]。
Mo2N 作为一类高熔点、高硬度、良好热稳定性和机械稳定性、极好抗腐蚀特性的新型功能材料,已广泛用于各种耐高温、耐磨擦和耐化学腐蚀等领域。此外,氮化物价格较低且抗硫毒性能强[2],其在许多化学反应中都表现出类贵金属的性质[3]和催化特性,其催化活性可与贵金属铂、铱相媲美,被誉为“准铂催化剂”,可广泛用于有氢参与的反应如烷烃异构化、不饱和烃加氢、加氢脱硫和脱氮等反应的催化剂[4]。Mo2N 的合成有着极为广阔的应用前景。
本文以(NH4)6Mo7O24·4H2O 为原料,采用高温焙烧法制备Mo2N 前驱体MoO3;在H2、N2气氛下制备Mo2N,考察了单因素和正交实验,并对催化剂进行了表征。
1 实验部分
1.1 原料、试剂及设备
N2(99.996% 杭州成丰气体有限公司);H2(99.9% 河南星岛气体科技有限公司);He(99. 99%河南星岛气体科技有限公司);羧甲基醚纤维素钠盐(CP 廊坊森匀科技有限公司);(NH4)6Mo7O24·4H2O(AR广州市江顺化工科技有限公司)。
GC7890II 型气相色谱仪(上海精密仪器仪表有限公司);2P17S225ANQ 型压缩机(日本松下);AIJ-5.0P 型高精度智能温控仪(厦门宇电自动化科技有限公司);K400 型质量流量计(青岛澳威流体计量有限公司);ACU10FA-XS 型流量显示控制仪(北京精量科技有限公司);SEM2000 型钨灯丝扫描电镜(国仪量子);D2 PHASER 型X 射线衍射仪(德国布鲁克AXS 公司);FBT-9A/B/X 型全自动比表面测定仪(沧州精弘工程仪器有限公司);SX2-5-12 型马弗炉(沈阳长城工业电炉厂);DZF-6210 型干燥箱(上海合恒仪器设备有限公司)。
1.2 实验方法
1.2.1 MoO3的制备 将(NH4)6Mo7O24·4H2O 置于马弗炉中在820K 下焙烧4.5h,生成的MoO3筛分出40~60 目作为Mo2N 制备原料。低于60 目的MoO3加入一定量的羧甲基醚纤维素钠盐混合,在压缩机上压片成型。成型后粉碎,筛选40~60 目MoO3。其原理是(NH4)6Mo7O24在高温下发生热分解,生成NH3、MoO3和水蒸气。
1.2.2 氮化剂的选择 选取高纯H2、N2混合气作为氮化剂。在程序升温过程中,以H2和N2混合气为氮化剂制得的Mo2N 比表面积高,且重现性好,合成气经干燥后可重复利用,不发生设备腐蚀,避免了在大型反应床层中NH3吸热分解的传热问题。
1.2.3 氮化工艺
(1)工艺装置(图1)
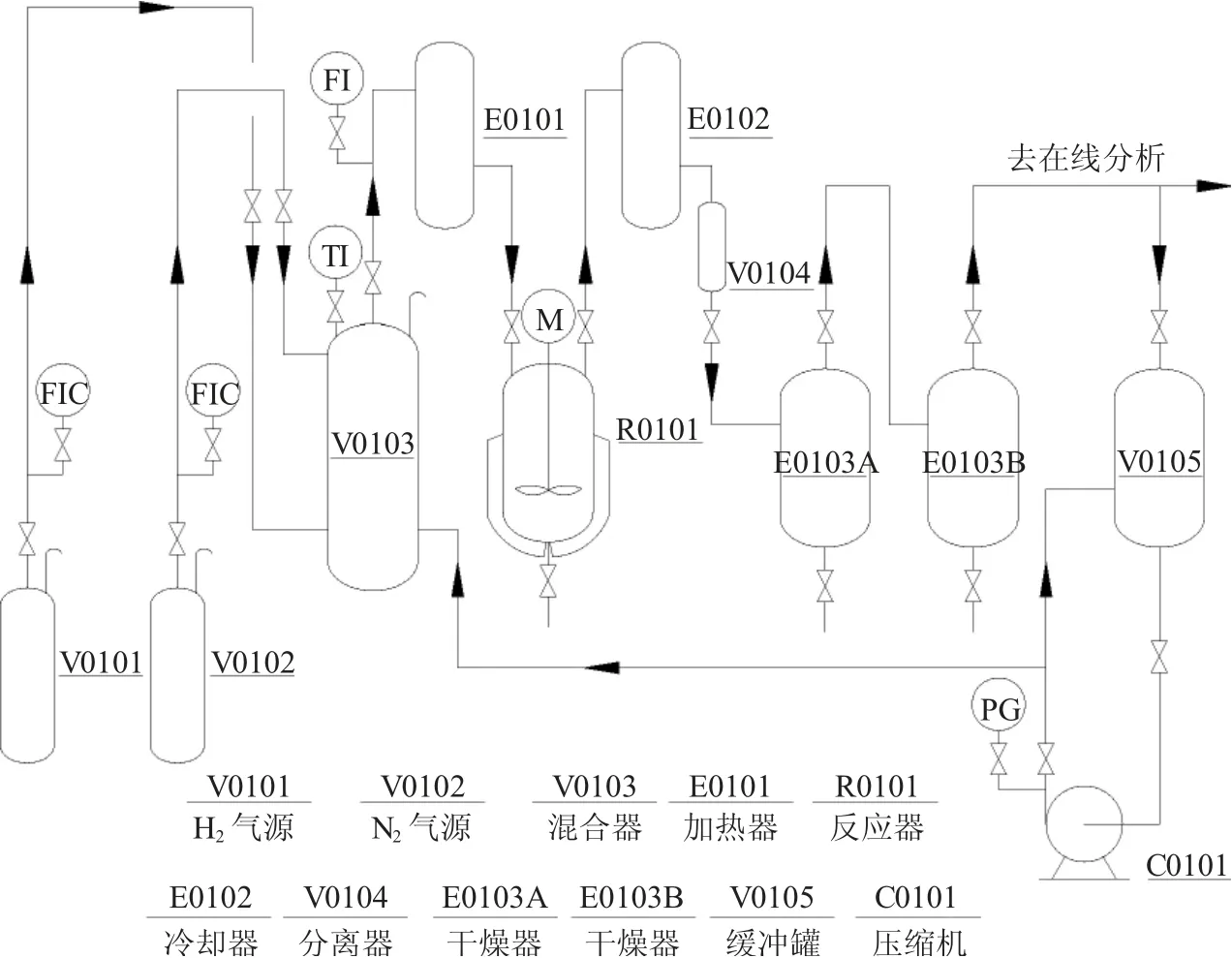
图1 氮化工艺装置图Fig.1 Diagram of nitriding process plant
(2)MoO3工艺流程 将MoO3粉碎、筛分,装入流化床反应器中,氮化剂由H2和N2气源供给,经质量流量控制器控制其流量及比例与来自压缩机未反应的循环氮化剂在混合器中充分混合,再经质量流量计流入加热器到指定温度。氮化剂根据设定的升温程序进入流化床氮化反应器与MoO3发生反应生成Mo2N。未反应的混合气体及反应生成的水由反应器的出口排出,依次经过粉尘回收装置进一步脱除因流化时间过长而造成的细小粉末颗粒,活性炭干燥后进入冷却器由分离器分离出冷凝水后进入干燥器深度脱水。脱水后的混合气一路进入气相色谱进行在线分析,另一路进入缓冲罐由气体压缩机打入系统回到混合气。反应结束后在N2气氛下冷却至室温,取出前用含有微量氧的N2进行钝化4~6h。
1.3 Mo2N 表征
采用FBT-9A/B/X 全自动比表面测定仪测定Mo2N 及前驱体的比表面积;采用扫描电子显微镜对Mo2N 及其前驱体进行观察;样品的物相采用德国布鲁克公司D2 PHASER X 射线衍射仪测定。
2 结果与讨论
2.1 氮化工艺实验
采用高温煅烧法制备Mo2N 的前驱体MoO3,以Mo2N 比表面积作为评价指标,考察了氢氮比、氮空速、恒温时间及升温速率对Mo2N 比表面积的影响。
2.1.1 氢氮比 首先进行程序升温,0.5h 内迅速升至673K,然后分别以273.6K·min-1和274.8K·min-1的速度升到873K 和1023K。在其他条件不变的情况下,考察氢氮比对Mo2N 比表面积的影响,图2 为Mo2N 比表面积随氢氮比变化的规律。
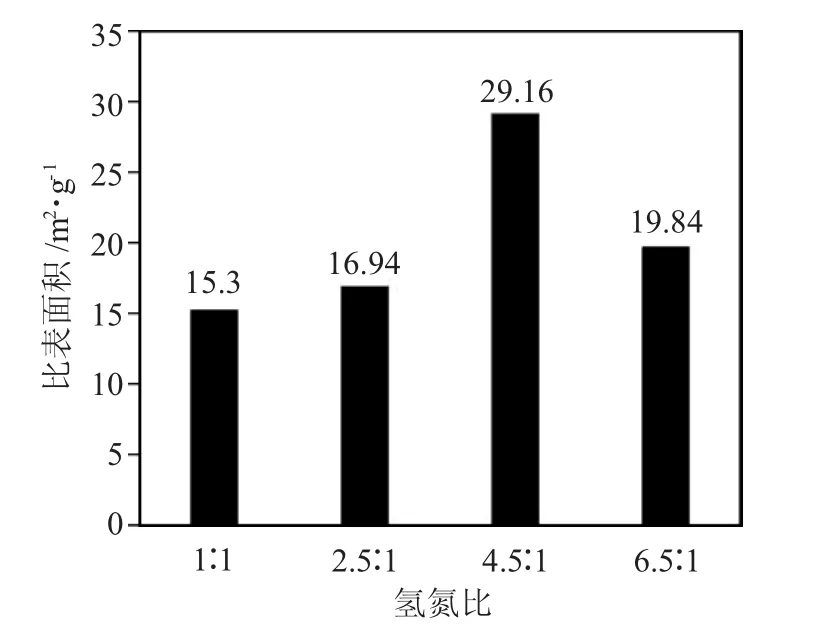
图2 Mo2N 比表面积随氢氮比变化的规律Fig.2 Rule of specific surface area of molybdenum nitridewith hydrogen nitrogen ratio
由图2 可见,在空速为45000h-1及一定的程序升温程序下,产物的比表面积是先随着氢氮比的增加而增加,这是由于在N2量较大时,H2的有效浓度较低,从反应机理来看,MoO3中的氧原子不能被氮原子取代,不能发生局部规整反应,继续增加氢氮比达到4.5∶1 时,Mo2N 比表面积有最大值,而后随着氢氮比的增加,比表面积呈下降趋势,这是因为过量的H2将前驱体MoO3还原成了金属钼或者MoO2,不能生成高比表面积的Mo2N,只能生成中比表面积或低比表面积的产物。
2.1.2 氮化剂空速 按上述升温程序进行升温。在氮化剂氢氮体积比为4.5∶1 的条件下,空速在25000~85000h-1区间内Mo2N 比表面积随空速变化的规律见图3。
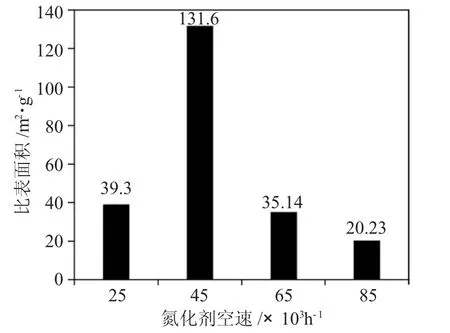
图3 Mo2N 比表面积随空速变化的规律Fig.3 Rule of specific surface area of molybdenum nitride with space velocity
由图3 可见,Mo2N 比表面积与氮化剂空速密切相关。初始氮化剂空速为25000h-1时,比表面积为39.3m2·g-1,空速为45000h-1时,比表面积为131.6m2·g-1。由于Mo2N 生成过程是还原反应,生成水蒸气,故为防止反应中间物和产物的水热烧结现象应及时除去水蒸气以得到较高比表面积的产物。当空速由45000h-1提高到65000h-1、85000h-1时,比表面积却由131.6m2·g-1降至35.14m2·g-1、20.23m2·g-1,这是由于采用了水吸收回收粉尘,过高的空速会使通过粉尘回收的循环气夹带更多的水分,这部分水在反应器中产生了水热烧结现象,因此,产物比表面积迅速下降。
2.1.3 恒温时间 在升温程序及其他条件不变的情况下,考察了恒温时间对Mo2N 比表面积的影响,Mo2N 比表面积随恒温时间变化的规律见图4。
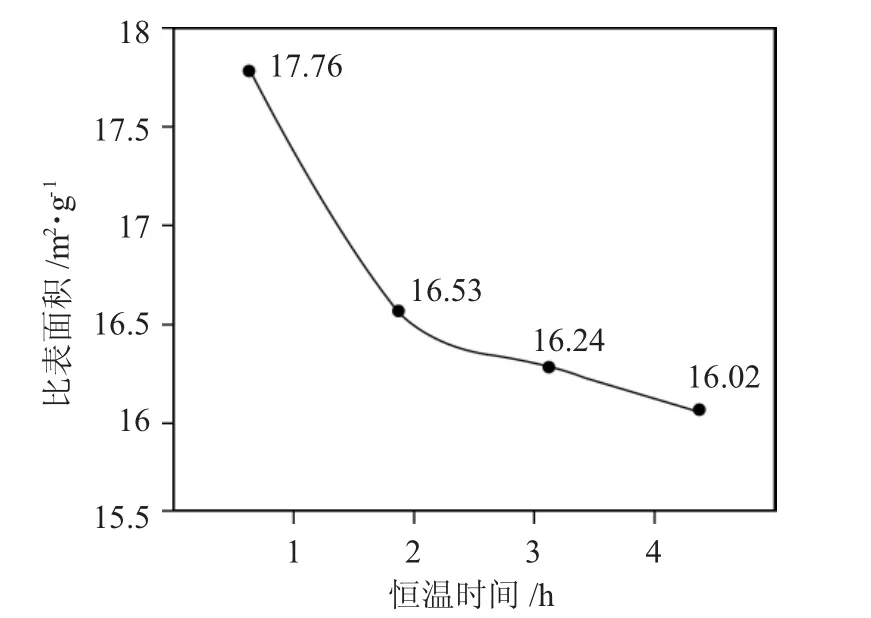
图4 Mo2N 比表面积随恒温时间变化曲线Fig.4 Curve of specific surface area of molybdenum nitride with constant temperature time
当氢氮混和气中的H2与N2的体积比为4.5∶1,空速为45000h-1及相同的升温程序时可以看出,随着反应的恒温时间改变,Mo2N 的比表面积变化不很明显,但对于后期的恒温处理是不可缺少的,增加适当的恒温时间主要是为了强化实验的结果,使反应器中未反应的MoO3充分反应。
2.1.4 升温速率 升温速率对形成高比表面积的Mo2N 具有较大影响,673~873K 是Mo2N 转变的关键温度范围,程序升温过程为0.5h 内从298K 升到673K,以274.8K·min-1的速率从873K 升到1023K。在氮化剂空速45000h-1和氢氮比为4.5∶1 的条件下,升温速率对Mo2N 比表面积的影响见图5。
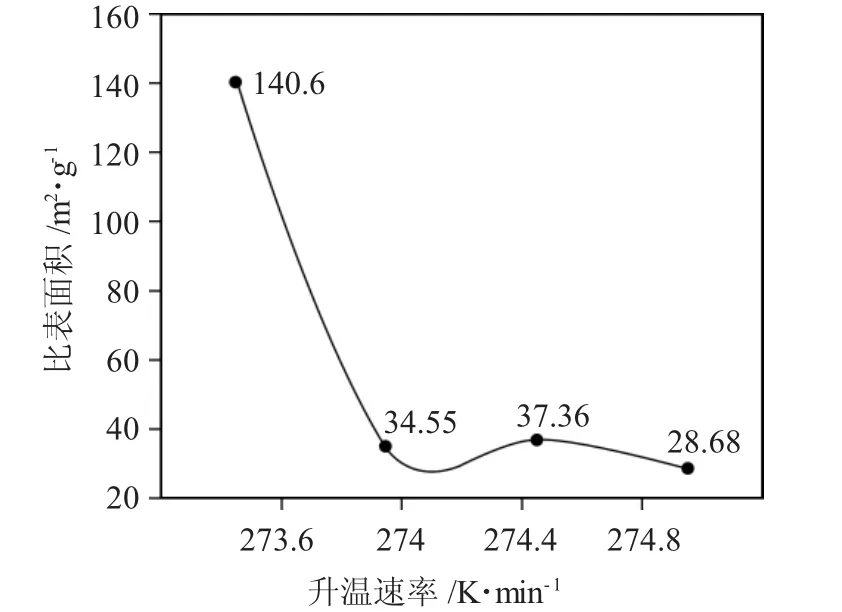
图5 升温速率对Mo2N 比表面积的影响Fig.5 Effect of heating rate on specific surface area of molybdenum nitride
由图5 可见,274K·min-1前,Mo2N 比表面随升温速率的提高显著下降,Mo2N 比表面与升温速率呈反比关系,即升温速率越大,Mo2N 比表面积越小。而在274~274.8K·min-1区间内,比表面积变化不是很明显。由于Mo2N 生成过程中涉及“局部规整”反应,程序升温速率越低,反应越平缓有利于局部规整,因此,可得到产物的比表面积较大。
2.2 Mo2N 合成的优化条件
由单因素实验结果可知,氢氮比、氮化剂空速、恒温时间、升温速率对氮化效果均有影响,实验因素水平见表1。
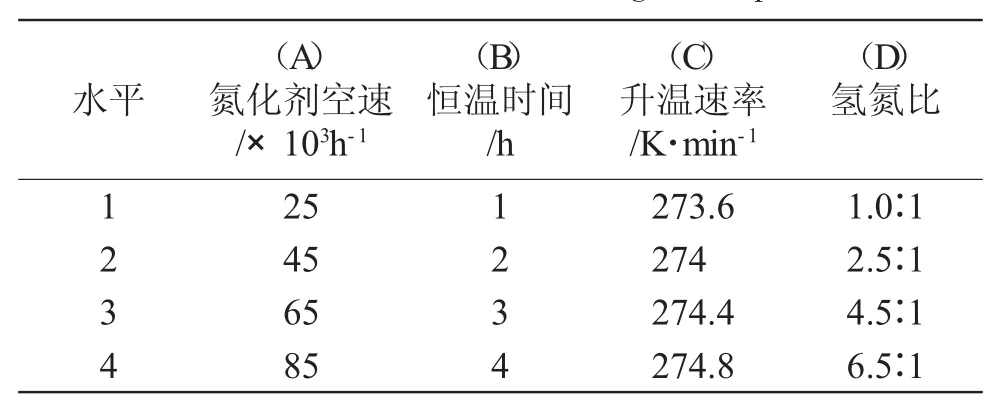
表1 正交实验因素水平Tab.1 Factors and levels of orthogonal experiment
按L16(44)安排正交实验,实验结果见表2。
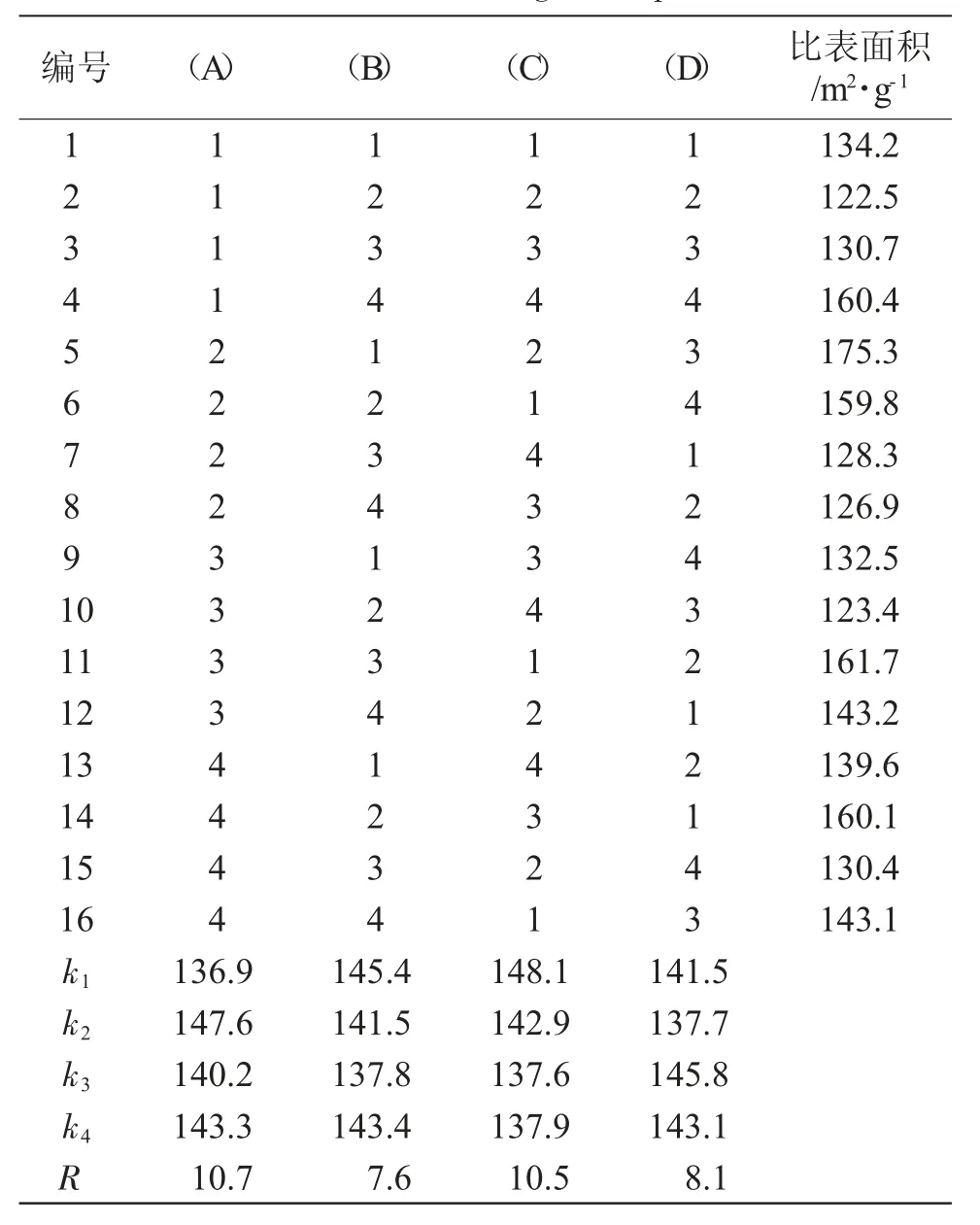
表2 正交实验结果Tab.2 Results of orthogonal experiment
根据极差值得出各因素对Mo2N 制备的影响顺序为:恒温时间<氢氮比<升温速率<氮化剂空速。由表2 得到Mo2N 制备的较优条件为氮化剂空速为45000h-1,升温速率为273.6K·min-1,氢氮比为4.5∶1,恒温时间为1h。在上述条件下进行验证实验,Mo2N比表面积达到176.8m2·g-1。
2.3 催化剂的表征
2.3.1 SEM 表征 图6 为MoO3及Mo2N 的SEM 图(放大比例1∶50000)。

图6 MoO3 及Mo2N 的SEM 图Fig.6 SEM images of molybdenum trioxide and molybdenum nitride
由图6 可见,与MoO3相比,Mo2N 晶体形貌发生了变化,这是由于其引进了元素N,增大了金属原子间的距离,MoO3是实心固体,氮化后形成孔道相连的多孔体。
2.3.2 XRD 表征 JCPDS 数据库相关物质的XRD特征衍射峰见表3。
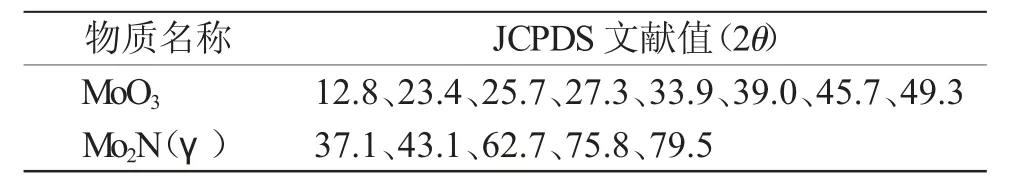
表3 相关物质的JCPDS 文献值Tab.3 JCPDS reference values for related substances
图7为采用高温焙烧法制备的MoO3和反应产物Mo2N(γ)的XRD 谱图。
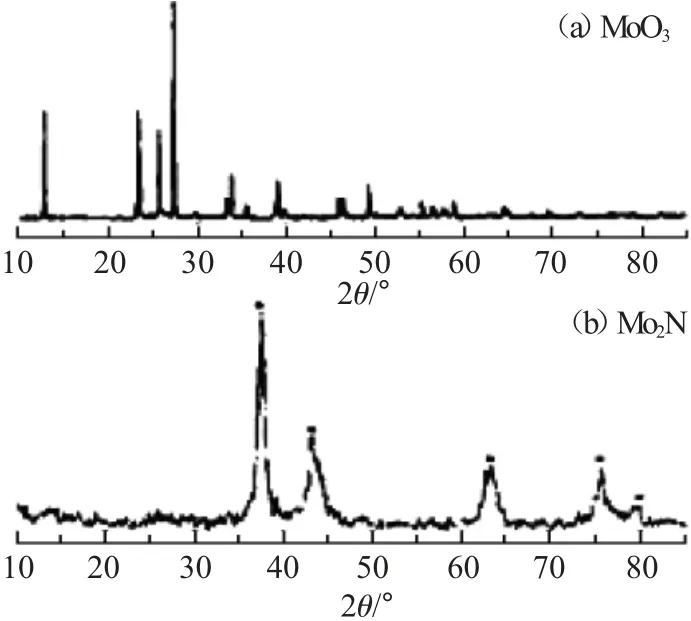
图7 MoO3 和Mo2N(γ)的XRD 谱图Fig.7 XRD patterns of MoO3 and Mo2N(γ)
由图7 可见,在12.8°、23.4°、25.7°、27.3°、33.8°、35.5°、39.0°、45.8°、49.3°、55.3°和58.8°均出现尖而高的特征衍射峰,与标准数据库相关物质的XRD 特征衍射峰一致,证明是MoO3结构;在37.1°、43.1°、62.7°、75.8°、79.5°出现新的特征衍射峰,之前的特征衍射峰均消失,而其峰位置与标准数据库Mo2N 特征衍射峰一致,表明生成的产物为Mo2N,且无杂质生成。
3 结论
(1)采用高温焙烧法制备Mo2N 前驱体MoO3有利于合成较高比表面积的Mo2N。
(2)单因素实验考察了Mo2N 比表面积随氢氮比、氮化剂空速、恒温时间及升温速率的变化情况。结果表明,当氢氮比为4.5∶1 时,产物的比表面积最大,为29.16m2·g-1;当氮化剂空速为45000h-1时,产物的比表面积最大,为131.6m2·g-1;当恒温时间为1h 时,Mo2N 的比表面积为17.76m2·g-1;当升温速率为273.6K·min-1时,比表面积可达最大,为140.6m2·g-1。
(3)通过正交实验,确定了Mo2N 合成的较优条件为:氮化剂空速为45000h-1,升温速率为273.6K·min-1,氢氮比(体积比)为4.5∶1、恒温时间为1h。在上述条件下进行验证实验,Mo2N 比表面积可达176.8m2·g-1。

