不同酶改性木薯淀粉及其结构分析
吴儒龙,刘钰馨,梁泽升,廖梁燕,李媛媛
(南宁师范大学化学与材料学院,广西天然高分子化学与物理重点实验室,广西南宁 530001)
淀粉是一种天然高分子材料,主要来源于植物,属于可再生资源。淀粉分子[1]有直链和支链两种分子,前者通过α-1,4糖苷键连接,后者通过α-1,4和α-1,6糖苷键连接。淀粉具有多种优异性能,如可生物降解、价格低廉易获取以及良好的生物相容性,在生物医药、化工和食品生产等领域有广泛的应用[2]。但淀粉还存在着诸多不足,如木薯天然淀粉糊化温度低,颗粒表面滑,没有孔洞[3,4]。在很大程度上限制了它的应用。为了充分利用和发挥淀粉的优良性质,拓宽其应用范围,需要对淀粉进行改性处理。目前,改性淀粉的制备方法主要有化学、物理、生物和复合改性法,用酶改性淀粉是一种环保有效的生物改性方法。利用生物催化反应可显著降低淀粉的分子量,且具有酶用量少、速度快、无污染的特点[5]。近几年国内外对木薯淀粉的酶改性研究较多,已成为国内外的研究热点。Kewalee等[6]用化学法和生物法对木薯淀粉进行改性,酶改性木薯淀粉表面被侵蚀产生许多大浅孔,盐酸水解淀粉则呈表面粗糙小圆形颗粒。盐酸改性后淀粉结晶度增大。Jairo等[7]对木薯淀粉通过酶促修饰,酶改性淀粉颗粒外部受到腐蚀并降解,改性后结晶度增加,糊化温度随结晶度的增加而升高。蔡敏[8]使用复合酶对木薯淀粉进行酶解,α-淀粉酶和葡萄糖淀粉酶的质量比为1:3时,淀粉表面具有很多微小孔。从淀粉酶改性后颗粒形貌来看,结果差异较大,可能是使用淀粉品种和酶源不同。本文研究不同酶协同处理木薯淀粉制备酶改性木薯淀粉,通过扫描电镜(SEM)、X射线衍射(XRD)、傅里叶变换红外光谱(FT-IR)、偏光显微镜(PLM)研究酶改性木薯淀粉的颗粒形态结构、酶解过程、球晶结构、晶型及基团等结构的变化规律,为木薯淀粉酶改性机理研究和木薯淀粉的应用提供参考。
1 实验部分
1.1 实验原料及试剂
木薯淀粉(食品级,直链含量17.4wt%,含水量13wt%),广西南宁市明阳生化股份有限公司;α-淀粉酶(BR,酶活力3.8×104U/g),上海易恩化学技术有限公司;糖化酶(BR,酶活力1.0×105U/g),上海源叶生物科技有限公司;木瓜蛋白酶(食品级),河南万邦实业有限公司;柠檬酸(分析纯),萍乡市白狮化学试剂有限责任公司;磷酸氢二钠(分析纯),天津市大茂化学试剂厂;氢氧化钠(分析纯),天津市鼎盛鑫化工有限公司。
1.2 实验设备及仪器
SQP电子天平,赛多利斯科学仪器有限公司;MS-H280-Pro加热型磁力搅拌器,大龙兴创实验仪器有限公司;59XC-PC偏光显微镜,上海光学仪器一厂;DZF-6050真空干燥箱,上海齐欣科学仪器有限公司;TESCAN MIRA扫描电子显微镜,捷克TESCAN公司;D8 Advance X射线衍射仪,德国Bruker公司;iS10红外光谱仪,美国Thermo Fisher公司;Q20差示扫描量热仪,美国TA公司
1.3 试样的制备
精确称取20 g的木薯淀粉加入到250 mL三角瓶中,加入磷酸氢二钠-柠檬酸缓冲液调节pH值至5.0,温度50 ℃,配置成浓度为20%(质量分数)的淀粉乳液。在恒温水浴锅中预热15 min,然后加入一定淀粉干基质量x%(质量分数)的混合酶,进行酶解反应12 h后,加入10 mL 4%(质量分数)氢氧化钠溶液终止反应。然后离心将沉淀进行抽滤,用去离子水洗3~4次,最后放入50 ℃烘箱中干燥12 h,粉碎过200目筛后即可得到改性木薯淀粉。
1.4 表征及测试
1.4.1 偏光显微镜(PLM)测试
将淀粉样品调配成一定浓度的淀粉乳,用移液枪量取少量于载玻片上,盖上盖玻片,置于偏光显微镜下,采用400倍放大倍数观察淀粉样品球晶形貌并拍照。
1.4.2 扫描电子显微镜(SEM)测试
将试样在真空干燥箱40 ℃干燥4 h后,用双面导电胶固定在扫描电镜专用的载物台上,取少量淀粉样品于导电胶上,置于真空条件下喷金处理后,将载物台放入样品室进行观察并拍照,扫描电镜电压设置为5.0 kV。
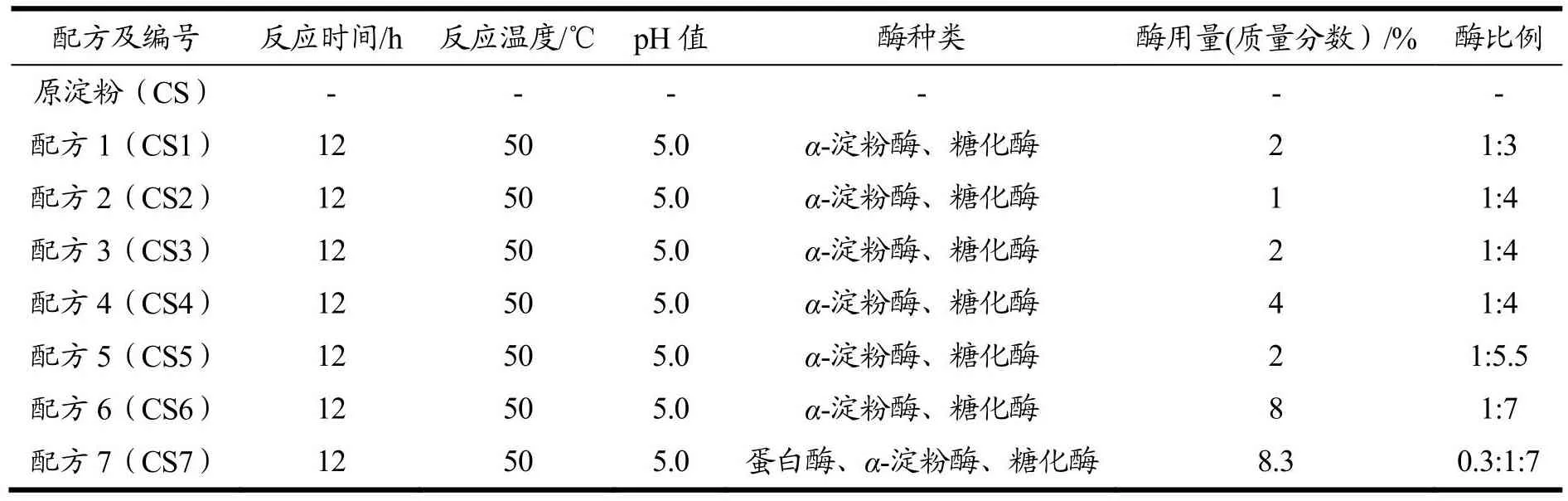
表1 改性淀粉试样配方Table 1 Modified starch sample formula
1.4.3 傅氏变换红外光谱仪(FT-IR)测试
将淀粉试样压片后采用全反射ATR模式进行实验,扫描波长范围为400~4 000 cm-1,扫描分辨率2 cm-1。
1.4.4 X射线衍射(XRD)测试
将淀粉试样在5~40o范围步宽为0.02o在40 kV电压和25 mA电流进行测试。XRD数据通过Jade6软件分峰拟合计算得到淀粉结晶度。
1.4.5 差示扫描量热法(DSC)测试
称取3 mg试样至坩埚铝盘中,加入9 µL去离子水加盖密封。放入温度为15 ℃,湿度为70%的恒温恒湿箱中平衡24 h。在气流量为50 mL/min的氮气气氛中以10 ℃/min升温速率,从40 ℃升温到100 ℃条件下进行测试。并用SPSS统计分析软件计算得到关于熔融焓和熔融温度显著性分析。
1.5 数据分析
采用Origin 2018制图,SPSS 26方差分析,试验结果为三次测量平均值,数据使用¯x±s表示。
2 结果与讨论
2.1 淀粉颗粒形态分析
图1为天然木薯淀粉和不同酶用量水解淀粉颗粒的SEM照片。从图1(a~e)发现天然淀粉颗粒表面光滑,颗粒饱满。从图1(b、c、d,f、g、h)可以看出,酶处理过的淀粉颗粒减小,表面被大面积侵蚀,有大量凹坑。酶用量为1%时,淀粉颗粒表面出现大量的小而浅凹坑。酶用量增加到2%,颗粒表面进一步被水解,侵蚀面积增大。酶用量达到4%时,淀粉颗粒表面被腐蚀更加严重,凹坑变深。α-淀粉酶和糖化酶水解木薯淀粉,酶侵蚀主要发生在淀粉颗粒表面[9]。

图1 不同酶用量作用下淀粉的SEM图Fig.1 SEM of starch by different enzymes content
图2显示天然和不同酶配比水解淀粉颗粒的SEM照片。天然淀粉颗粒圆形或半截球形,表面光滑,而水解淀粉颗粒表面被大面积侵蚀,出现凹陷。随糖化酶用量的增加,淀粉颗粒被腐蚀而破碎的程度越高,原因在于糖化酶不仅能作用于α-1,4-糖苷键,也能缓慢水解支链淀粉的α-1,6-糖苷键。但没有出现较深的孔隙,可能是木薯淀粉存在光滑表面以及颗粒之间和颗粒内的适合酶催化作用的位点较少,酶无法进入内部进行水解,从而产生较少的深孔[10]。

图2 不同酶比例作用下淀粉的SEM图Fig.2 SEM of starch bydifferent enzymes proportions
图3为天然木薯淀粉和不同酶种类水解淀粉颗粒的SEM照片。SEM显微照片显示,天然淀粉颗粒圆形或半截球形,表面光滑,酶水解的淀粉颗粒都有不同程度的破碎,颗粒表面及内部被严重侵蚀,淀粉颗粒内部已经形成中空结构。α-淀粉酶主要水解淀粉的无定形区域,糖化酶主要水解淀粉的结晶区域[11]。随着酶用量的增加及改变酶配比,淀粉的结晶区域也受到酶水解形成中空结构。淀粉颗粒外壳还保持着较好的形态。块根淀粉外层结构排列紧密,酶无法直接进入淀粉内部进行水解[12]。淀粉颗粒的表面与内部具有蛋白质、脂质,是淀粉颗粒酶改性过程的第一道屏障[13]。蛋白酶对淀粉表面蛋白去除有明显效果[14],可增加酶和淀粉的结合位点,更利于酶的水解,因此增加酶用量以及改变酶配比对水解淀粉起到明显作用。

图3 不同酶种类作用下淀粉的SEM图Fig.3 SEM of starch bydifferent types of enzymes
2.2 晶体形态分析
图4显示天然和不同酶用量水解淀粉的偏光照片。图4a~e可看出,天然淀粉颗粒形态完整,呈圆形。在正交偏光下观察到天然淀粉球晶双折射现象十分明显,出现大量十字消光现象。图4(b~f、c~g、d~h)可以看到,在不同酶量的作用下,淀粉颗粒在透射偏光下,淀粉颗粒结构受到破坏,在正交偏光观察下发现,这些颗粒十字消光现象减弱或消失。随着酶用量的增加,淀粉结晶区也受到酶作用而被破坏。
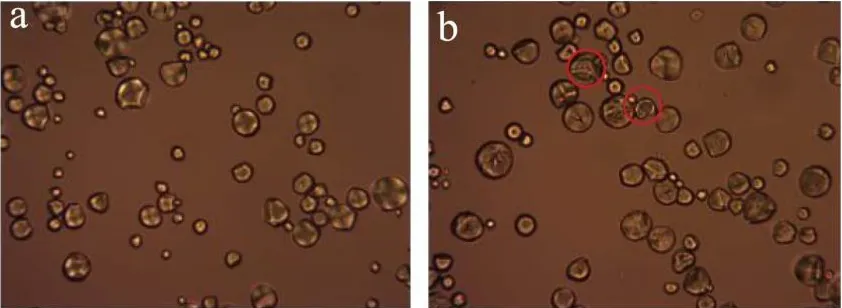

图4 不同酶用量作用下淀粉的偏光图(400×)Fig.4 Polarizing micrographs of starch by different enzymes content (400×)
图5为不同酶配比水解淀粉晶体的照片。图5(a~e)天然淀粉颗粒形态完整,呈球形。在正交偏光观察下天然淀粉球晶双折射现象明显,偏光十字完整。从图5(b~f、c~g、d~h)可以看到在不同酶配比的作用下,随着糖化酶配比的增加,淀粉颗粒结构受到破坏,颗粒凹陷。在正交偏光观察下发现,这些颗粒十字消光现象减弱或消失。随着糖化酶配比的增加,凹陷颗粒数量增多。
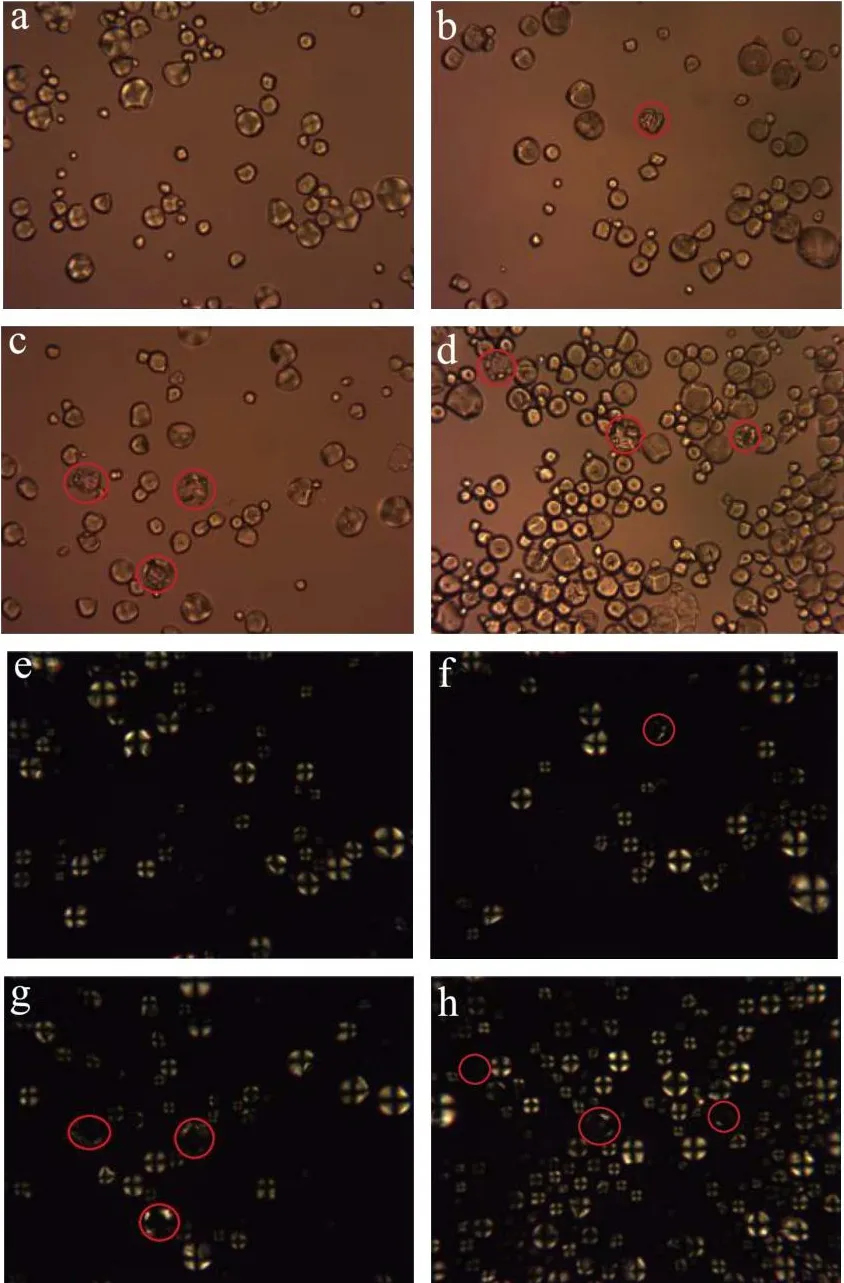
图5 不同酶比例作用下淀粉的偏光图(400×)Fig.5 Polarizing micrographs of starch by different enzymes proportions (400×)
图6显示了天然和不同酶种类水解淀粉颗粒的偏光照片。图6(a~d)天然淀粉颗粒形态完整,在正交偏光下淀粉球晶双折射现象十分明显。从图6(b~e、c~f)可以看出在不同酶种类的作用下,淀粉颗粒在偏光下观察到淀粉颗粒结构受到破坏,图3(b~e、c~f)的扫描电镜图也显示了淀粉颗粒中心被酶解,剩下外部结构的壳而形成的空腔。在正交偏光观察下发现,淀粉颗粒偏光十字现象减弱甚至消失。
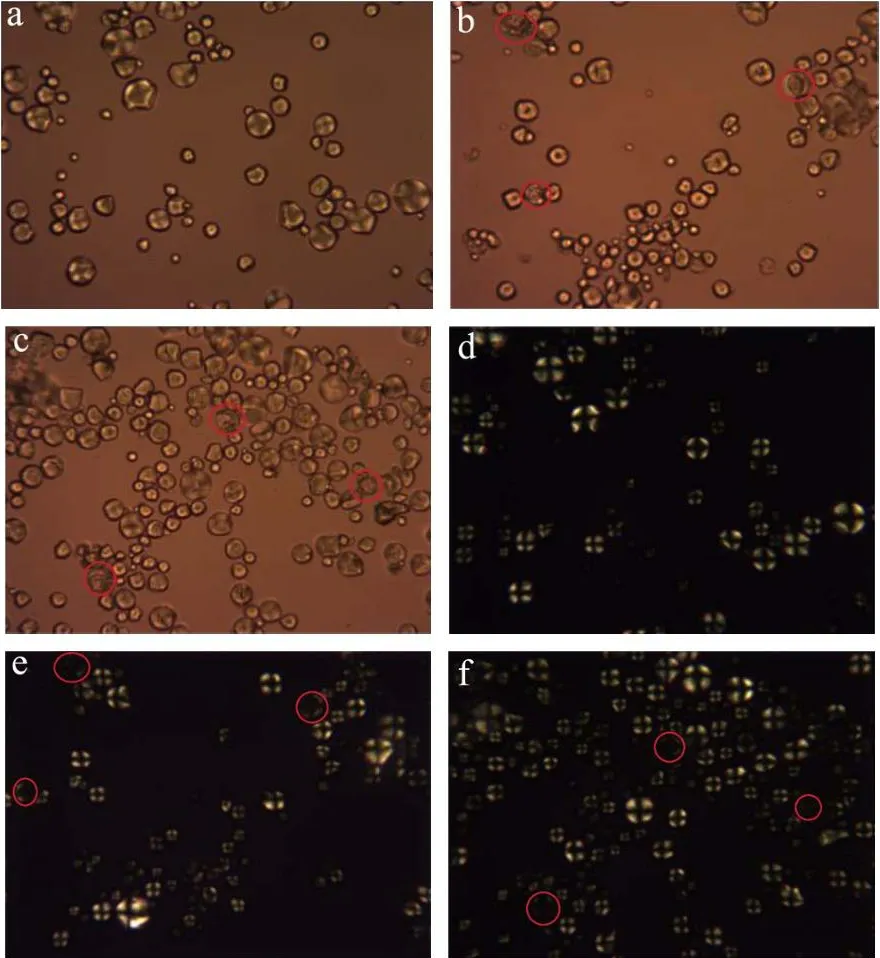
图6 不同酶种类作用下淀粉的偏光图(400×)Fig.6 Polarizing micrographs of starch by with different types of enzymes
2.3 基团分析
如图7所示为不同酶用量作用下木薯淀粉的红外光谱图。酶改性后的木薯淀粉在3 397 cm-1的峰属于-OH的伸缩振动;在2 932 cm-1出现一个中等强度的峰是-CH2不对称伸缩振动;1 648 cm-1附近的吸收峰为无定形区域H2O的弯曲振动;在1 455 cm-1附近的吸收峰是-CH2弯曲振动;1 417 cm-1和1 370 cm-1附近吸收峰分别归属为-CH2弯曲振动和-CH弯曲振动。1 340 cm-1附近的吸收峰是-CH2弯曲振动以及C-O-H弯曲振动;1 157 cm-1附近的吸收峰归属于C-O和C-C键的伸缩振动;1 080 cm-1附近的吸收峰是C-H的弯曲振动;1 019 cm-1附近的吸收峰归属于C-O伸缩振动以及C-OH弯曲振动;931 cm-1附近的吸收峰是α-1,4糖苷键(C-O-C)的骨架振动[15]。在4 000~400 cm-1的整个光谱范围内,Kumar等[16]红外峰进行的归属相类似,没有新的吸收峰出现,说明酶改性的淀粉仍具有原来的基本官能团。
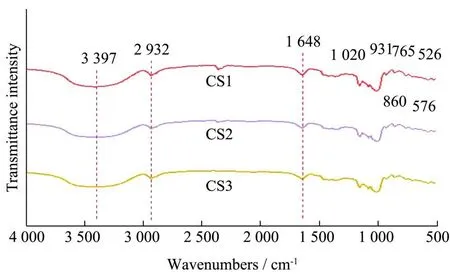
图7 不同酶用量作用下木薯淀粉的红外光谱图Fig.7 FT-IR spectra of the treated cassava starch with different enzymes content
2.4 晶型分析
天然木薯淀粉和酶改性后木薯淀粉的XRD如图8所示。不同晶型的淀粉产生衍射峰的衍射角角度不同,A型淀粉晶型在15 °、17 °、18 °、20 °和23 °会出现衍射峰,一般在5.6 °、15 °、17 °、20 °和24 °为B型淀粉晶型[17]。在30 °~35 °出现的峰与淀粉酶结晶有关,C型淀粉由A型和B型转化[18],其衍射峰包含A型和B型的衍射峰[19]。图8为天然淀粉和酶改性后的XRD图,由图可知,天然淀粉的衍射角2θ在5.6 °、15 °、17.2 °、22 °和24 °处有衍射峰,因此天然淀粉的晶型为B型。酶改性后的淀粉的衍射角2θ在5.6 °衍射峰消失,15 °、17.1 °、18 °和23 °处有衍射峰,晶型显示为A型。晶型由B型转变为A型。在木薯淀粉酶解过程中,先水解淀粉颗粒中结构松散的无定形区域[20],增加酶用量到4%,淀粉相对结晶度达到了40.03%。其次同时增加酶用量及糖化酶比例(8%,1:7)淀粉颗粒的结晶区域也会受到水解[21],淀粉结晶度增加至41.41%,可能是酶用量及糖化酶比例增加,使淀粉的无定形区域水解程度远大于结晶区域的水解程度。添加蛋白酶后,可增加酶和淀粉的结合位点,更利于酶的水解,结晶度从41.41%下降到37.17%。天然木薯淀粉的相对结晶度为33.38%,通过酶处理后,相对结晶度都有所提高,最高为41.41%。
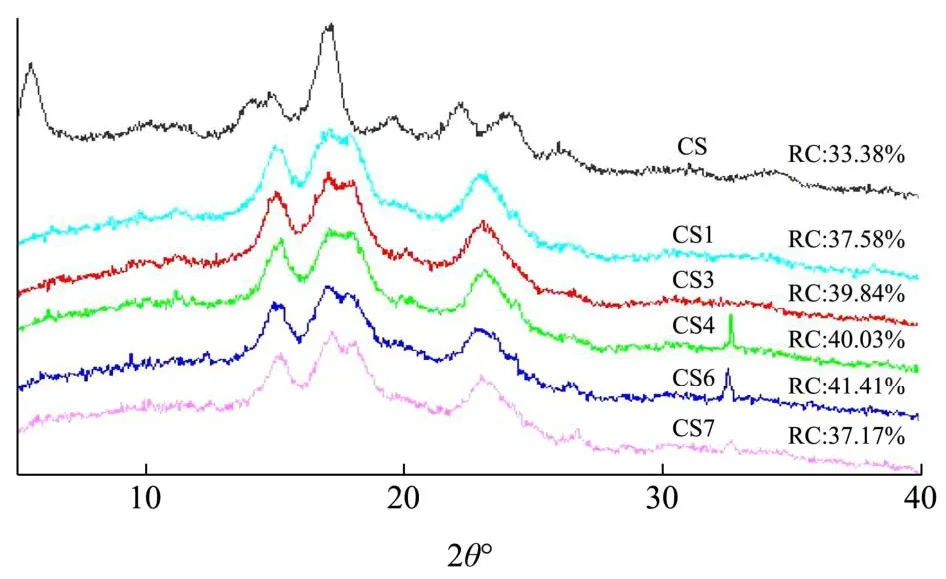
图8 天然木薯淀粉和酶改性木薯淀粉的XRD图Fig.8 X-ray diffraction pattern of nativecassava starch and enzyme modified cassava starch
2.5 熔融焓和熔融温度分析
用差示扫描量热法(DSC)测定木薯淀粉经酶处理前后的热性能。天然木薯淀粉和酶改性后木薯淀粉的糊化曲线如图9所示。天然木薯淀粉和酶改性木薯淀粉有明显的热转变,这是因为都发生了糊化。天然木薯淀粉熔融峰峰形较宽,酶改性后木薯淀粉熔融峰较窄。天然木薯淀粉和酶改性后木薯淀粉酶解淀粉的DSC数据如表2所示。
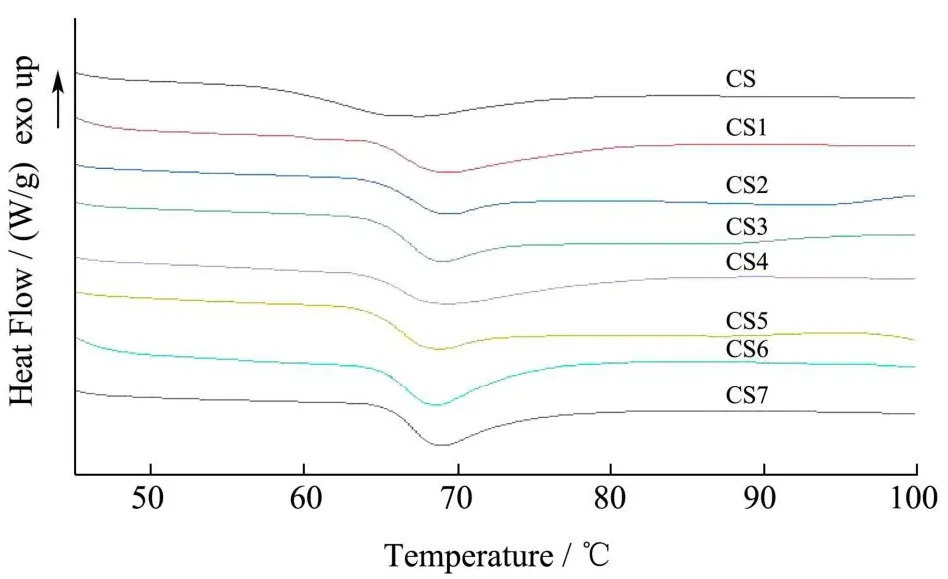
图9 天然木薯淀粉和酶改性木薯淀粉的糊化曲线Fig.9 Gelatinization curves of nativecassava starch and enzyme modified cassava starch
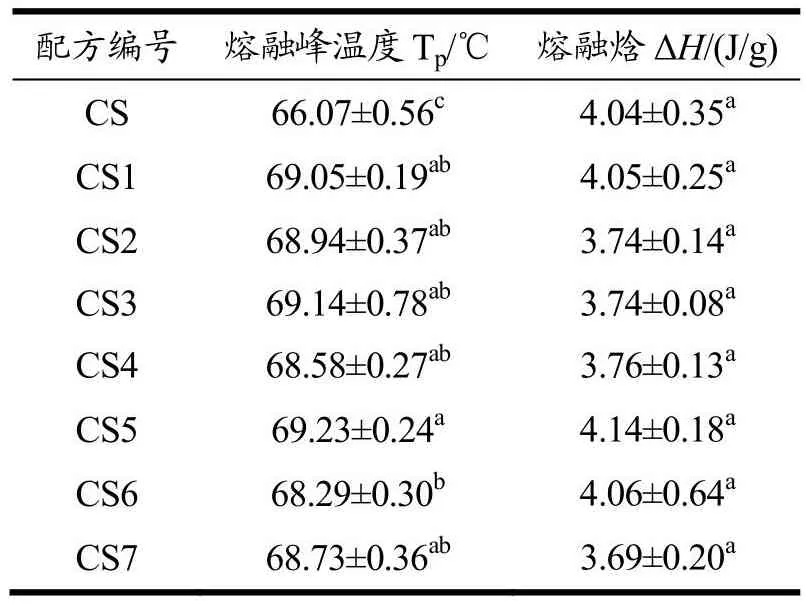
表2 天然木薯淀粉和酶改性木薯淀粉的DSC数据Table 2 DSC data of nativecassava starch and enzyme modified cassava starch
在酶比例(1:4)相同,酶用量(1%、2%、4%)不同条件下水解淀粉。改性前CS的Tp和ΔH分别为66.07 ℃和4.04 J/g。酶改性后CS2、CS3、CS4的Tp和ΔH分别68.94 ℃、69.14 ℃、68.58 ℃和3.74 J/g、3.74 J/g、3.76 J/g。结果显示酶水解延缓了糊化过程,酶处理提高了热转变温度。天然淀粉结晶度为33.38%,酶处理后结晶度为40.03%,表明酶水解主要发生在无定形区[20],进一步提高了淀粉的结晶度[22]。在酶比例(1:4),酶用量(1%、2%、4%)条件下水解,CS2、CS3、CS4的Tp和ΔH没有显著差异。糊化焓(ΔH)定义为破坏淀粉结晶区域中的双螺旋结构所需的能量。相比于天然淀粉,CS2、CS3、CS4的ΔH无显著差异,CS2、CS3、CS4的Tp显著差异。随着酶用量的增加,结晶区/无定型区被破坏,结晶度增加,理论上糊化焓值增大,但DSC结果显示糊化焓值无显著差异。这可能跟晶体的完善程度有关,可能是无定形区的深度水解,以及结晶区被酶水解后,其双螺旋结构有序度降低,晶体完善程度低但结晶度增大。淀粉酶解后结晶度增加,但双螺旋结构有序度降低,晶体完善程度低,导致糊化焓值无显著差异。
在酶量(2%)相同,酶比例(1:3、1:4、1:5.5)不同条件下水解淀粉。酶改性后CS1、CS3、CS5的Tp和ΔH分别69.05 ℃、69.14 ℃、69.23 ℃和4.05 J/g、3.74 J/g、4.14 J/g。随着酶比例的增大,酶改性淀粉的Tp升高,Tp从改性前的66.07 ℃升高到69.23 ℃。结果表明糖化酶比例增加,酶改性淀粉结晶度从37.58%提高到39.84%。淀粉的水解程度也会增大,这与王伟健等[23]研究结果一致。在酶量(2%)相同,酶比例(1:3、1:4、1:5.5)不同条件下水解淀粉,CS5的Tp与CS1、CS3有显著差异。CS1、CS3、CS5的ΔH与天然淀粉相比无显著差异。随着糖化酶用量的增加,结晶区/无定型区被破坏,结晶度增加,糊化焓值理论上会增大,但DSC结果显示糊化焓值无显著差异。淀粉酶解后结晶度增加,但双螺旋结构有序度降低,晶体完善程度低,导致糊化焓值无显著差异,这与前文得到结论一致。
在酶量(8%)和酶比例(1:7)相同,酶种类不同(蛋白酶、α-淀粉酶、糖化酶和α-淀粉酶、糖化酶)条件下水解淀粉。酶改性后CS6、CS7的Tp和ΔH分别68.29、68.73 ℃和4.06、3.69 J/g。结果显示增大酶用量以及改变酶配比,改性淀粉的Tp和ΔH都增大。添加蛋白酶后Tp增大,ΔH无显著差异。CS6的ΔH较天然淀粉无显著变化,酶处理后影响到结晶区域双螺旋结构,可能是双螺旋结构的降低,但双螺旋结构发展有序程度较高,形成高度有序的晶体结构[24],结晶度也有所提高。添加蛋白酶后,结晶度较CS6有所下降。蛋白酶对淀粉表面蛋白去除有明显效果[14],可增加酶和淀粉的结合位点,有利于酶水解,无定形区和结晶区水解程度增加,相对结晶度减少。
3 结论
通过酶对木薯淀粉进行改性研究,发现α-淀粉酶和糖化酶用量及糖化酶配比较低时,对木薯淀粉颗粒表面进行水解。随着α-淀粉酶和糖化酶用量的增加、糖化酶配比增大和添加蛋白酶后,木薯淀粉表面及内部都受到水解,形成中空结构,淀粉颗粒的十字消光现象减弱甚至消失。α-淀粉酶、糖化酶和蛋白酶处理并未使淀粉分子形成新的官能团,而是影响淀粉分子内的结构以及分子链的排列,使其结晶度增加,晶型由B型转变为A型。酶改性延缓了淀粉糊化过程,提高了糊化温度。研究结果表明不同酶用量、酶配比和酶种类会对木薯淀粉颗粒表面和内部进行酶解,并造成不同结构的变化。通过实验有助于揭示酶对木薯淀粉的改性作用机理,并为深入研究木薯淀粉的应用提供理论依据。
——微网状透光防炫目汽车前挡风玻璃膜的设计研究

