改性纤维素磁球负载溶菌酶的制备及其抗菌性能
张晓婉,张嘉慧,李威龙,马芹,卜贤盼,王建国,
(1.西北农林科技大学食品科学与工程学院,陕西杨凌 712100)(2.安康市富硒产品研发中心,陕西安康 725000)
食品中腐败菌的生长严重威胁食品的质量与安全,消费者需要更新鲜和加工适度的产品,符合上述要求的果汁在人类饮食中占有重要地位。脂环酸芽孢杆菌是导致果汁腐败变质的主要菌种,其已成为果汁行业的重要目标和关注点。
脂环酸芽孢杆菌(Alicyclobacillus acidoterrestris)是一种好氧或兼性厌氧的革兰氏阳性菌[1],与大多数芽孢杆菌的耐受pH值相比,脂环酸芽孢杆菌可低至2.5,因此又被称为嗜酸耐热菌。脂环酸芽孢杆菌是非致病性细菌,但在果汁中会产生有烟熏味的愈创木酚和消毒水味的卤酚[2]等次级代谢产物而使果汁浑浊,出现不愉快气味,进而严重影响果汁的品质[3]。脂环酸芽孢杆菌具有嗜酸、耐热、强抗逆性等生理生化特征,传统的巴氏灭菌对其抑制效果并不理想[4,5],而其他物理或化学灭菌方法对其作用也有限。因此,开发安全、高效、环保的抗菌材料尤为重要。
根据报道,目前已经开发出一系列含有溶菌酶的抗菌材料用于伤口敷料和食品包装,但是,溶菌酶和基质之间松散的连接可能会导致溶菌酶迁移造成二次污染,或者可能需要使用昂贵的交联剂,因此在溶菌酶和底物之间引入稳定的共价键可能是避免上述问题的更好选择。本研究采用聚多巴胺涂覆纤维素磁球的方法将溶菌酶负载到磁球上,聚多巴胺起到连接磁球和溶菌酶的桥梁作用。聚多巴胺具有良好的生物相容性和丰富的官能团,可在几乎任何基质表面形成涂层用于功能化改性。Cheng等[6]在聚多巴胺修饰的二氧化硅纳米粒子表面引入靶向聚合物聚乙二醇-叶酸作为治疗宫颈癌的模型药物;Ren等[7]使用聚多巴胺包覆的磁性纳米粒子固定脂肪酶用于催化不同的反应;Sureshkumar等[8]通过多巴胺自聚合涂覆在甲壳素颗粒上用于固定淀粉水解酶,这些实验均已证明当聚多巴胺沉积在固体表面上时,它可与含有胺或硫醇的功能性配体通过迈克尔加成反应或席夫碱反应相结合。截止目前未见报导使用该方法负载溶菌酶针对A.acidoterrestris(DSM3922)进行抑制的相关记录。
由于绿色标签的普及以及消费者和监管机构对健康和食品安全的担忧,对天然抗菌剂的需求有所增加。溶菌酶(Lysozyme,Lyz)是常用的Generally Recognized as Safe(GRAS)级的天然抗菌蛋白[9,10],其性质稳定,尤其是在酸性条件下这一特征更为明显。其抗菌机理主要是破坏细菌细胞壁,使N-乙酰氨基葡萄糖与N-乙酰胞壁酸之间的β-1,4糖苷键断裂致使内容物流出,故溶菌酶又称胞壁质酶[11]。溶菌酶作为保鲜剂,现已广泛应用于食品领域的防腐保鲜,对人体无毒副作用,且具有一定的保健功效,已被国际食品法典委员会和我国卫生部门允许应用于食品加工领域[12]。
虽然溶菌酶直接投放到食品中可以发挥抑制A.acidoterrestris的作用,但已使用的溶菌酶无法回收利用,造成二次污染的同时增加了食品工业的生产成本和资源的耗费。为解决这一问题,向抗菌剂载体中加入磁性纳米粒子可构建具有磁响应性的抗菌材料,从而快速磁分离达到回收利用的目的。磁赤铁矿(γ-Fe2O3)纳米颗粒具有优异的生物相容性、热稳定性、化学稳定性以及超顺磁行为,近年来在生物医学和水处理等领域实现了广泛的应用[13,14],本研究选择将其加入抗菌材料。
本研究以纤维素为原材料,通过溶凝胶转变法制得纤维素磁球。多巴胺盐酸盐在碱性条件下氧化自聚合涂覆在纤维素磁球上形成聚多巴胺涂层,溶菌酶通过官能团间相互作用接枝到聚多巴胺涂层上,用以去除果汁中的脂环酸芽孢杆菌。通过SEM、FT-IR、XPS、EDX、VSM、TGA、XRD对复合球进行表征,通过比浊法测定复合球对A.acidoterrestris的抑制性。纤维素磁球负载溶菌酶可为食品安全提供低成本和绿色途径,在保持抗菌活性的同时防止对环境的二次污染。
1 材料与方法
1.1 原料与试剂
棉短绒纤维素,购自湖北化纤集团有限公司;一水合氢氧化锂、尿素、氯化钠、Tris,均购自国药集团化学试剂有限公司;γ-Fe2O3,购自阿拉丁化学试剂有限公司;溶菌酶、多巴胺盐酸盐购自麦克林化学试剂有限公司;盐酸购自四川西陇科学有限公司;脂环酸芽孢杆菌(A.acidoterrestris)DSM 3922购自德国微生物菌种保藏中心。
1.2 仪器与设备
Vetex 70傅里叶变换红外光谱仪,德国布鲁克公司;TGA/DSC 3+热重分析仪,瑞士梅特勒-托利多公司;D/max 2200PC X射线衍射仪,日本理学株式会社;MIRA LMS扫描电子显微镜,捷克TESCAN公司;UV2700紫外-可见分光光度计,日本岛津公司;VSM7404振动样品磁强计,美国Lake Shore公司;ESCALAB 250Xi X射线光电子能谱仪,美国ThermoFischer公司。
1.3 试验方法
1.3.1 纤维素磁球的制备
将4 g纯纤维素(PC)用玻璃棒分散到由8 wt%LiOH·H2O/15 wt% Urea/77 wt% H2O配制成的绿色溶剂(100 mL)中。混合溶液在-20 ℃下冰冻,取出后在室温下解冻,得到浓度为4 wt%的透明纤维素溶液。在机械搅拌下,向溶液中加入0.5 gγ-Fe2O3纳米粒子,继续搅拌1 h,以保证纳米颗粒的均匀分散,随后,用注射器将溶液滴入10 wt%氯化钠溶液中成球并过夜固化,用蒸馏水多次洗涤并透析除去绿色溶剂,排除绿色溶剂对磁球抑菌性能的影响,利用此方法得到的磁性纤维素球命名为RC[15],将制备方法相同但未加入γ-Fe2O3纳米粒子的纯纤维素球称为CB。
1.3.2 聚多巴胺涂覆的纤维素磁球的的制备
多巴胺盐酸盐溶液(2 mg/mL)的配制:将1 g多巴胺盐酸盐溶于500 mL Tris-HCl缓冲液中(pH值8.5,10 mmol/L)搅拌均匀。
将300个纤维素磁球分成三批每批100个分别分散到100 mL多巴胺盐酸盐溶液中,室温下分别混合搅拌4、8、16 h,随后磁分离取出磁球,并用去离子水彻底冲洗,以除去残留的溶剂和未聚合的多巴胺[16],排除杂质对磁球抑菌性能的影响。
1.3.3 溶菌酶的固定化
将不同聚多巴胺涂覆时间处理过的纤维素磁球分别溶于50 mL溶菌酶溶液中(5 mg/mL),室温下搅拌24 h,用蒸馏水清洗数次,常温干燥至恒重。将经过4、8、16 h多巴胺盐酸盐溶液处理后制备而成的溶菌酶固定的纤维素磁球分别命名为LC-1、LC-2和LC-3。
1.3.4 官能团分析
用于确定样品的化学结构。将干燥的样品和溴化钾(1:100)充分研磨压片。在4 000~400 cm-1的范围内以4 cm-1的分辨率扫描16次得到样品的红外光谱图。
1.3.5 形貌表征
使用扫描电子显微镜观察样品的表面形貌。取样品粘到导电胶上,使用溅射镀膜仪10 mA下喷金45 s,随后使用扫描电子显微镜拍摄样品形貌,加速电压为3 kV。能谱mapping拍摄时加速电压为15 kV,探测器为SE2二次电子探测器。
1.3.6 磁化强度分析
使用振动样品磁强计研究γ-Fe2O3纳米粒子和样品在室温下-1.5~1.5 T磁场强度范围内的磁性。
1.3.7 晶型结构分析
样品的晶体结构是在2θ=5~80°的区间范围内通过X射线衍射仪在λ=0.154 06 nm、40 kV、40 mA的Cu Kα辐射下进行测定。
1.3.8 元素及键能分析
采用X射线光电子能谱仪测定样品表面元素组成,其中测试通能全谱为50 eV,窄谱为20 eV,步长为0.05 eV,停留时间为40~50 ms。
1.3.9 热稳定性分析
通过热重分析仪分析样品热稳定性。加热范围25~600 ℃,加热速率为10 ℃/min,氮气氛保护。
1.3.10 抗菌活性测试
AAM培养基的配制:称取葡萄糖2.0 g、酵母浸粉2.0 g、(NH4)2SO40.4 g、MgSO4·7H2O 1.0 g、无水CaCl20.38 g、KH2PO41.2 g溶解于1 L蒸馏水中,H2SO4调pH值4.2,121 ℃高压灭菌15 min备用。
取脂环酸芽孢杆菌DSM 3922菌种冻存管,室温融化后接种于AAM培养基中,45 ℃摇床培养12 h待用。采用生长曲线法测定样品的抗菌活性。将新鲜AAM培养基配制成含菌量约为每毫升含1×104CFU的菌悬液。50 mL纯净培养基为空白组(BlACK),加入50 mg RC的菌悬液为对照组,实验组为分别含有0.75、1.25、2.5、5、10、20 mg/mL溶菌酶的菌悬液,测试溶菌酶在该实验条件下的最小抑菌浓度。
称取RC、LC-1、LC-2和LC-3样品各50 mg,分别加入50 mL菌悬液,50 mL培养基为空白组(Black),加入RC的菌悬液为对照组,全部培养瓶置于45 ℃摇床培养12 h,每隔2 h测定各组在600 nm处的吸光度值(OD600)。
1.3.11 数据分析
使用Origin 9.1软件进行数据处理,采用Image J 1.8.0软件进行粒径统计。
2 结果与讨论
2.1 溶菌酶涂覆的纤维素磁球的制备与表征
2.1.1 LCs的制备
LCs的制备流程如图1所示。纤维素通过冻融法溶解于LiOH·H2O/Urea体系,γ-Fe2O3磁性纳米粒子与纤维素溶解体系充分混合后在NaCl凝固浴中再生成球。多巴胺盐酸盐氧化自聚合在纤维素磁球表面形成聚多巴胺涂层,溶菌酶于涂层表面实现接枝固定。
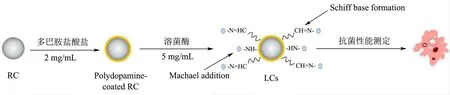
图1 纤维素磁球负载溶菌酶的制备流程图Fig.1 Flow chart of preparation of lysozyme-coated cellulose magnetic beads
2.1.2 形貌分析
图2是纯纤维素球CB,纤维素磁球RC,涂覆接枝磁球LC-3的干燥前后形貌图对比和LC-3的粒径分布图对比。单纯的纤维素球呈乳白色透明状,加入γ-Fe2O3后,颜色由乳白色变为粉红色,经过聚多巴胺涂覆和溶菌酶的接枝后,复合球颜色转变为黑色。通过ImageJ软件测得LC-3干燥前后平均直径分别为3.20和1.45 mm。干燥后球的直径急剧减小,这可能是由于球中水含量降低,使得纤维素氢键网络结构更加致密。

图2 干燥前后CB(a,e)、RC(b,f)、LC-3(c,g)的形貌图和LC-3(d,h)的粒径分布图Fig.2 Topography of CB (a, e), RC (b, f), LC-3 (c, g) and particle size distribution of LC-3 (d, h) before and after drying
图3是RC、LC-1和LC-3的扫描电镜图像。纤维素在溶解与再生的过程中,由于水诱导的相分离,RC中富含溶剂的区域形成了孔隙和粗糙表面,这与Luo等[17]研究一致。由于多巴胺氧化自聚合形成松散的薄层,涂覆在纤维素磁球的表面和溶菌酶的少量接枝,使得LC-1表面较为平滑,这与Xi等[16]的研究相类似。随着涂覆时间的增加,LC-3上聚多巴胺粒子不断堆积,涂层变厚,高放大倍数下,在其表面观察到无数小的微粒,由Ji等[18]可知这是由于聚多巴胺涂层提供了足够多的活性位点因而接枝了大量的溶菌酶粒子。

图3 RC(a-e)、LC-1(f-j)和LC-3(k-o)的扫描电镜图Fig.3 SEM images of RC (a-e), LC-1 (f-j) and LC-3 (k-o)
2.1.3 官能团分析
RC和LCs的FT-IR谱图如图4所示。所有纤维素球在3 400 cm-1处的宽吸收峰归因于羟基的伸缩振动。对于LCs,1 000 cm-1附近处出现的吸收峰是由苯环引起的,这与Sureshkumar等[8]的实验结果一致。由Zhang等[19]可知1 650 cm-1的吸收峰是由于芳香环中的C=C共振以及N-H弯曲振动叠加引起。2 800~3 200 cm-1的吸收峰变宽,强度变弱是由于酚羟基拉伸引起的,Li等[20]和Song等[21]在研究中也发现这些官能团归因于儿茶酚胺和醌,证明聚多巴胺成功涂覆在纤维素球表面。在1 477 cm-1处发现的吸收峰归因于溶菌酶中甲基C-H的弯曲振动,Sebti等[22]也报道了类似的研究结果,表明溶菌酶成功锚定在纤维素磁球上。

图4 RC、LC-1、LC-2和LC-3的FT-IR光谱图Fig.4 FT-IR spectra of RC, LC-1, LC-2 and LC-3
2.1.4 热稳定性分析
如RC、LCs的热重分析谱图5a和微分差热重分析谱图5b图所示。在热重分析谱图中,RC和LCs有相同的减重趋势,100~200 ℃的质量损失归因于水分的蒸发,这与Tan等[23]的研究结果一致。随着温度持续升高,在300~370 ℃范围内质量损失明显,这是由于纤维素分子链降解,Nie等[24]也报道了相同的结果。在第三阶段370 ℃之后纤维素燃烧和碳化,使质量又出现一定程度的下降,这与Zhang等[25]的研究结果类似。LCs在60%质量损失时所对应温度分别为358、365和393 ℃,这表明随着聚多巴胺涂覆时间增强,LCs的质量损失出现不同程度的减少,且涂覆时间越长,质量损失越少,600 ℃时,RC和LCs具有不同的质量损失率是因为纤维素磁球表面经过聚多巴胺涂覆和溶菌酶接枝后在一定程度上保护了一部分纤维素免受碳化,降低了质量损失,进而提升了纤维素磁球的热稳定性。LC-1聚多巴胺涂覆时间短,因此在热重分析谱图和微分差热重分析谱图中其谱图几乎与RC谱图重合。在微分差热重分析谱图中,RC的起始降解温度(T0)为300 ℃,最大降解速率温度(Tm)为346 ℃,对应的最大降解速率绝对值为1.84。在349和343 ℃,LC-2和LC-3有最大降解速率,绝对值分别为1.44和1.16,小于RC。以上结果表明,聚多巴胺的涂覆和溶菌酶的固定没有破坏纤维素磁球的稳定性,反而在某种程度上提升了其稳定性,这将有助于复合球在食品工业领域中广泛应用。
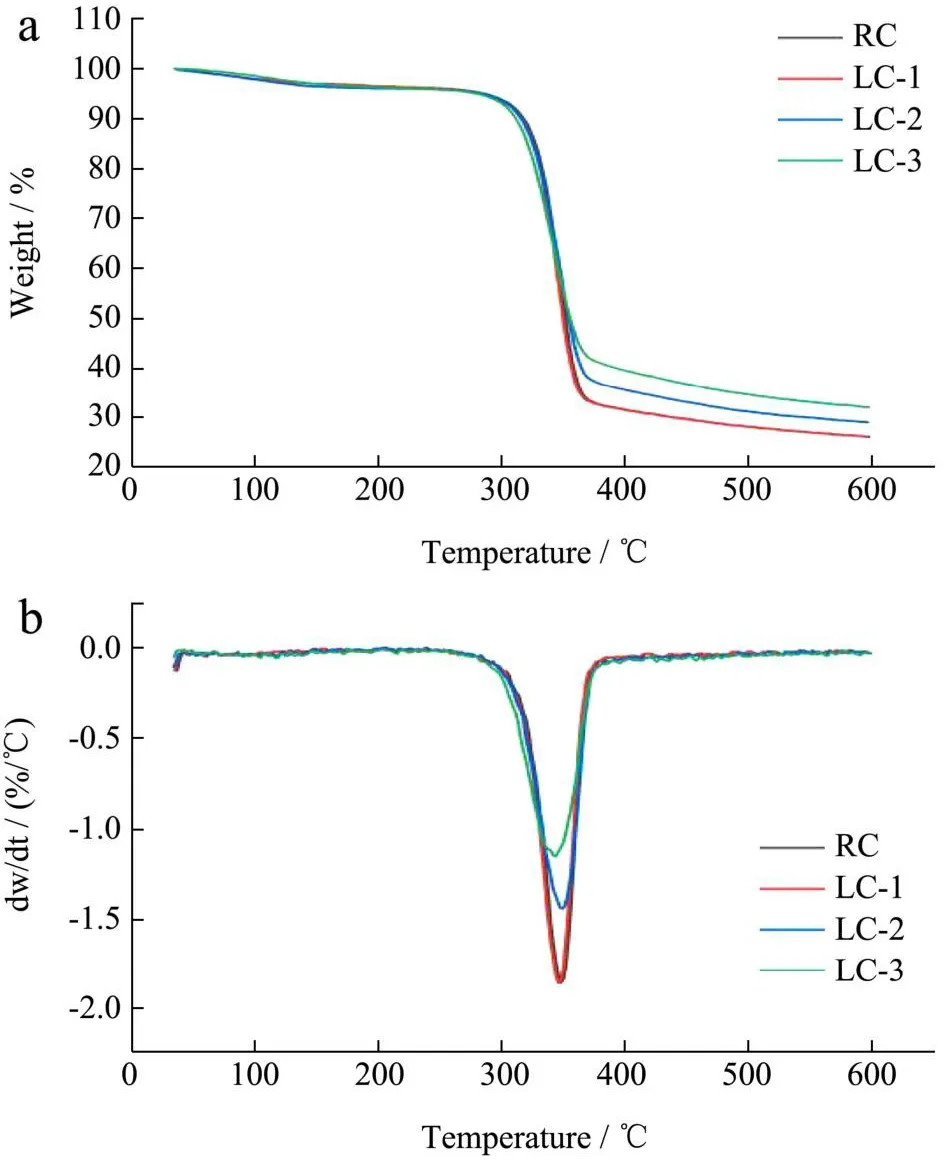
图5 RC、LCs的TGA谱图(a)和DTG(b)谱图Fig.5 TGA (a) and DTG (b) of RC and LCs
2.1.5 磁化强度分析
RC和LCs的磁滞回线如图6所示。各组样品的磁化强度随外加场强的增加而增大,RC、LC-1和LC-3的饱和磁化强度值Ms分别为5.68、5.54和5.38 emu/g,由Tan等[23]的研究可知,γ-Fe2O3的磁化强度为219.73 emu/g,与之相比,RC和LCs磁化强度有明显的下降,这表明γ-Fe2O3被纤维素成功包覆,这与Samaneh等[26]的研究结果相一致。此外,由图6d可知,与RC相比,LCs的饱和磁化强度值Ms随着聚多巴胺和溶菌酶的修饰而降低,这可能是由于涂覆接枝增加了复合球的尺寸和质量,表明聚多巴胺涂层和溶菌酶的修饰是成功的。3条S形磁滞回线均表现出零剩磁和矫顽力,表明复合材料继承了γ-Fe2O3超顺磁特性,Yinfeng等[23]在研究中通过使用外部磁铁实现了磁球在几秒钟内快速分离和收集,分离过程表明了其在食品或水处理领域具有潜在的应用前景,可避免二次污染,且常温下可储存,这有利于纤维素磁球在食品工业中的回收再利用。
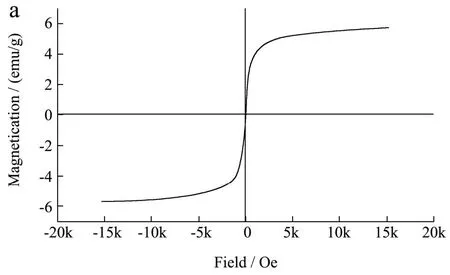
图6 RC(a)、LC-1(b)、LC-3(c)的磁滞回线和饱和磁化强度值比较(d)Fig.6 Comparison of saturation magnetization values (d) and hysteresis loops of RC (a), LC-1 (b), and LC-3 (c)
2.1.6 元素及键能分析
各组样品的XPS分析如图7所示。在图7a中,RC仅显示出C、O两个峰,而在图7b和图7c中,LCs均显示出额外的N峰,证明聚多巴胺和溶菌酶成功修饰在纤维素磁球上,此结果与图8中EDS谱图结果一致。
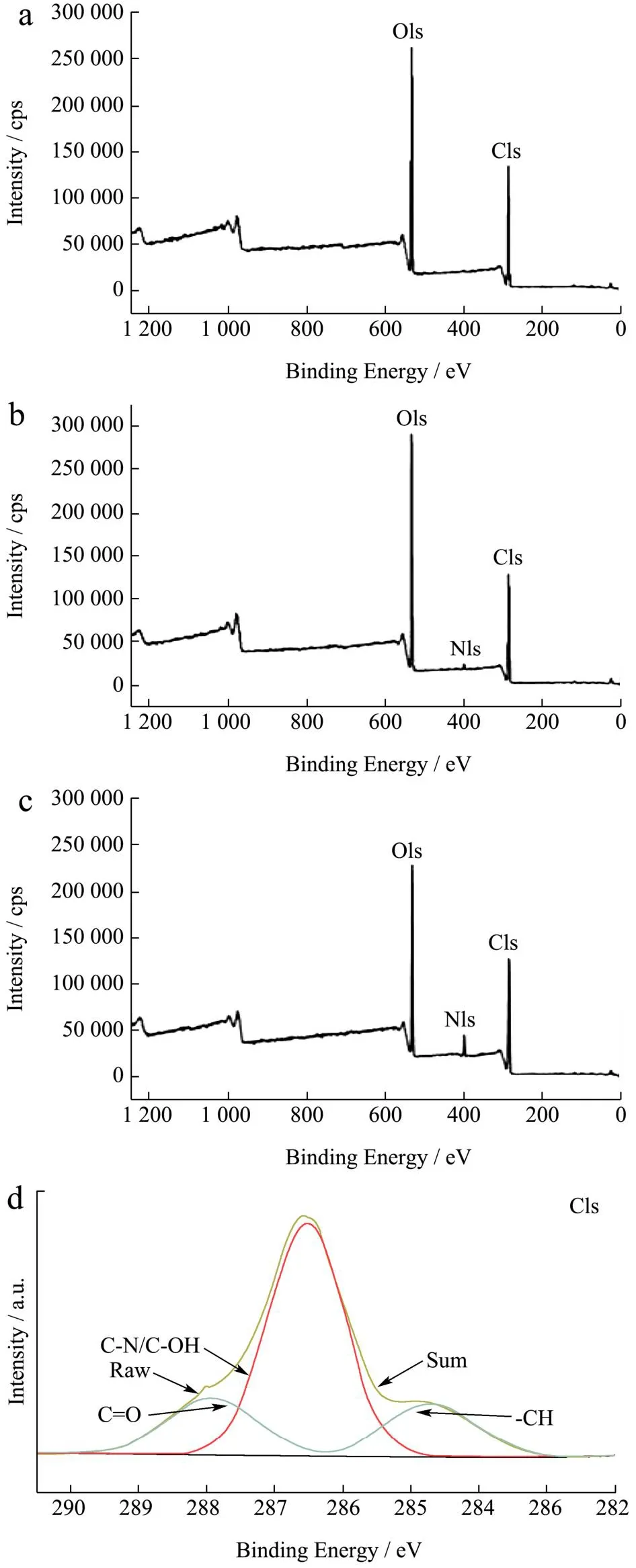
图7 RC(a)、LC-1(b)和LC-3(c)的XPS全谱图,LC-3的C1s(d)、O1s(e)、N1s(f)谱图Fig.7 XPS spectrum for the RC (a), LC-1 (b), LC-3 (c), the corresponding spectra of LC-3 for C1s (d), O1s (e) and N1s (f)
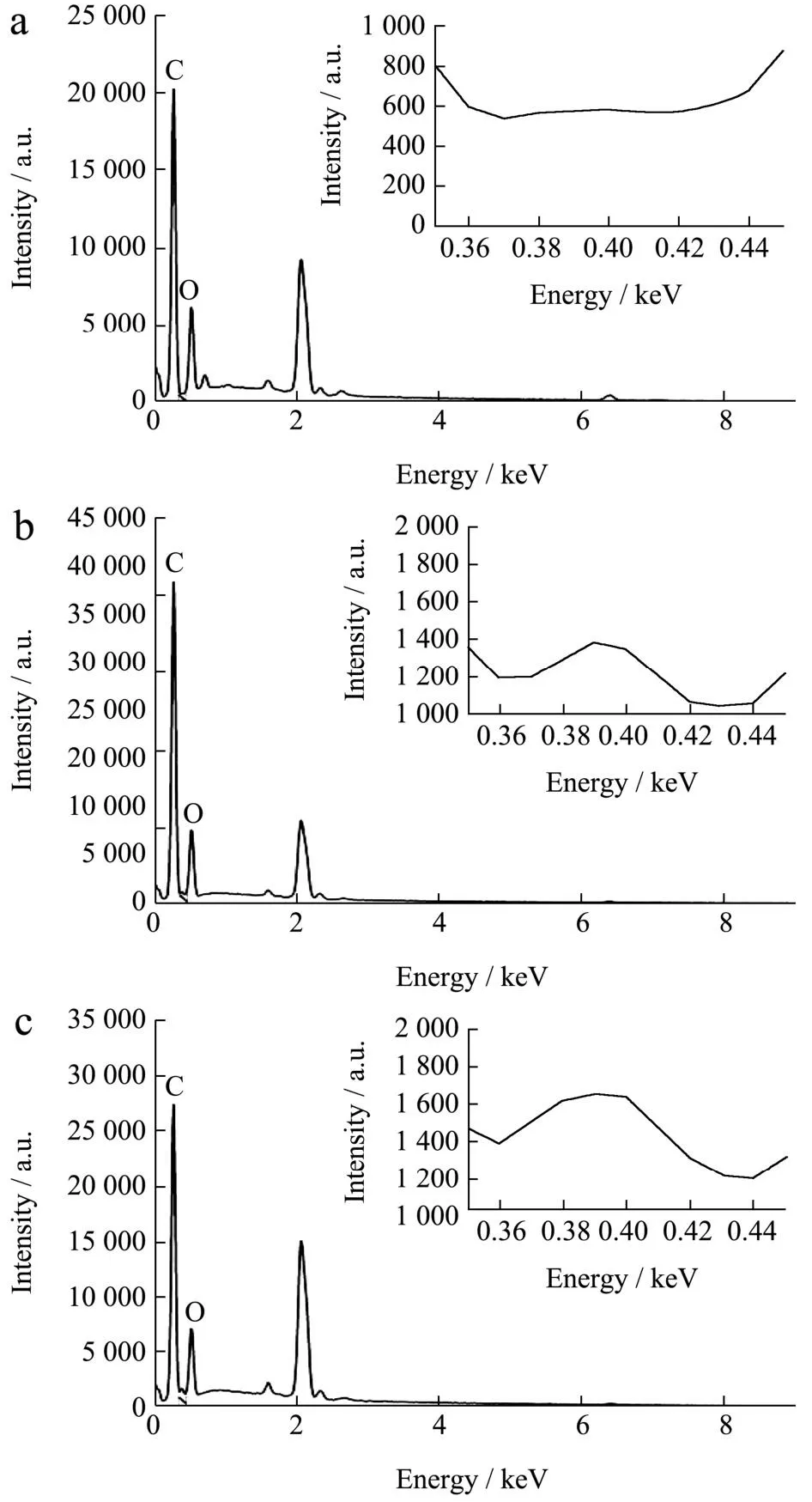
图8 RC(g)、LC-1(h)、LC-3(i)的EDS谱图Fig.8 EDS spectrum for the RC (g), LC-1 (h) and LC-3 (i)
在C1s(d)谱图中可以看到284.8、286.3、288 eV处产生了三个峰,分别对应于-CH[27]、C-N/C-OH[28]和C=O键。O1s(e)区域光谱在531.7和532.4 eV处有两个峰,归因于C=O[29]和-OH键。532.4 eV的结合能来源于聚多巴胺中儿茶酚和多巴胺奎宁形式的氧自由基,Xi等[18]也有相同的结果。Fazli等[30]发现单一的聚多巴胺仅在399.8 eV处显示出N-R(N-C或N-H)峰,本研究与其结果一致。而在LC-3(f)中,401.2和399.0 eV处出现新的谱带,其分别代表着苯环与溶菌酶间的R-N-R连接键和酰胺键,这些结果表明溶菌酶的氨基和聚多巴胺的苯基之间通过迈克尔加成反应和席夫碱反应结合在一起,Lee等[31]和Zhang等[32]此前均有类似的报道。在XPS谱图和EDS谱图中,Fe元素含量极少,这可能是由于纤维素将绝大多数γ-Fe2O3包裹在球内,表面Fe元素含量低,后经涂覆接枝改性,复合球表面Fe元素含量进一步降低。
2.1.7 晶形结构分析
图9为纯纤维素(PC)、再生纤维素球(CB)、γ-Fe2O3和LCs的XRD谱图。在PC谱图中2θ=15.0 °、16.5 °、22.8 °和34.5 °为其衍射峰,对应于纤维素I处(-110)、(110)、(200)和(004)的晶面,实验结果与Xu等[33]一致。CB谱图中,在2θ=12.2 °、20.1 °和21.9 °处观察到纤维素II晶体的特征峰,对应于(-110)、(110)和(020)的晶面[34],这表明纤维素在溶解和再生后晶形结构由I型转变为II型,此结果与Cai等[35]一致。LCs纤维素II型晶体的特征峰强度较CB明显降低,这是由于纤维素球中添加了磁性纳米粒子,且纤维素I型晶体时表观特征为棉短绒纤维,而II型晶体时对应纤维素磁球,干燥后机械性能明显提升。由右图可知,聚多巴胺涂覆时间的增强对纤维素晶形结构无明显影响。同时,在2θ=30.3 °、33.1 °、35.7 °、43.3 °、49.5 °、53.7 °、57.2 °和62.9 °处LCs均表现出相同的γ-Fe2O3的特征衍射峰,分别对应于(220)、(310)、(311)、(400)、(421)、(422)、(511)和(440)晶面,Cai等[35]也有相同的结论,表明聚多巴胺和溶菌酶修饰没有明显影响磁性纳米粒子的晶体结构。

图9 PC、CB、γ-Fe2O3和LCs的XRD谱图Fig.9 XRD spectra of PC, CB, γ-Fe2O3 and LCs
2.2 LCs在抗菌领域的应用
2.2.1 溶菌酶抗菌活性分析
溶菌酶的抗菌活性如图10所示。50 mL纯净培养基为空白组(BlACK),对照组为加入了50 mg RC的菌悬液,通过之前的预实验确定了RC对A.acidoterrestris的生长无影响。将分别含有0.75、1.25、2.5、5、10、20 mg/mL溶菌酶的菌悬液设为实验组,测试溶菌酶在该实验条件下的最小抑菌浓度。当溶菌酶浓度达到0.75 mg/mL及以上时对脂环酸芽孢杆菌有很好的抑制性,这是由于脂环酸芽孢杆菌为革兰氏阳性菌,溶菌酶通过对脂环酸芽孢杆菌的细胞壁靶向水解从而达到抗菌作用[11]。由于在该实验条件下实测溶菌酶最小抑菌浓度较低,故合理推测纤维素磁球上溶菌酶的接枝量可以对A.acidoterrestris产生抑制,因而继续进行后续负载溶菌酶的实验。
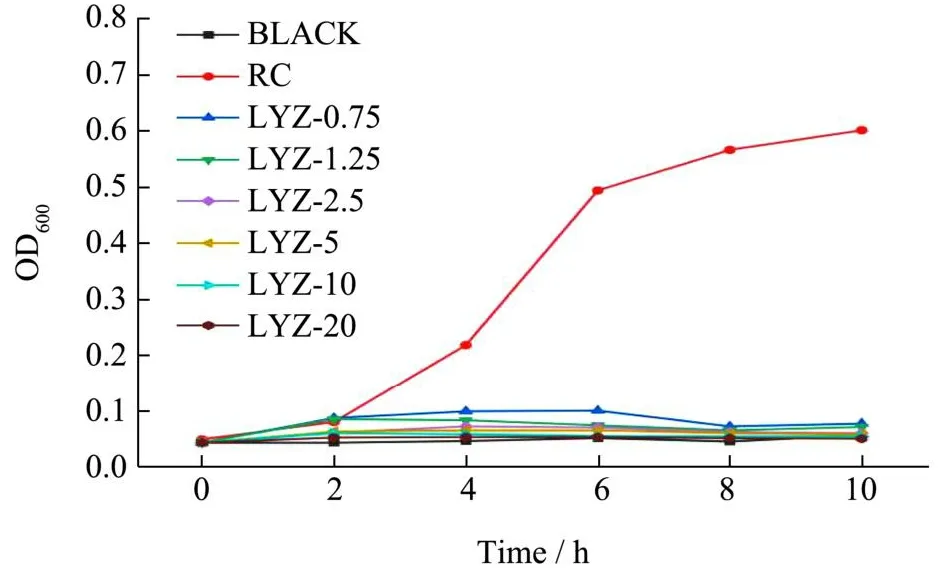
图10 不同浓度溶菌酶对脂环酸芽孢杆菌的抗菌活性Fig.10 Antibacterial activities of different concentrations of lysozyme against A.acidoterrestris
2.2.2 复合球抗菌活性分析
复合球的抗菌活性如图11所示。对照组RC的OD600值在2h后开始明显上升,表明菌体开始快速繁殖。所有经过涂覆接枝的纤维素磁球均对脂环酸芽孢杆菌显示出优异的抗菌活性,菌的生长几乎被完全抑制,LC-3的抑制效果最强,这是由于经过长时间聚多巴胺涂覆的纤维素磁球溶菌酶接枝量更大,抗菌效果更好。虽然溶菌酶在食品加工中具有明确的优势,但在液态食品中必须达到一定浓度才能抑制微生物的生长,故需要消耗大量溶菌酶才能抑制少量的A.acidoterrestris。因此,在果汁中添加溶菌酶是一种低效且昂贵的果汁杀菌方式,将其制备成抗菌材料可节省果汁工业的生产成本和造成的资源浪费。

图11 复合球对脂环酸芽孢杆菌的抗菌活性Fig.11 Antibacterial activities of RC and LCs against Alicyclobacillus
2.3 LCs的安全性评价
本研究制备的抗菌材料由以下几部分组成:纤维素、溶菌酶、γ-Fe2O3纳米粒子、聚多巴胺。纤维素及纤维素基抗菌材料具有安全无毒等优点,现已广泛应用于食品包装、药物输送、污水处理等领域[36];溶菌酶已被国际食品法典委员会和我国卫生部门允许应用于食品加工领域[12];γ-Fe2O3纳米粒子由于其优异的生物相容性、表面可修饰性、热化学稳定性和超顺磁性,近年来已在食品抗菌材料、生物医学、水处理等领域得到应用[23];在食品安全检测领域,聚多巴胺因其丰富的官能团和吸附位点,近年来作为功能化复合材料已在食品样品的多种痕量有机污染物的检测中发挥应用,推动了食品样品前处理技术向着绿色化方向前进[37]。综上可知,本研究制备的抗菌复合球可安全应用于食品加工等领域。
3 结论
本研究通过溶胶-凝胶转化法构建磁性纤维素球,聚多巴胺由多巴胺盐酸盐在碱性条件下形成并包覆在纤维素磁球表层,再通过席夫碱反应与迈克尔加成反应将溶菌酶与聚多巴胺共价结合形成交联聚合物,生成由溶菌酶锚定的纤维素磁球,该复合球具有磁响应性灵敏,热稳定性好的特点。抗菌试验表明纤维素磁球能有效抑制脂环酸芽孢杆菌的生长。本研究制备的复合球为降低果汁领域中脂环酸芽孢杆菌的危害提出了理论构想,将在后续研究中进一步以多种果汁为模型进行实际抗菌应用实验。此外,该复合球具有成本低、效率高、便于回收、可生物降解等优点,在食品工业和其他领域具有广阔的应用前景。

