一种分区温控的实时荧光PCR快速热循环系统设计
陈尔东, 高孜航, 王坤东, 雷华明
(上海交通大学 电子信息与电气工程学院,上海 200240)
聚合酶链式反应(Polymerase Chain Reaction, PCR)技术可以实现体外快速扩增DNA片段,自1983年由Mullis等[1]发明以来被广泛运用于基因检测领域.由此发展而来的实时荧光定量PCR仪通过荧光分子插入DNA片段中实现对待测DNA样本的定量检测[2].PCR反应主要分为3步:变性、退火、延伸.重复这3个步骤实现DNA片段的分裂、配对和复制,该反应需要热循环系统精确控制样品在65~95 ℃循环[3-4].PCR的效率和速度取决于反应的内容如聚合酶浓度和引物设计[5],以及有效温度循环、影响反应开始时的转变温度和斜坡温度的持续时间[6].目前常见的PCR热循环系统存在耗时长、操作复杂、设备成本高的问题[7].其通过保持试液静止,控制加热基座温度变化对试液进行升温和降温[8],完成一次检测需要进行35~40次温度循环约2~3 h,时间大部分耗费在控制加热基座和周围环境的温度变化上[9-11].针对上述问题,Wu等[12]开发了基于管道的油浴PCR加热方法,通过多物理场仿真,确定合适的管道尺寸,利用液体自然对流实现不同温度之间的循环流动.Li 等[13]使用半导体制冷器(Thermoelectric Cooler,TEC)作为热源,通过改进的多模式比例积分微分 (Proportional Integral Derivative, PID)算法减少稳态时间、提高反应速率,该方法需要复杂的温控算法,在温度变化过程中容易受到超调、振荡的不良影响[14].Trauba等[15]采用微流控技术使用4个铜块作为热源,20 μL样品流经由聚碳酸酯制成的微流体管道实现加热,约52 s 可以实现30次循环,但这类PCR制造成本高且后期不能修改循环次数[16].此外,也有学者使用非接触式传热方式来提高效率,Lee等[17]采用激光对样品进行加热,与传统方式相比激光能量密度高且没有热惯性,可以有效提高热循环效率,但设备结构复杂、成本高且难以小型化.
随着PCR技术的发展,研究人员发现将退火温度和延伸温度合为一个温度也能实现基因扩增,即两步法 PCR,常用于靶基因较短的扩增,该方法和需要3个不同温度点的标准PCR反应相比,所需时间较短,控制较为方便[18].本研究采用二步法PCR方案,设计了PCR热循环系统的机械结构及其温控电路,使用增量式PID算法控制基座温度稳定在65和95 ℃实现两个恒温区,通过使样品盘在不同恒温区域中旋转,实现快速温度循环.避免了加热器件温度反复变化,能明显节约反应时间,提高检测效率.同时,针对PCR试液温度变化过程中的传热滞后效应[19-20],分析了该热循环系统的结构并构建传热机理,采用Fluent软件对试液加热的延迟现象进行有限元分析.由上述仿真结果对该热循环系统PCR试液的真实温度变化规律进行合理预测并对温度延迟时间补偿,最后利用PCR热循环系统样机进行试验验证,得到试液的实际温度变化,结果表明该设计PCR热循环系统能提高检测效率,满足快速PCR检测的需求.
1 PCR热循环系统硬件设计
1.1 机械结构设计
PCR热循环系统的机械结构主要包括加热基座和试液盘,如图1所示.加热基座实现分区温控,将温度分为65 ℃恒温区、95 ℃恒温区、冷却区.试液盘具有4个试液腔可以同时检测4路样品.腔体底部采用一层薄膜,隔绝外部环境又能保证与加热块紧密接触增加传热效率.加热基座包括6个紫铜加热块,用温控电路将加热块稳定在设定温度,加热块之间使用硅酸铝棉包覆以降低与空气的对流换热系数,铜块由下方的加热陶瓷片进行加热,温度传感器嵌入铝块和陶瓷加热片之间检测加热基座的温度.
将待测试液装载样品盘中后,上位机发送指令控制样品盘旋转,依次经过95 ℃恒温区、冷却区、65 ℃ 恒温区,旋转一周可实现2次热循环.重复以上过程以实现DNA的扩增.在每次循环结束后,试液腔都会经过加热基座上的荧光检测开孔,激发光和荧光分别经过该孔入射和出射,实现实时荧光定量检测功能.
1.2 电路设计
PCR热循环的电路部分实现对两个恒温区温度的高精度控制,确保PCR反应能正常进行.其电路的主要成如图2所示,包括上位机、主控模块、温控驱动模块、测温模块.

图2 PCR热循环系统电路构成Fig.2 Circuit composition of PCR thermal cycling system
主控模块由STM32C8T6及外围电路组成,主要控制脉冲宽度调制(Pulse Width Modulation, PWM)驱动电路加热陶瓷片、读取温度值以及将温度数据通过控制器局域网总线(Controller Area Network, CAN)通信协议传输给上位机模块.
温度驱动模块主要由L6203桥式驱动芯片和加热陶瓷片组成,主控模块产生PWM信号,通过SN74LVCT45将晶体管-晶体管逻辑(Transistor-Transistor Logic, TTL)电平转换为+5 V电平的同时增加驱动能力,最后输出到L6203芯片产生最大5 A的电流驱动加热陶瓷片.采用的薄膜陶瓷片内阻为10 Ω,考虑芯片的散热条件,最大加热功率能达到10 W,系统启动时加热基座能到达最快6 ℃/s 的升温速率.
测温模块能实时采集加热基座的温度,并作为温控程序的反馈信号,以保证温度恒定,使PCR反应能正常完成.该模块主要包括温度传感器和AD采集电路,反应温度主要集中于50~100 ℃的中低温范围,温度传感器采用Pt100铂电阻,其精度高、稳定性好,若将温度传感器直接放入样品腔中能直接测出试液温度但容易污染试液,因此将Pt100嵌入陶瓷加热片上,后续通过分析传热过程预估试液的真实温度.AD采集电路部分使用24位模数转换器LTC2440,采用三线制电桥法测量Pt100阻值变化,随后通过AD620仪表放大器,放大倍数设15倍使其输出接近AD的量程,达到最佳精度.经测试,温度采集精度能到达±0.1 ℃.
2 试液温度仿真分析
2.1 传热机理分析
PCR热循环系统使用的热传递方式主要为热传导.试液加瓷加热片—质加热基座—试管—试液,这是一个非稳态热传递过程.在经过一定时间后,试液温度才能逐渐稳定在设定温度上.因此试液在每个恒温区的停留时间为反应时间和温度稳定需要的时间之和.试液处在一个体积小、密封的环境中做旋转运动,难以布置传感器在不影响反应的情况下直接测得试液温度,因此采用Fluent对该瞬态热传递过程进行有限元分析得到试液的真实温度变化曲线.
2.2 仿真模型构建
由热力学原理可知,热传递可分为3类边界条件:①给定边界温度;②给定边界热流密度;③给定边界换热系数和流体温度.PCR热循环系统的热传递涉及流固耦合传热,使用Fluent进行仿真分析.由于试液腔下方与加热基座直接接触,所以加载第一类边界条件,样品盘上方及左右与空气直接接触加载第三类边界条件.4个试液位置对称且传热条件一致,因此只对其中一个样品的传热过程进行仿真.各材料对应热性能参数如表1所示.
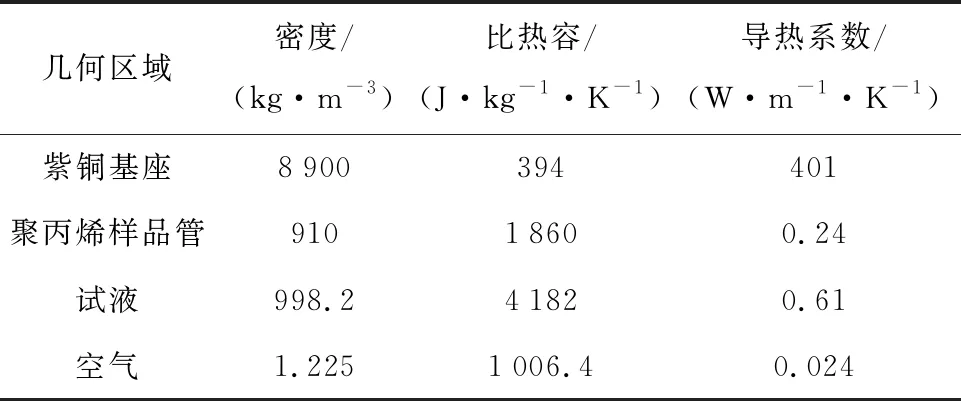
表1 传热模型各区域热物性参数
首先使用meshing进行网格划分,全局网格尺寸设置为0.2 mm,在不同材料的传热表面对网格进行膨胀加密以提高计算准确性.总共生成节点数量 98 426,单元数量 349 878,反应网格质量的偏态(skewness)系数为0.208,表明具有较好的网格质量,网格模型如图3所示.

图3 传热模型网格划分和仿真温度云图Fig.3 Meshing and simulation temperature cloud map of heat transfer model
2.3 仿真结果分析
反应的每个阶段保持时间取决于检测目标和引物的种类[21-22],以目前常见的PCR反应为例进行仿真.设定在单次循环过程中,需在95 ℃温度(T)下保持时间(t)15 s,65 ℃保持40 s.如图4所示,将该温度曲线加载为试液的边界条件进行仿真,取试液中心点的温度值绘制曲线.在变性阶段试液温度从65 ℃升温到95 ℃,此过程仅耗时5.8 s,保持该温度15 s,随后试液温度经过6.1 s从95 ℃下降并稳定在65 ℃进入退火/延伸阶段.在每个扩增循环中试液的升温和降温过程中损耗的时间仅为11.9 s,完成一次循环所需的时间为68 s.相较传统的变温式加热方法有效提升了反应速率.

图4 PCR单次循环试液温度仿真Fig.4 Temperature simulation of PCR single cycle test solution
3 温控算法设计
在PCR技术中,对温度的控制非常重要.在高温变性阶段如果温度过高会影响聚合酶的活性降低DNA扩增效率,如果温度过低会导致变性不充分,极可能出现假阴性;在低温退火阶段温度过高或者过低则会影响PCR反应的特异性.尤其对于定量PCR仪而言,需要尽可能保持每次循环温度稳定.因此,对于PCR的温度控制要求控制精度高、超调小、调节时间短.该设计采用分区温控的热循环方式,可以简化温控算法,只需保证有较小的调节时间和静态误差,无需让加热片反复升温和降温.因此采用经典PID控制,其是最早发展起来的控制策略之一,算法简单、鲁棒性好、可靠性高,被广泛应用于工业过程控制[23].PID算法可表示为
(1)
式中:Kp为比例控制系数;Ki为积分控制系数;Kd为微分控制系数;e(t)为当前值与目标值的误差.Kp能加快系统响应速度,但数值过大容易产生超调;Ki能减小系统静态误差,积分过大容易影响系统稳定性;Kp根据偏差变化趋势调节系统,能降低调节时间,但过大会引起系统振荡.为了减小误差累加,增加系统抗干扰能力,采用增量式PID算法,其算式为
Δu(k)=Kp(e(k)-e(k-1))+Kie(k)+
Kd(e(k)-2e(k-1)+e(k-2))
(2)
式中:Δu(k)为控制量的增量;e(k)、e(k-1)和e(k-2)为最近3次采样的误差值.Δu(k)仅与最近3次的采样值有关,与位置式PID相比占用内存小,改善了积分饱和现象.
最后利用Ziegler-Nichols方法进行参数整定.首先对65 ℃加热模块进行整定,将Kd=0、Ki=0,Kp设置为较小的值,随后逐渐增大Kp使系统出现等幅振荡,记录此时的增益和振荡周期,最后用经验公式求得PID参数为Kp=210、Ki=32、Kd=18.采用类似方法得到95 ℃的PID参数为Kp=100、Ki=110、Kd=250.该参数下基座的升温曲线实验结果如图5~6所示.

图5 65 ℃恒温区基座升温曲线Fig.5 Heating curve of constant temperature zone of 65 ℃

图6 95 ℃恒温区基座升温曲线Fig.6 Heating curve of constant temperature zone of 95 ℃
由加热曲线可以看出,65 ℃恒温区的超调量为0.96%,调节时间为31.2 s,静态误差为0.05 ℃;95 ℃ 恒温区的超调量为0.83%,调节时间为 23.5 s,静态误差为0.07 ℃.65 ℃恒温区面积较大热容量也较大,因此在功率相同的情况下65 ℃恒温区调节时间比95 ℃恒温区长.结果表明,该加热基座设计满足PCR系统稳态精度高的要求.
4 样机试液温度试验
搭建试验样机如图7所示,上位机控制试液盘在恒温区中进行旋转运动.使用50 μL水代替反应试液,将K型热电偶插入试液腔中对试液温度进行测量.在反应过程中,每个阶段时间应包含上文中仿真得到的热延迟时间,因此95和65 ℃的停留设置为20.8和46.1 s.采集其中两个循环的试液温度变化曲线如图8所示.

图7 PCR样机试液测温装置图Fig.7 Temperature measuring device of PCR prototype test solution

图8 试液温度变化曲线Fig.8 Temperature of test solution
该结果表明,反应过程中试液温度达到稳态后与目标温度差小于±0.2 ℃,试液热延迟引起的时滞后效应大致符合上文的仿真结果,加热时间为7.9 s,与仿真结果相差1.1 s;冷却时间为6.8 s,与仿真结果相差0.7 s,表明该仿真模型能较好地预测试液的实际变化规律,较准确地补偿实际工作中每阶段的停留时间.此外,试液在升温过程中不会受到超调的影响,实际升温速度达到3.8 ℃/s,实际降温速度达到4.4 ℃/s.实验结果显示,基于分区温控的PCR热循环系统能有效缩短PCR反应所需时间,较好实现了预期指标.
5 结语
PCR自发明以来,已成为遗传分析的强大工具.PCR反应时间与温度循环密切相关.为缩短反应时间,设计一种用于实时荧光PCR的热循环系统,采用恒温区切换的方式对试液进行加热.通过结构和软件设计,实现了±0.1 ℃的恒温区温控精度和试液最高3.8 ℃/s的升温速度以及4.4 ℃/s的降温速度.结果证明,该温控系统满足了PCR的要求,为DNA扩增提供了可靠快速的反应环境.同时,与传统变温式加热PCR仪相比,该设计避免了需控制基座反复达到目标温度的时间,缩短了单次PCR循环的过程,提高了核酸检测效率.理论仿真结合实验验证了该分区温控方案能有效提高PCR热循环效率,所提出的PCR热循环系统具有小型化、易操作、低成本的特点,从而为正在研制的实时荧光PCR仪提供了理论依据和坚实基础.

