饲料中添加丁酸梭菌对卵形鲳鲹幼鱼生长性能、血清生化指标及肠道菌群和短链脂肪酸含量的影响
吴 杨 黄倩倩 虞 为,3 徐创文 洪敏娜 蒋 魁 麦晓勇 陈海谊 林黑着,3 杨 铿,*
(1.中国水产科学研究院南海水产研究所,农业农村部南海渔业资源开发利用重点实验室,广东省渔业生态环境重点实验室,广州 510300;2.信阳农林学院,信阳 464000;3.中国水产科学研究院南海水产研究所深圳实验基地,深圳 518121;4.广州市欣海利生生物科技有限公司,广州 510300)
卵形鲳鲹(Trachinotusovatus),俗称金鲳,属于暖水性洄游鱼类。卵形鲳鲹生长快速,适温范围广[1-2],价格适宜,深受广大养殖户青睐。1989年,我国台湾省首次人工繁殖卵形鲳鲹苗种成功,卵形鲳鲹人工繁育在我国一些沿海地区快速发展并达到规模化生产水平。近年来,水产养殖业发展迅猛,卵形鲳鲹的集约化养殖规模逐渐扩大,导致水体环境恶化、鱼体疾病频发等问题日益凸显。因此,开发出一种绿色、高效的饲料产品对卵形鲳鲹养殖业的可持续发展至关重要。

1 材料与方法
1.1 试验设计
丁酸梭菌由广州某生物科技有限公司提供,其菌液活菌数实测值为1×109CFU/mL。基础饲料中蛋白质源主要由鱼粉、豆粕、花生粕、猪肉粉和大豆浓缩蛋白提供,脂肪源主要由大豆卵磷脂和鱼油提供,糖源主要由小麦粉提供。试验共配制6种等氮等能的试验饲料,丁酸梭菌添加量分别为0、0.25%、0.50%、1.00%、2.00%和4.00%。试验饲料组成及营养水平见表1。饲料开始制作之前将各种饲料原料粉碎后过40目筛网备用。饲料制作时严格按照饲料配方精准称量,采取逐级扩大法将各原料进行手动混匀,然后再搅拌混合10 min,取出初混饲料粉末,将称取好的大豆卵磷脂和鱼油加入其中,手动细致揉搓混合均匀并过40目筛网,然后放入搅拌机搅拌10 min。按梯度用量筒量取25、50、100、200、400 mL丁酸梭菌菌液于烧杯中,加纯净水至4 L(对照组加4 L纯净水)后用玻璃棒搅拌均匀,倒入搅拌完成的配合饲料粉末中,并充分混合均匀。最后进行挤条和制粒,制成2.5 mm粒径的沉性饲料。饲料于16 ℃晾干后,装入带有标签的密封袋,放入-20 ℃冰箱保存。
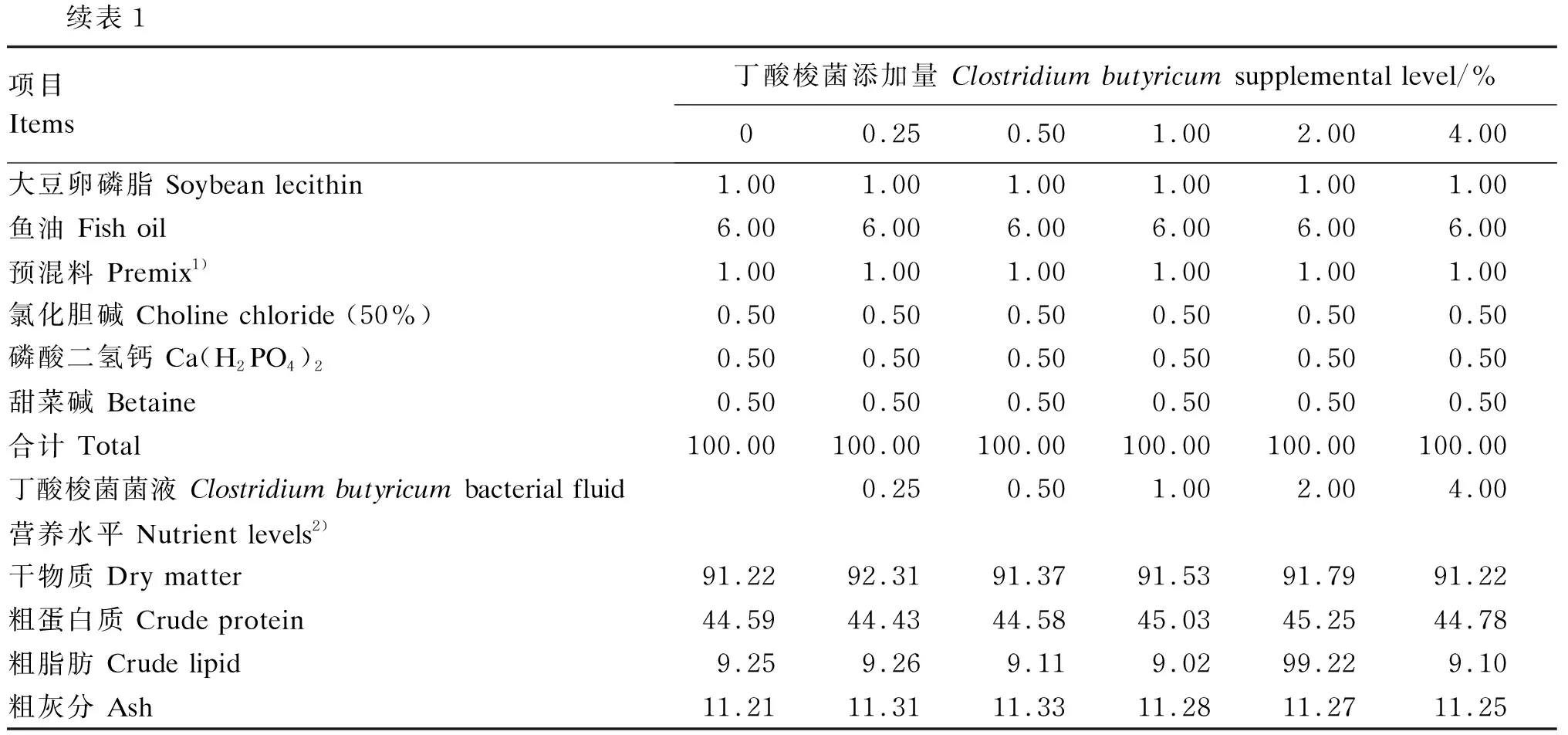
续表1项目Items丁酸梭菌添加量 Clostridium butyricum supplemental level/%00.250.501.002.004.00大豆卵磷脂 Soybean lecithin1.001.001.001.001.001.00鱼油 Fish oil6.006.006.006.006.006.00预混料 Premix1)1.001.001.001.001.001.00氯化胆碱 Choline chloride (50%)0.500.500.500.500.500.50磷酸二氢钙 Ca(H2PO4)20.500.500.500.500.500.50甜菜碱 Betaine0.500.500.500.500.500.50合计 Total100.00100.00100.00100.00100.00100.00丁酸梭菌菌液 Clostridium butyricum bacterial fluid0.250.501.002.004.00营养水平 Nutrient levels2)干物质 Dry matter91.2292.3191.3791.5391.7991.22粗蛋白质 Crude protein44.5944.4344.5845.0345.2544.78粗脂肪 Crude lipid9.259.269.119.0299.229.10粗灰分 Ash11.2111.3111.3311.2811.2711.25
1.2 试验设计和饲养管理
试验开始前,将卵形鲳鲹幼鱼在中国水产科学研究院南海水产研究所深圳试验基地池塘网箱中暂养1周后饥饿24 h,挑选活力、大小相似的试验鱼450尾,初始体质量为(9.55±0.13) g,随机分为6组,每组3个重复,每个重复25尾。各组分别投喂丁酸梭菌添加量为0(C0组,对照组)、0.25%(C1组)、0.50%(C2组)、1.00%(C3组)、2.00%(C4组)和4.00%(C5组)的试验饲料。
试验鱼饲养于规格为1.0 m×1.0 m×1.5 m的网箱里,共18个网箱,每个网箱25尾。养殖试验期间于每天06:00和17:00分别表观饱食投喂1次。试验期60 d。
1.3 样品采集
养殖试验结束后,将所有试验鱼饥饿24 h后,对每个网箱的鱼进行称重并记录。从每个网箱中随机取5尾,分别记录其体长和体质量。用1 mL无菌注射器(1%肝素钠润洗)进行尾静脉取血,将取得的血液离心(3 000×g,4 ℃)10 min,上清液用于血清生化指标的测定。取血后将试验鱼按顺序解剖取出内脏团和肝脏,并记录对应的质量。取后肠内容物约0.5 g于1.5 mL冻存管中,立即放入液氮中保存,用于肠道菌群和短链脂肪酸含量的分析。
1.4 指标测定
1.4.1 生长性能
相关指标计算公式如下:
成活率(survival rate,SR,%)=
100×终末尾数/初始尾数;
增重率(weight gain rate,WGR,%)=
100×(Wt-W0)/W0;
特定生长率(specific growth rate,SGR,%/d)=
100×(lnWt-lnW0)/t;
饲料系数(feed conversion ratio,FCR)=
F/(Wt-W0);
肥满度(condition factor,CF)=100×
W/L3;
脏体比(viscerosomatic index,VSI,%)=
100×Wv/W;
肝体比(hepatosomatic index,HSI,%)=
100×Wh/W。
式中:Wt为末均质量(g);W0为初均质量(g);t为试验天数(d);F为总摄食量(g);Wh为肝脏质量(g);Wv为内脏质量(g);W为鱼体质量(g);L为鱼体长(cm)。
1.4.2 饲料营养水平
饲料粗蛋白质、粗脂肪、水分和粗灰分含量分别通过凯氏定氮法、索氏抽提法、常压干燥法和550 ℃马弗炉灼烧法进行测定。
1.4.3 血清生化指标
血清生化指标委托广州新海医院检验中心,采用贝克曼全自动生化分析仪(HITACHI-7180,日立公司,日本)对血清总蛋白(total protein,TP)、葡萄糖(glucose,GLU)、总胆固醇(total cholesterol,TCHO)、甘油三酯(triglyceride,TG)、高密度脂蛋白(high-density lipoprotein,HDL)含量和谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartate transaminase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)活性进行测定。
1.4.4 肠道菌群
委托广州吉瑞基因技术公司利用Illumina MiSeq测序平台,对C0、C4、C5组的肠道内容物样品进行DNA提取和PCR扩增,通过16S RNA高通量测序,对肠道菌群进行分类鉴定。
1.4.5 肠道短链脂肪酸含量
肠道短链脂肪酸含量的测定参照Hsu等[15]的方法进行。将肠道食糜样品(约50 mg)与15%磷酸(50 μL)、125 μg/mL异丙酸(100 μL)和乙醚(400 μL)混合。离心后,取上清液用毛细管柱(Agilent HP-INNOWAX,Aglient公司,美国)进行气相色谱分析(Trace 1300-ISQ 7000 GC/MS,Thermo公司,美国);注入器、离子源、传输线和四极子的温度分别为250、230、250和150 ℃。程序如下:起始烘箱温度为90 ℃,分别以每分钟10、5和25 ℃的速率升高到120、150和250 ℃,并且在250 ℃保持2 min。将氦气在1.0 mL/min流速下作为载气,气相色谱条件为电子冲击电离(EI)源,单离子监测(SIM)扫描模式,电子能量为70 ev。
1.5 数据分析
试验数据采用Excel 2019处理,通过SPSS 23.0软件进行单因素方差分析(one-way ANOVA),Duncan氏法进行多重比较分析,所得数据以“平均值±标准差”表示,P<0.05为差异显著。肠道菌群采用多级物种差异判别分析(LEfSe)进行差异性检验。
2 结 果
2.1 饲料中添加丁酸梭菌对卵形鲳鲹幼鱼生长性能的影响
由表2可见,C4组的末均质量、增重率和特定生长率显著均显著高于C0和C5组(P<0.05)。C2组的肥满度显著高于C0和C5组(P<0.05)。C0和C3组的肝体比显著高于C5组(P<0.05)。各组之间成活率、饲料系数、肝体比无显著差异(P>0.05)。
2.2 饲料中添加丁酸梭菌对卵形鲳鲹幼鱼血清生化指标的影响
由表3可见,C3组的血清总胆固醇含量和碱性磷酸酶活性显著高于C5组(P<0.05)。C1和C5组的血清谷丙转氨酶活性显著高于其余各组(P<0.05)。C1组的血清谷草转氨酶活性显著高于C0和C2组(P<0.05)。C1组的血清总蛋白和葡萄糖含量最高,均显著高于C0组(P<0.05)。C1和C5组的血清高密度脂蛋白含量显著高于其余各组(P<0.05)。
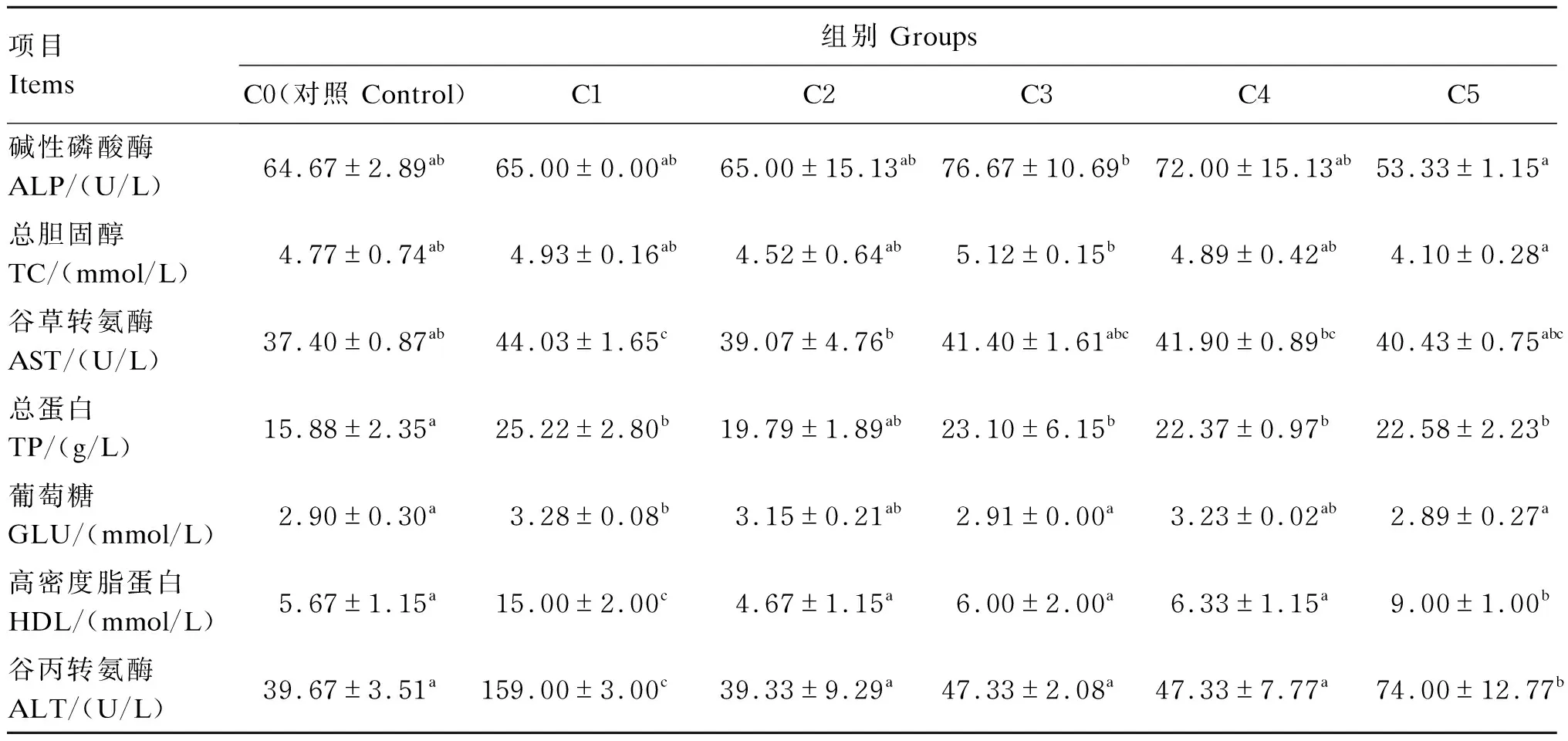
表3 饲料中添加丁酸梭菌对卵形鲳鲹幼鱼血清生化指标的影响
2.3 饲料中添加丁酸梭菌对卵形鲳鲹幼鱼肠道菌群的影响
2.3.1 肠道菌群操作分类单元(OTU)及alpha多样性分析
由图1可知,各组间样品Good’s coverage指数均接近1,表明测序深度能够覆盖样品中绝大部分物种。各组间观察到的物种数(observed_species)、Chao1指数、Faith_pd指数差异不显著(P>0.05)。C4组的Shannon指数、Simpson指数和Pielou_e指数最低,且C4组的Shannon指数和Pielou_e指数显著低于C0和C5组(P<0.05),C4组的Simpson指数显著低于C5组(P<0.05)。
由图2可知,在抽样深度为最低样本序列量95%的条件下,观测到的OTU数为2 372个,各组共有的OTU数为112个,占比4.72%。
2.3.2 肠道菌群门水平和属水平组成及相对丰度分析
在门水平上,排名前20的不同肠道菌群的相对丰度见图3。结果表明,卵形鲳鲹幼鱼肠道中软壁菌门(Tenericutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)为相对丰度较高的5个菌门。其中,软壁菌门和变形菌门分别占门水平物种总相对丰度的62.02%和33.60%,是各组卵形鲳鲹幼鱼肠道菌群中相对丰度最高的2个菌门。
由表4可见,C4和C5组的软壁菌门相对丰度低于C0组,但各组之间无显著差异(P>0.05)。C4组的变形菌门相对丰度高于C0和C5组,但各组之间无显著差异(P>0.05)。此外,C4和C5组的厚壁菌门/拟杆菌门显著低于C0组(P<0.05)。
在属水平上,排名前20的不同肠道菌群的相对丰度见图4。结果表明,支原体属(Mycoplasma)、发光细菌属(Photobacterium)、鲁杰氏菌属(Ruegeria)、分枝杆菌属(Mycobacterium)、Nautella、盐单胞菌属(Halomonas)是卵形鲳鲹幼鱼肠道菌群中相对丰度最高的6个菌属。其中,相对丰度最高的支原体属和发光细菌属分别占属水平物种总相对丰度的62.02%和24.01%。C0、C4、C5组的支原体属相对丰度分别为71.15%、57.39%、57.51%,这与门水平接近一致。发光细菌属相对丰度在C0组仅为1.75%,而在C4、C5组分别为36.63%、33.67%。
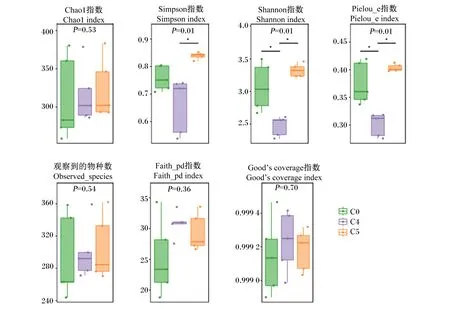
*表示差异显著(P<0.05)。* indicated significant difference (P<0.05).
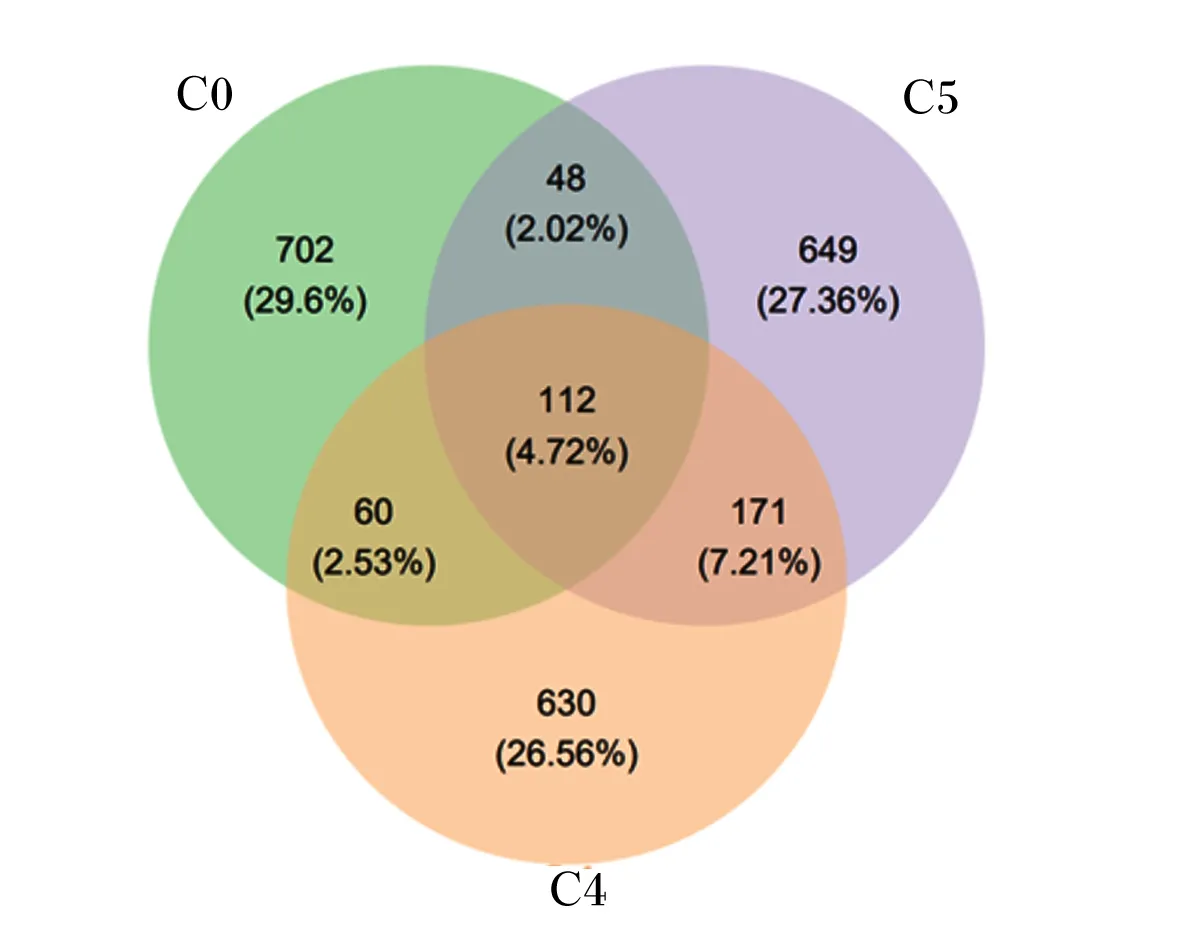
图2 卵形鲳鲹幼鱼肠道菌群OTU的Venu图
为了进一步了解各组卵形鲳鲹幼鱼肠道菌群的差异,通过LEfSe差异性检验和各组卵形鲳鲹幼鱼肠道中平均相对丰度前50位的菌群在门水平和属水平上的相对丰度组成图分析(图5),结果表明,C5组的放线菌门、厚壁菌门、拟杆菌门和蓝藻门(Cyanobacteria)相对丰度显著高于C0和C4组(P<0.05)。脱铁杆菌门(Deferribacteres)是C4和C5独有的菌门,且C4的脱铁杆菌门相对丰度显著高于C0和C5组(P<0.05)。C0组的鲁杰氏菌属(Ruegeria)、Nautella相对丰度显著高于C4和C5组(P<0.05)。C5组的分枝杆菌属、优杆菌属(Eubacterium)、乳杆菌属(Lactobacillus)、聚球藻属(Synechococcus)、考拉杆菌属(Phascolarctobacterium)、拟杆菌属(Bacteroides)、脱硫弧菌属(Desulfovibrio)、弧菌属(Vibrio)、巨单细胞属(Megamonas)、葡萄球菌属(Staphylococcus)、螺杆菌属(Helicobacter)、瘤胃球菌(Ruminococcus)相对丰度显著高于C0和C4组(P<0.05)。C4组的发光细菌属、芽孢杆菌属(Bacillus)、Mucispirillum相对丰度显著高于C0和C5组(P<0.05)。
2.4 饲料中添加丁酸梭菌对卵形鲳鲹幼鱼肠道短链脂肪酸含量的影响
本试验中,所有卵形鲳鲹幼鱼肠道内容物样品中,短链脂肪酸的含量在62.98~117.62 μg/g。如表5所示,C5组的短链脂肪酸总含量显著高于C4和C0组(P<0.05),C4组的短链脂肪酸总含量显著高于C0组(P<0.05)。
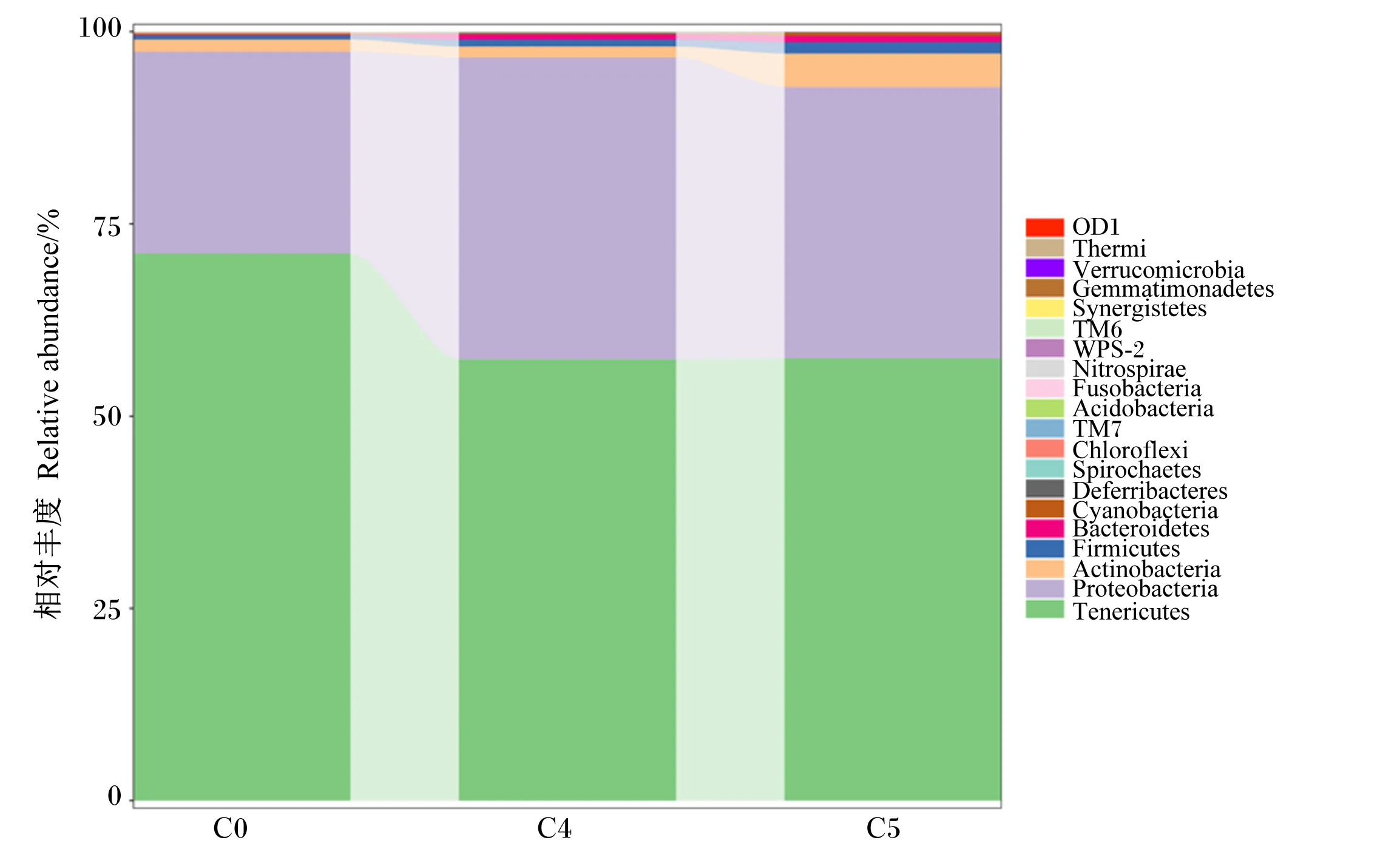
Verrucomicrobia:疣微菌门;Gemmatimonadetes:芽单孢菌门;Synergistetes:互养菌门;Nitrospirae:硝化螺旋菌门;Fusobacteria:梭杆菌门;Acidobacteria:酸杆菌门;Chloroflexi:绿弯菌门;Spirochaetes:螺旋体门;Deferribacteres:脱铁杆菌门;Cyanobacteria:蓝藻门;Bacteroidetes:拟杆菌门;Firmicutes:厚壁菌门;Actinobacteria:放线菌门;Proteobacteria:变形菌门;Tenericutes:软壁菌门。
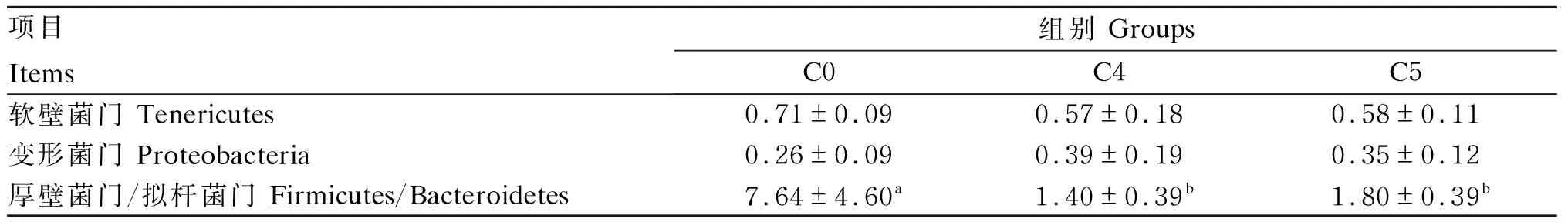
表4 卵形鲳鲹幼鱼肠道菌群的相对丰度
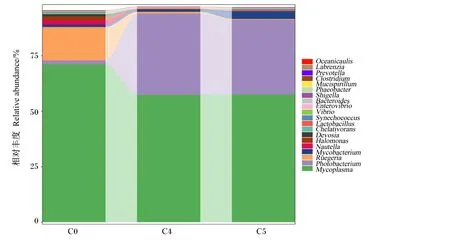
Oceanicaulis:海洋柄菌属;Labrenzia:拉布伦茨氏菌属;Prevotella:普氏菌属;Clostridium:梭菌属;Mucispirillum:黏液螺旋菌属;Shigella:志贺氏菌属;Bacteroides:拟杆菌属;Enterovibrio:肠弧菌属;Vibrio:弧菌属;Synechococcus:聚球藻属;Lactobacillus:乳杆菌属:Chelativorans:根瘤菌属;Devosia:德沃斯氏菌属;Halomonas:盐单胞菌属;Mycobacterium:分枝杆菌属;Ruegeria:鲁杰氏菌属;Photobacterium:发光杆菌属;Mycoplasma:支原体属。
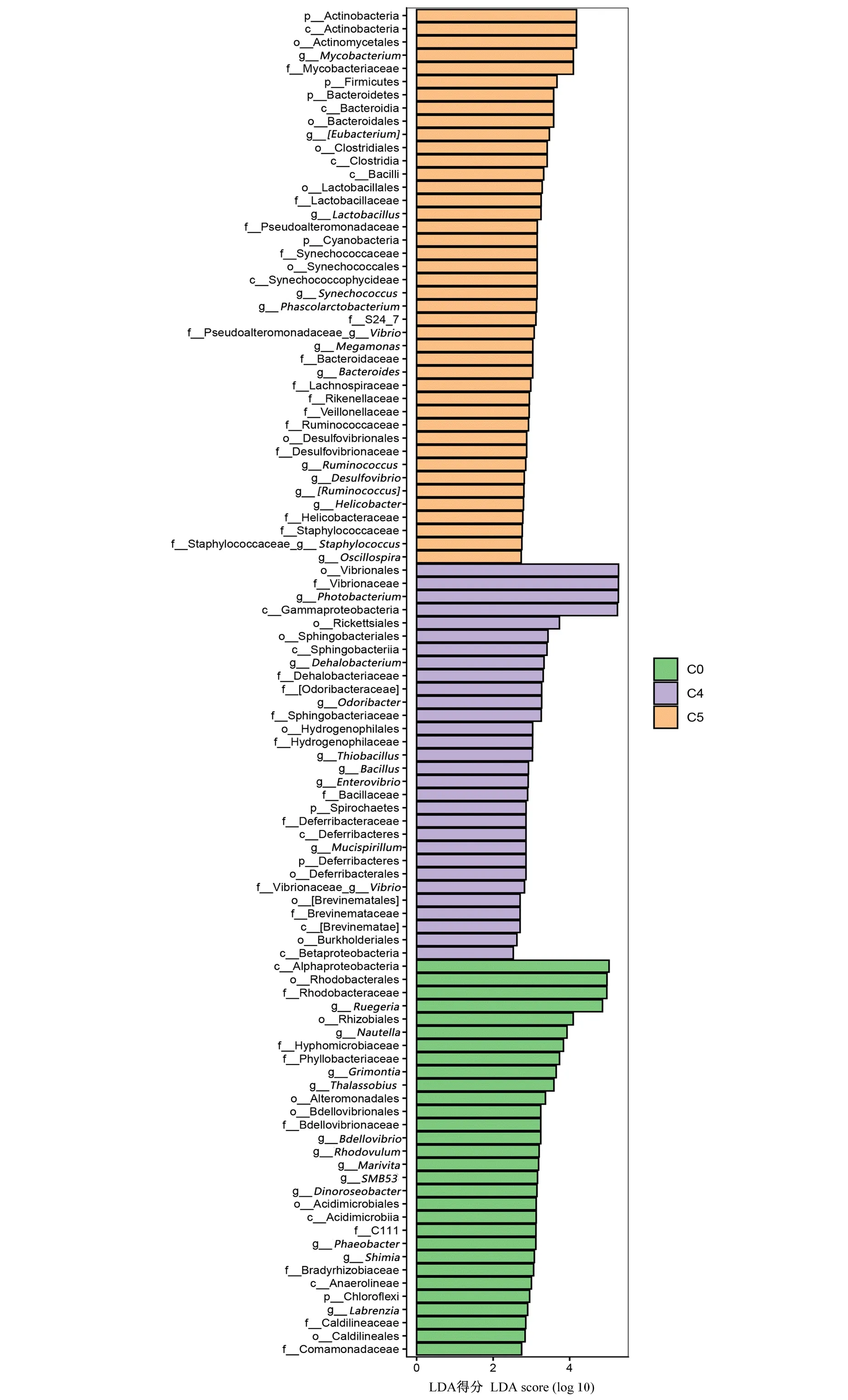
纵坐标为组间具有显著差异的分类单元,横坐标则以条形图直观地展示各分类单元的线性判别式分析对数得分值。分类单元按照得分值大小进行排序,以此描述它们在样本分组中的特异性。长度越长表明该分类单元的差异越显著,条形图的颜色指示了该分类单元所对应的相对丰度最高的样本分组。The ordinate is the classification unit with significant differences between groups, and the horizontal coordinate is a bar chart to visually display the linear discriminant analysis logarithm scores of each classification unit. The classification units are sorted by score value size to describe their specificity within the sample grouping. The longer the length indicates the more significant the difference in the classification unit, and the color of the bar plot indicates the sample group corresponding to the classification unit with the highest relative abundance.

表5 饲料中添加丁酸梭菌对卵形鲳鲹幼鱼肠道短链脂肪酸总含量的影响
如图6所示,C5组的肠道乙酸、丁酸、异丁酸、异戊酸、己酸含量均显著高于C0和C4组(P<0.05)。C4组的乙酸、异丁酸、异戊酸含量显著高于C0组(P<0.05)。
3 讨 论
3.1 饲料中添加丁酸梭菌对卵形鲳鲹幼鱼生长性能的影响
动物的生长性能是机体代谢的综合性指标,在畜禽动物和一些水产生物的研究表明,丁酸梭菌作为饲料添加剂能显著提高机体的生长性能和饲料利用率。黄灵等[16]研究发现,饲料中添加丁酸梭菌显著提高了虎龙斑的末重、增重率、特定生长率以及肥满度。Gao等[17]研究发现,丁酸梭菌对银鲳(Pampusargenteus)肠道消化酶、非特异免疫酶的活性有促进作用,进而提高了其生长性能。这与斑节对虾[10]、珍珠龙胆石斑鱼[18]上的研究类似。前期试验结果表明,饲粮中添加丁酸梭菌对卵形鲳鲹幼鱼的生长具有一定的促进用,这与本试验结果相似。本试验中,C4组卵形鲳鲹幼鱼的末均质量、增重率和特定生长率显著高于C0和C5组。丁酸梭菌促进动物生长的原因可能是:丁酸梭菌的主要代谢产物是丁酸、甲酸、乙酸等多种短链脂肪酸,其中丁酸可为肠道上皮细胞的生命活动提供能量,降低肠道黏膜的通透性,促进肠道吸收营养物质;丁酸梭菌能分泌多种消化酶以及多种维生素等营养物质,有利于宿主肠道健康。除此以外,丁酸梭菌还能抑制肠道病原菌的生长,促进有益菌如乳酸菌、双歧杆菌的生长。肥满度可以作为衡量鱼体营养状况的指标之一,肥满度越大表明机体储存营养物质越多。本试验中,C2组卵形鲳鲹幼鱼的肥满度显著高于C0和C5组。这表明摄入适量的丁酸梭菌有助于机体储存营养物质。
3.2 饲料中添加丁酸梭菌对卵形鲳鲹幼鱼血清生化指标的影响
血清生化指标可以作为鱼类营养水平、组织状态以及健康状况的重要参数[19]。血清总蛋白含量可以反映出机体的营养状况和对蛋白质的代谢水平。血清总蛋白含量的升高,往往代表着机体蛋白质代谢旺盛。在断奶仔猪[20]和肉鸡[21]的研究中表明,丁酸梭菌提高了机体血清白蛋白、球蛋白以及总蛋白的含量。葡萄糖含量的高低可以反映机体对糖类的利用和转化能力[22]。正常状态下,动物血液中葡萄糖含量往往处于动态平衡,本试验中,丁酸梭菌添加组的血清总蛋白和葡萄糖含量均高于C0组,C1、C4组的血清总蛋白含量显著高于C0组,C1、C3、C4、C5组的血清葡萄糖含量均显著高于C0组,这与丁酸梭菌在虎龙斑[16]、松浦镜鲤[23]的研究结果一致。推测可能是丁酸梭菌提高了血清总蛋白和葡萄糖含量,刺激了卵形鲳鲹的蛋白质和葡萄糖能量周转代谢,有助于卵形鲳鲹吸收营养物质。
总胆固醇含量可以作为评估机体脂质代谢的指标之一,高密度脂蛋白的功能是运输血液中的胆固醇,二者的含量具有相关性[24]。然而,血液中胆固醇含量提高可能意味着机体脂质代谢紊乱。本试验中,C3组的血清总胆固醇含量显著高于C5组,C1和C5组的血清高密度脂蛋白含量显著高于其余各组,说明适量的丁酸梭菌提高了卵形鲳鲹血清总胆固醇和高密度脂蛋白的含量。谷丙转氨酶、谷草转氨酶主要在鱼类的肝脏中分布,肝脏细胞受损时会释放到血液中,其活性与肝脏受损伤的程度呈正相关趋势[25]。此外,当鱼类受到外界环境刺激而应激时,机体血清谷草转氨酶、谷丙转氨酶活性也会相对增高[26]。本试验中,C1组的血清谷草转氨酶和谷丙转氨酶活性均显著高于C0组,推测可能是鱼体受到应激或者C1组卵形鲳鲹幼鱼的肝脏出现了损伤,具体的原因仍需要进一步研究。
3.3 饲料中添加丁酸梭菌对卵形鲳鲹幼鱼肠道菌群的影响
微生物可以通过黏附作用在肠道内定植,并在肠道表面附着。肠道菌群的平衡有益于宿主的健康,此外,肠道菌群对宿主的营养吸收和肠道免疫反应也有重要影响。使用益生菌是维持动物肠道菌群平衡的有效手段[27]。研究表明,丁酸梭菌能促进肠道双歧杆菌、乳酸杆菌等肠道有益菌群增殖,并且能够抑制致病菌(大肠杆菌等)的生长,调节肠道微生物的平衡,优化宿主肠道内微生态环境的功能。何菊等[28]研究发现,在饲粮中添加丁酸梭菌制剂,极显著增加了肉鸡的回肠和盲肠中乳酸杆菌、双歧杆菌的数量,并且显著降低了沙氏门菌的数量。在水产动物中,Li等[29]研究发现,丁酸梭菌增加了罗非鱼肠道中拟杆菌门、厚壁菌门、绿柔菌门(Chloroflexi)、氯菌门(Chlorobi)、酸杆菌门(Acidobacteria)、螺旋体门(Spirochaetae)、硝化螺旋体门(Nitrospirae)、微囊菌门(Parcubacteria)和浮霉菌门(Planctomycetes)相对丰度。本试验中,卵形鲳鲹幼鱼肠道菌群相对丰度最高的2个菌门主要为软壁菌门和变形菌门,占物种门水平总相对丰度的95.62%,且呈现出拮抗的趋势,这与本试验前期研究结果相似。丁酸梭菌显著提高了卵形鲳鲹幼鱼肠道菌群中放线菌门、厚壁菌门、拟杆菌门、蓝藻门和脱铁杆菌门相对丰度。放线菌门被认为是动物肠道中的优势菌群,类群丰富,其代谢产生的抗生素、免疫抑制剂、维生素和各种酶等生物活性物质,参与宿主一系列重要的生理活动,如生长代谢、维持肠道微生态平衡等[30]。厚壁菌门是正常中华绒螯蟹相对丰度最高的优势菌门,其相对丰度显著高于低品质中华绒螯蟹[31]。此外,也有研究表明,厚壁菌门是参与短链脂肪酸合成的重要菌门[32]。在小鼠的一项研究表明,脱铁杆菌门的微生物改变和富集对沙氏门菌诱导的肠道炎症具有抵御作用[33]。厚壁菌门与拟杆菌门的比值被认为是肠道炎症和肥胖的标准[34]。本试验中,C4和C5组的厚壁菌门与拟杆菌门的比值显著低于C0组,这表明丁酸梭菌有效改善了卵形鲳鲹幼鱼的肠道健康。
在属水平上,支原体属和发光细菌属为卵形鲳鲹幼鱼肠道的主要优势菌属。支原菌可引起人和陆生动物疾病,在鱼类中也有支原菌引发疾病的报道[35]。丁酸梭菌的摄入降低了卵形鲳鲹幼鱼肠道菌群支原体门的相对丰度,但各组间没有显著差异。研究表明,丁酸梭菌能提高动物的有益菌属相对丰度,有益于宿主的肠道健康。李娜等[36]研究发现,番鸭灌服丁酸梭菌后,增加了肠道中有益菌的定殖和发育,如丁酸球菌属、瘤胃球菌属、毛螺菌属、乳球菌属和布劳特式菌属等,减少了致病菌的数量,如埃希氏杆菌-志贺氏菌属。在水产动物中也有类似的效果,朱振祥[26]研究发现,鲤鱼肠道的拟杆菌属与饲料中丁酸梭菌添加量表现出正相关趋势。本研究中,适量的丁酸梭菌提高了卵形鲳鲹幼鱼肠道内的发光细菌属、芽孢杆菌属、Mucispirillum的相对丰度。芽孢杆菌属被认为是水产动物肠道内的有益菌属[37],芽孢杆菌属的多种芽孢杆菌是水产养殖常见的益生菌,如枯草芽孢杆菌、短小芽孢杆菌、凝结芽孢杆菌等。Mucispirillum隶属于脱铁杆菌门,是本试验中丁酸梭菌添加组中卵形鲳鲹幼鱼肠道特有的菌属。有研究表明,Mucispirillum的Mucispirillumschaedleri在小鼠肠道内通过与沙氏门菌竞争厌氧呼吸底物,沙门氏菌毒力因子的表达受到抑制,从而帮助宿主抵抗结肠炎[38]。然而,过量的丁酸梭菌在提高卵形鲳鲹幼鱼肠道内的有益菌属乳杆菌属和拟杆菌属相对丰度的同时也提高了条件致病菌如分支杆菌属、弧菌属、螺杆菌菌、脱硫弧菌属、葡萄球菌属的相对丰度,这可能是过量的丁酸梭菌破坏了卵形鲳鲹幼鱼的肠道微生物平衡,不利于宿主的健康。然而,丁酸梭菌显著降低了卵形鲳鲹幼鱼肠道中蛭弧菌属、Ruegeria、Nautella的相对丰度。蛭弧菌属是一种有益菌,在健康凡纳滨对虾肠道中的相对丰度显著高于患病组,其能裂解弧菌,有益于宿主的健康。在农业、医学及污水治理等领域现已应用,其对农作物及人畜疾病都有一定的防治效果[39]。有研究发现,Ruegeria是海洋环境中最为常见的菌属之一[40],Ruegeria的coral-associatedRuegeria可能是一种潜在的益生菌[41]。
3.4 饲料中添加丁酸梭菌对卵形鲳鲹幼鱼肠道短链脂肪酸含量的影响

4 结 论
饲料中添加2.00%的丁酸梭菌提高了卵形鲳鲹幼鱼的末均质量、增重率以及特定生长率,提高了血清总蛋白和葡萄糖含量,改变了门水平上和属水平上的肠道菌群组成,提高了肠道短链脂肪酸含量。
——奇妙的蛋

