N-乙酰半胱氨酸联合头孢西丁对金黄色葡萄球菌的体外药敏试验研究
吴桐,谷海瀛,2
N-乙酰半胱氨酸联合头孢西丁对金黄色葡萄球菌的体外药敏试验研究
吴桐1,谷海瀛1,2
1.宁波大学医学部,浙江宁波 315211;2.宁波大学医学院附属医院消化病实验室,浙江宁波 315020
使用头孢西丁(cefoxitin,FOX)分别与未处理的N-乙酰半胱氨酸(N-acetylcysteine,NAC)和酸碱度调节至中性的NAC对金黄色葡萄球菌(,)ATCC29213、ATCC43300进行体外联合药敏试验,检测FOX与NAC联合应用对的作用,评估NAC的酸性特性在发挥药物效果中的影响。微量肉汤稀释法测定药物最小抑菌浓度(minimal inhibitory concentration,MIC);棋盘法进行联合药物敏感性试验,结晶紫染色法测定生物被膜(biofilm,BF)形成量,激光共聚焦显微镜观察菌落成分变化。调节NAC至中性再次进行上述试验。FOX对ATCC29213和ATCC43300的MIC分别为2μg/ml和32μg/ml,NAC对2菌株的MIC均为4mg/ml。酸度调节至中性的NAC对ATCC29213和ATCC43300的MIC均>64mg/ml。保持弱酸性的NAC与FOX间存在相加作用,BF含量、细菌数量、BF多糖成分均有所下降;中性的NAC与FOX联合应用时药物间作用效果为无关甚至拮抗,未出现上述作用效果。NAC的存在一定程度上可增加体外条件下对FOX的敏感性,降低细菌数量和BF的形成量,且不因菌株耐药性的不同而存在明显差异,但这种作用依赖于NAC自身的酸性。
金黄色葡萄球菌;生物被膜;N-乙酰半胱氨酸;抗生物被膜
金黄色葡萄球菌(,)是常见的革兰阳性病原菌之一,能够持续定植于大约30%的健康成年人的鼻咽部,并在多达60%的人群中间歇定植,是医院和社区获得性感染的主要病原菌之一[1]。据2021年CHINET中国细菌耐药监测显示,在临床革兰阳性细菌分离株中高居首位,约31.2%,而其中耐甲氧西林的的检出率高达30.0%[2]。尽管抗菌药物不断开发迭代,但目前对治疗的选择仍十分有限,在具有多药耐药性感染相关的最重要的ESKAPE组(屎肠球菌、金黄色葡萄球菌、肺炎克雷伯菌、鲍曼不动杆菌、铜绿假单胞菌、肠杆菌属)中,也因较高的毒性和强大的可塑性及适应性占据特殊地位,生物被膜(biofilm,BF)形成是维持感染和产生药物耐受的一种重要方式[3-5]。
N-乙酰半胱氨酸(N-acetylcysteine,NAC)(C₅H₉NO₃S)是一种具有弱酸性的硫醇化合物,是谷胱甘肽合成的前体及活性氧清除剂,现常作为祛痰药用于呼吸系统疾病的辅助治疗[6]。NAC的广泛应用不仅因其具有良好的抗氧化性和自由基清除活性,还因其作为硫醇分子,性质非常稳定,人体对浓度高达1200mg/ml的NAC仍具有良好的耐受性[7]。
现有研究表明NAC对多种细菌具有抑制作用,能够抑制细菌BF形成,并可与多种抗生素产生协同效应[8-10]。此外,有研究者认为NAC可提高ATCC29213的β-内酰胺类抗生素敏感性,甚至10mmol/LNAC可将耐甲氧西林金黄色葡萄球菌(methicillin-resistant,MRSA)转变为甲氧西林敏感金黄色葡萄球菌(methicillin- susceptible,MSSA),但相关试验依据缺乏[11]。FOX属半合成β-内酰胺类抗生素,可作用于青霉素结合蛋白(penicillin binding proteins,PBPs)而抑制细菌细胞壁中肽聚糖的合成来发挥其抗菌作用[12]。在美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)中,FOX被认为是检测葡萄球菌mecA基因介导的甲氧西林耐药性的可靠药物,并规定当的FOX最小抑菌浓度(minimal inhibitory concentration,MIC)>4μg/ml时可将其判定为MRSA。故本研究选取FOX与NAC对ATCC29213和ATCC43300进行体外药敏试验,探究药物对的作用,并评估NAC的弱酸性质对药物作用效果的影响,以期为相关感染的临床治疗药物选择提供一定的参考信息。
1 材料与方法
1.1 菌株
1.1.1 试验菌株ATCC29213和ATCC43300均为购于北京北纳生物科技有限公司的二代菌株。试验前使用MALDI TOF MS对菌株进行鉴定。
1.1.2 试验菌液 新鲜无菌MHB液体培养基制备0.5麦氏浓度的菌液,稀释1000倍后用于试验。
1.2 主要试剂和仪器
NAC和FOX购自上海梯希爱化成工业发展有限公司;MHB培养粉购自英国OXOID公司;结晶紫购自美国Sigma公司;碘化丙啶和50%戊二醛购自上海麦克林生化科技有限公司;FITC-conA购自上海懋康生物科技有限公司。FOX药敏冻干板、NAC药敏冻干板、FOX与NAC联合药敏冻干板购自宁波迅检生物科技有限公司。
生物安全柜购自苏州金净净化设备科技有限公司;比浊仪和VITEK MS质谱仪购自生物梅里埃公司;全波长酶标仪和–80℃超低温冰箱购自赛默飞世尔科技有限公司;培养箱购自上海跃进医疗器械有限公司;LEICA TCS SP8激光共聚焦显微镜购自德国徕卡公司。
NAC使用NaOH溶液调节至pH 6.8~7.0。NAC药敏冻干板浓度范围为0.0625~64.0000mg/ml,FOX药敏冻干板浓度范围为0.125~128.000μg/ml,每列第12孔均为药物空白孔。FOX与NAC联合药敏冻干板,横排为FOX,1~11孔浓度梯度为1/128~8MIC;每列B~H孔添加NAC,浓度为1/16~4MIC;每块药敏冻干板的H1、A12孔为药物空白孔[13]。
1.3 MIC测定
向药敏冻干板中每孔加入110μl试验菌液,置于35°C环境中22h,观察各培养孔中细菌的生长情况,确定药物对ATCC29213和ATCC43300的MIC。
1.4 联合药敏试验与部分抑菌浓度指数
向联合药敏冻干板中每孔加入110μl试验菌液,置于35°C环境中22h,观察各培养孔中细菌的生长情况,根据部分抑菌浓度指数(fractional inhibitory concentration index,FICI)药A联合药A单药药B联合/药B单药对药物之间的作用效果进行判断[14]。
1.5 结晶紫法测定BF形成量
药敏板的选择、菌液接种与培养同1.4。取出联合药敏板,弃去孔内液体,使用无菌生理盐水清洗2次;99%甲醇固定15min;0.2%结晶紫染液染色10min;无菌蒸馏水洗涤至无染液流出;每孔加入110μl 95%乙醇,混匀后测量各孔600nm处的吸光度[15]。
1.6 激光共聚焦显微镜观察药物作用后BF变化情况
药敏板的选择、菌液接种与培养同1.4。根据联合药敏试验及FICI选择合适的培养孔。取洁净玻片编号,每载玻片上滴加170μl无菌蒸馏水,吸取10μl的培养物至玻片上的蒸馏水中,室温晾干。80μl 2.5%戊二醛溶液,置于4℃环境中1.5h固定;PBS冲洗; 20.0μg/ml的FITC-conA荧光染液80μl,避光放置于4℃环境中30min;PBS冲洗;10.0μg/ml的碘化丙啶(propidium iodide,PI)染液100μl,置于37℃环境中、20min避光孵育;PBS冲洗,晾干,封片。LEICA TCS SP8激光共聚焦显微镜,分别在488nm和552nm发射波长的滤光器下观察。
1.7 统计学方法
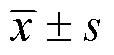
2 结果与分析
2.1 两株S. aureus的药物MIC
药物对ATCC29213和ATCC43300的MIC见表1。对培养物吸光度的测定结果显示,当NAC的浓度超过0.125mg/ml时,细菌的数量开始出现显著下降。而使用NaOH溶液将NAC的pH值调节至6.8~7.0时,NAC对ATCC29213和ATCC43300的MIC均显示>64mg/ml,培养物吸光度仅在中性NAC达8mg/ml或更高时,才出现较明显的下降,见图1。
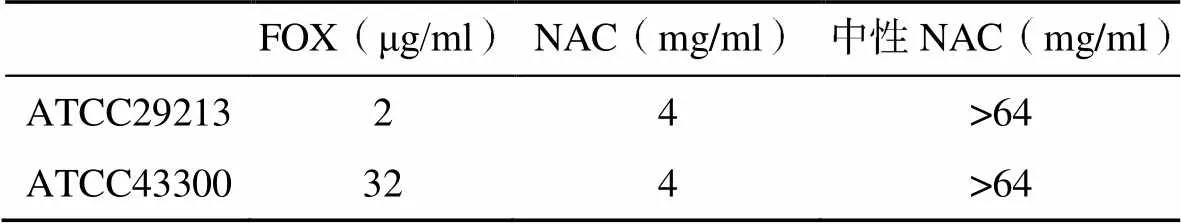
表1 药物对S. aureus ATCC29213和ATCC43300的MIC
2.2 联合药敏试验与FICI
根据药物MIC值确定联合药敏试验中药物的浓度范围,NAC为0.25~16.00mg/ml,ATCC29213的FOX浓度为0.015~16.000μg/ml,ATCC43300的FOX浓度为0.25~256.00μg/ml。
在未对酸碱度进行调节的情况下,FOX和NAC联用对ATCC29213和ATCC43300表现出相似的抗菌效果。在MSSA菌株ATCC29213的96孔药敏培养板中,B4、C4、D4、D5、E4、E5、E6、E7孔中均未见细菌生长,通过计算FICI,仅D5、E5、E6、E7四孔内药物之间表现为相加作用,其余培养孔的药物之间的相互作用均表现为无关;其中,E7孔作用效果最佳,其FICI值为0.625;D5、E6两孔的FICI值相同,为0.75;E5孔FICI值最大,为1.0。
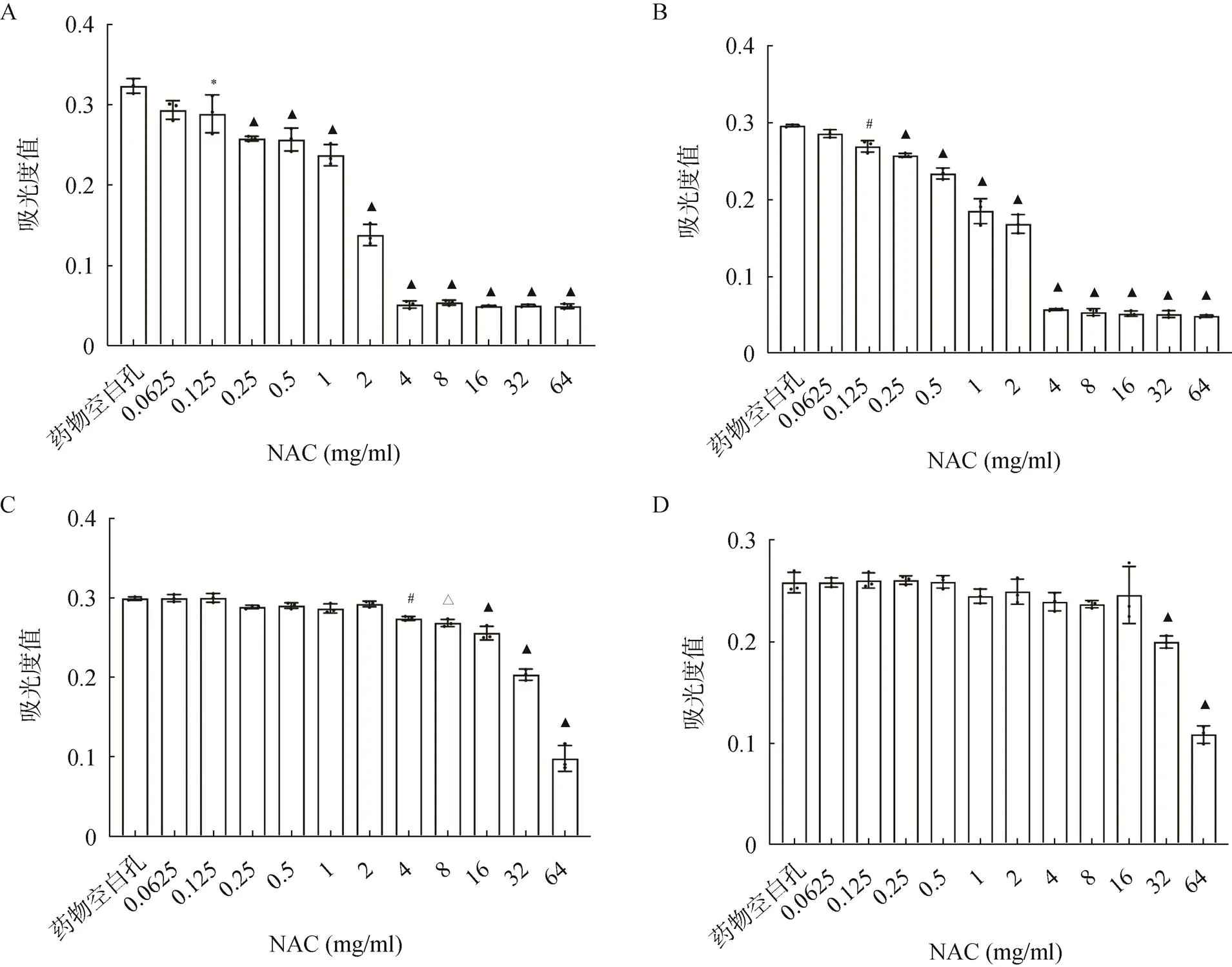
图1 NAC酸碱度改变时两株S. aureus菌液吸光度的变化(OD600)
A.ATCC29213;B.ATCC43300;C.中性条件下ATCC29213;D.中性条件下ATCC43300
注:OD600为600nm处的吸光度值;与药物空白孔比较,*<0.05;#<0.01;△<0.001;▲<0.0001
对耐药菌株ATCC43300,在联合药敏板FOX单药孔中测得的MIC值为8μg/ml,故FICI计算中使用8μg/ml。在未调节酸碱度的情况下,B6、C6、D6、D7、E6、E7、E8、E9孔内未见细菌生长,D7、E7、E8、E9孔显示出两种药物之间具有相加作用,其FICI分别为0.750、1.000、0.750、0.625,其余培养孔则均表现为无关作用,见图2。
2.3 药物作用后S. aureus BF总生物量测定
使用结晶紫染色对BF总生物量进行测定。未调节pH时,亚抑菌浓度FOX作用下ATCC29213和ATCC43300的BF含量均随着NAC浓度的升高而降低,与同浓度FOX单独作用相比,联合用药时BF分别减少37.3%~56.5%和28.1%~41.4%不等;与药物空白孔相比,此时ATCC29213和ATCC43300 BF的最大减少量分别为49.7%和43.4%。同样的联合药物浓度在中性条件下BF量则表现出与细菌数量相似的增加,甚至可高达70%,见表2。
2.4 激光共聚焦显微镜观察结果
两株激光共聚焦显微镜下所见BF荧光标记特点相似,无药物作用的培养物中标记菌体的PI所发出的红色荧光及标记多糖类物质的FITC-conA发出的绿色荧光亮度高、范围大、聚集性强;亚抑菌浓度的FOX单独作用时,红和绿两种荧光的强度略有下降,并变得更为分散,这种变化特点随着药物浓度的升高会变得更明显。而在具有药物相加作用的各孔中,标记BF的绿色荧光更分散,荧光强度更弱,红色荧光标记的菌体数量大幅减少,荧光强度微弱;与之对应的中性NAC联合作用孔镜下表现介于低浓度FOX单独作用或无药物作用时,红和绿两种荧光的亮度强、范围大,且呈现出聚集趋势,见图3。
3 讨论
本试验选取药物敏感性不同的ATCC29213和ATCC43300进行FOX和NAC的药物联合试验,并调节NAC至中性进行试验,以观察两种药物单独及联合应用对菌株的影响,同时评估NAC弱酸特性在其中的作用。研究结果表明保持弱酸性质的NAC单独作用时已具备良好的抗菌、抗BF形成能力,当与FOX联合应用时,可一定程度上增加ATCC29213和ATCC43300对FOX的敏感性,减少BF的形成量和其中的细菌数量、多糖成分含量。这可能与NAC竞争性抑制细菌对半胱氨酸的摄取、通过硫醇–二硫键交换还原蛋白质并降低其交联程度、在细菌细胞质中解离并酸化胞质造成菌体蛋白变性和遗传物质的损伤相关[16-18]。但也有研究表明,NAC的抑菌效果与其pH之间没有明显关联,1mmol/ml的NAC几乎可完全裂解细菌培养物中的双链DNA(double-stranded DNA,dsDNA),即使其变为中性,这种裂解也保持在50%左右,而细胞外DNA(extracellular DNA,eDNA)对BF的发育和结构的完整性来说至关重要,NAC破坏BF的关键或许在于eDNA的降解,但需进一步探索[19-21]。
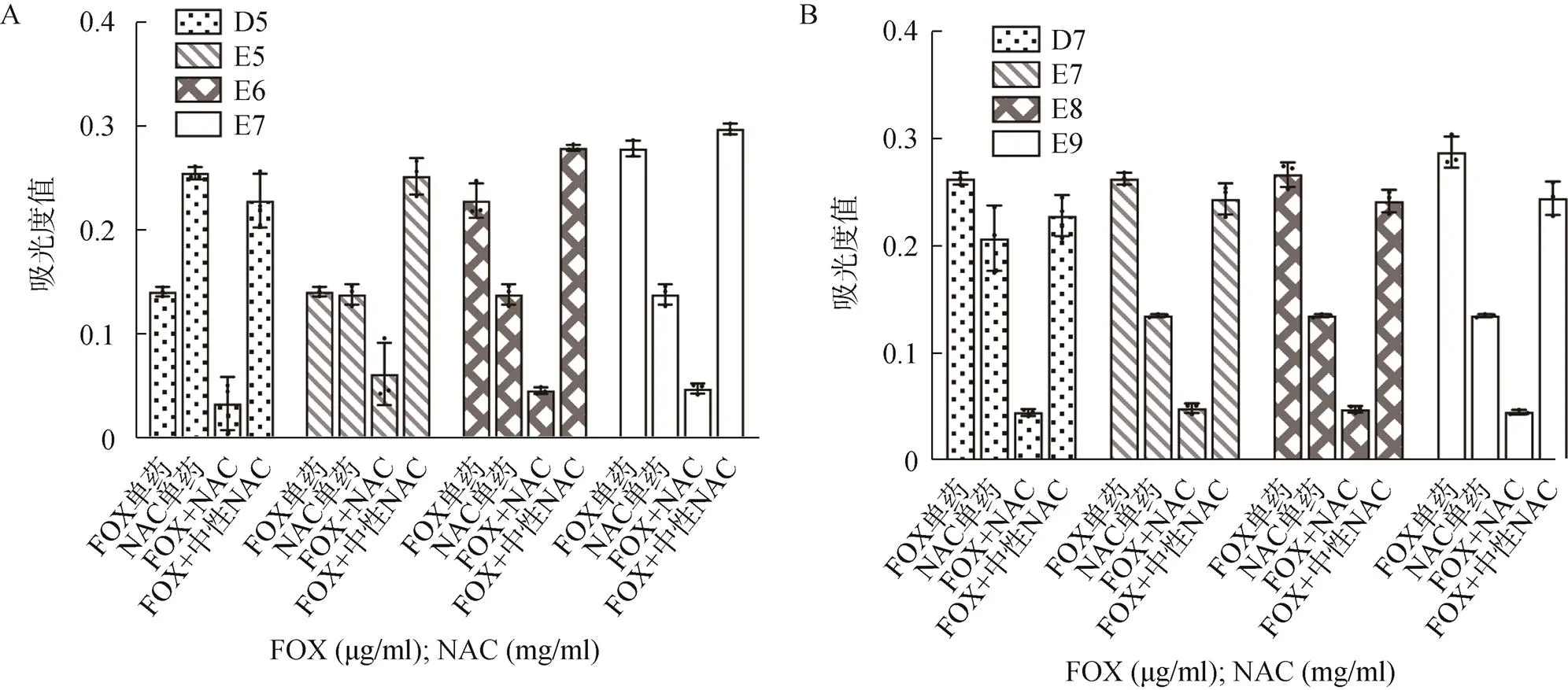
图2 具有药物相加作用的培养孔与同浓度FOX单独作用、同浓度FOX与中性NAC联用时S. aureus ATCC29213培养物OD600比较
A.ATCC29213;B.ATCC43300
注:<0.001
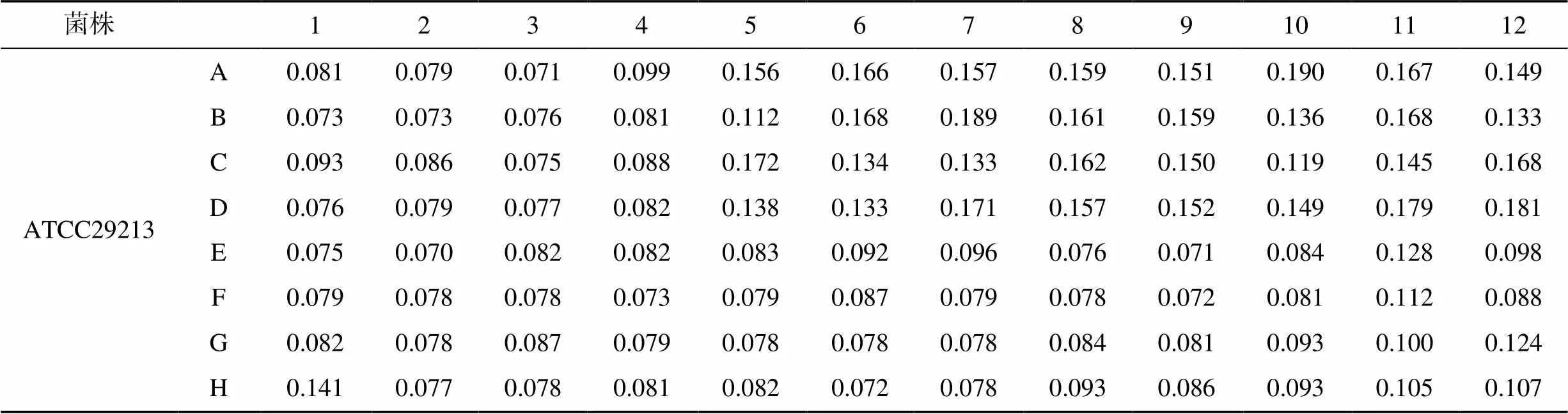
表2 NAC与FOX联合药敏板中S. aureus ATCC29213 BF结晶紫染色的吸光度(未调节pH,OD600)
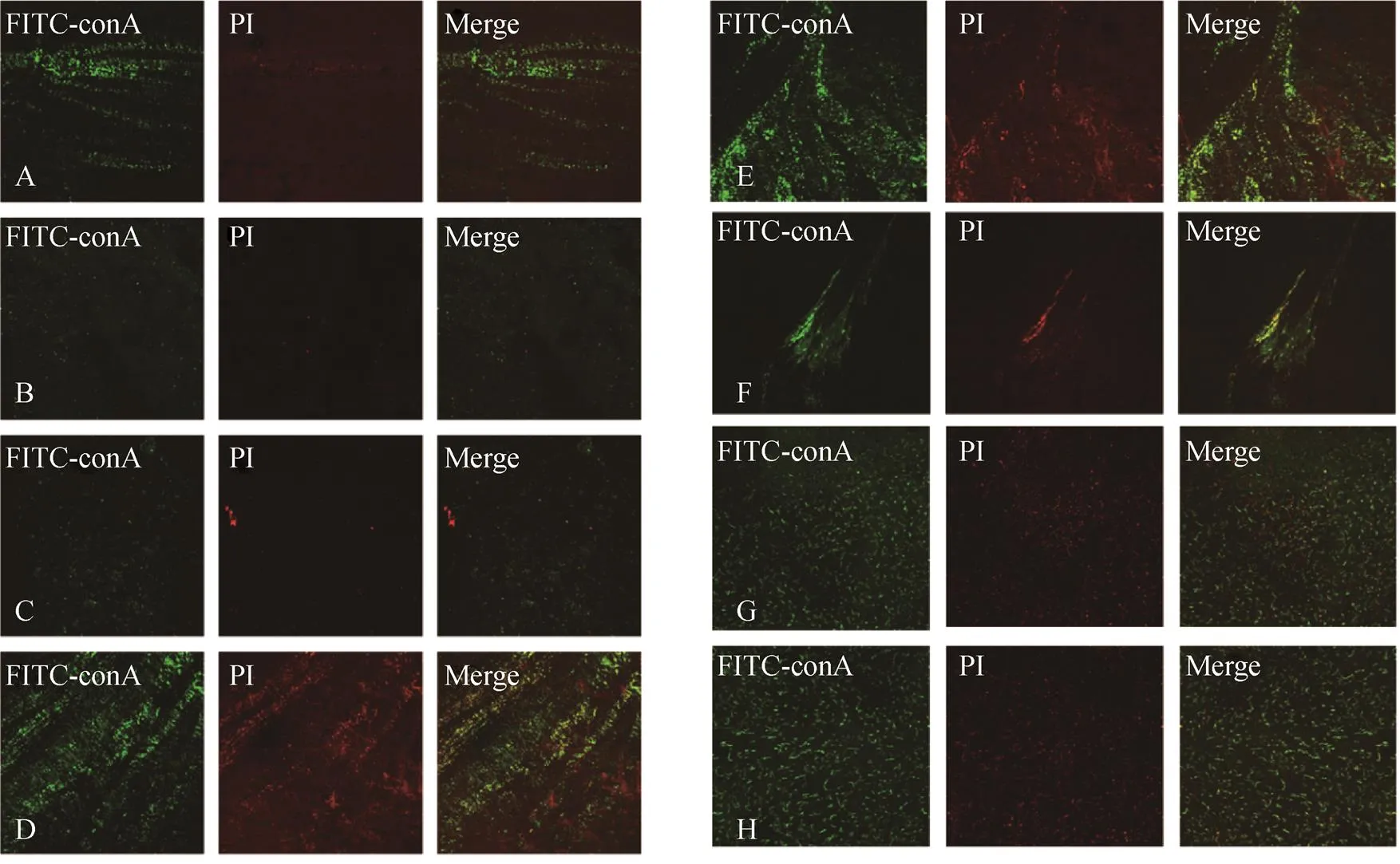
图3 药物作用22h后S. aureus ATCC29213激光共聚焦下的荧光图像(×40)
A.E6孔;B.D5孔;C.E7孔;D.H1孔;E.E6孔(pH6.8~7.0);F.D5孔(pH6.8~7.0);G.E7孔(pH 6.8~7.0);H.A12孔
是临床常见病原菌,其BF形成能力是产生药物耐受的重要原因之一,与之相关的感染在治疗和诊断上仍存在着较大的困难。本试验仅选取ATCC29213和ATCC43300进行体外药物敏感试验,但除了单物种BF外,包含不同种、属的混合BF在人类宿主中也十分常见。这种混合BF内积累的生存阻力相对更大,其中的细菌更易通过抗性基因的水平转移等方式增强自身抵抗力,导致实际治疗中包括常规一线药物在内的多数抗生素难以根除这些与BF关联的感染,给人类健康和疾病治疗带来艰巨挑战[22]。因此,进一步开展对临床分离株及混合病原菌的联合药物敏感试验十分必要。
寻找针对细菌BF的新型治疗方法是当前的紧迫问题,其在临床实践中扮演着十分重要的角色,但新药的开发费用较高且过程缓慢,药物再利用就成为另一种合理有效的解决办法。本试验结果有助于支持使用NAC作为具有抗细菌BF应用潜力的候选药物用于预防和治疗BF的形成。
[1] KWIECINSKI J M, HORSWILL A R.bloodstream infections: Pathogenesis and regulatory mechanisms[J]. Curr Opin Microbiol, 2020, 53: 51–60.
[2] 胡付品, 郭燕, 朱德妹, 等. 2021年CHINET中国细菌耐药监测[J]. 中国感染与化疗杂志, 2022, 22(5): 521–530.
[3] LEE A S, DE LENCASTRE H, GARAU J, et al. Methicillin-resistant[J]. Nat Rev Dis Primers, 2018, 4: 18033.
[4] MLYNARCZYK-BONIKOWSKA B, KOWALEWSKI C, KROLAK-ULINSKA A, et al. Molecular mechanisms of drug resistance in[J]. Int J Mol Sci, 2022, 23(15): 1–33.
[5] MOORMEIER D E, BAYLES K W.biofilm: A complex developmental organism[J]. Mol Microbiol, 2017, 104(3): 365–376.
[6] 杨中澜, 王敏, 周莉莉, 等. 乙酰半胱氨酸的药理作用与临床应用[J]. 中国临床药理学杂志, 2021, 37(14): 1932–1936.
[7] CALVERLEY P, ROGLIANI P, PAPI A. Safety of N-acetylcysteine at high doses in chronic respiratory diseases: A review[J]. Drug Saf, 2021, 44(3): 273–290.
[8] PÉREZ-GIRALDO C, RODRÍGUEZ-BENITO A, MORÁN F J, et al. Influence of N-acetylcysteine on the formation of biofilm byepidermidis[J]. J Antimicrob Chemother, 1997, 39(5): 643–646.
[9] POLLINI S, BONCOMPAGNI S, DI MAGGIO T, et al. In vitro synergism of colistin in combination with N-acetylcysteine againstgrown in planktonic phase and in biofilms[J]. J Antimicrob Chemother, 2018, 73(9): 2388–2395.
[10] MANOHARAN A, OGNENOVSKA S, PAINO D, et al. N-acetylcysteine protects bladder epithelial cells from bacterial invasion and displays antibiofilm activity against urinary tract bacterial pathogens[J]. Antibiotics (Basel), 2021, 10(8): 1–17.
[11] YANG F, ZHANG S, SHANG X, et al. Short communication: N-acetylcysteine-mediated augmentation of β-lactam antibacterial activity against methicillin- resistantisolated from bovine mastitis cases[J]. J Dairy Sci, 2019, 102(8): 6920–6922.
[12] SAENHOM N, KANSAN R, CHOPJITT P, et al. Evaluation of in-house cefoxitin screening broth to determine methicillin-resistant[J]. Heliyon, 2022, 8(2): e08950.
[13] LEBER A. Synergism testing: Broth microdilution checkerboard and broth macrodilution methods[M]. Washington, DC: ASM Press, 2016: 11–23.
[14] 丁丽, 陈佰义, 李敏, 等. 碳青霉烯类耐药革兰阴性菌联合药敏试验及报告专家共识[J]. 中国感染与化疗杂志, 2023, 23(1): 80–90.
[15] KAMBLE E, SANGHVI P, PARDESI K. Synergistic effect of antibiotic combinations onbiofilms and their persister cell populations[J]. Biofilm, 2022, 4: 100068.
[16] DINICOLA S, DE GRAZIA S, CARLOMAGNO G, et al. N-acetylcysteine as powerful molecule to destroy bacterial biofilms. A systematic review[J]. Eur Rev Med Pharmacol Sci, 2014, 18(19): 2942–2948.
[17] NAGY P. Kinetics and mechanisms of thiol-disulfide exchange covering direct substitution and thiol oxidation-mediated pathways[J]. Antioxid Redox Signal, 2013, 18(13): 1623–1641.
[18] KUNDUKAD B, SCHUSSMAN M, YANG K, et al. Mechanistic action of weak acid drugs on biofilms[J]. Sci Rep, 2017, 7(1): 4783.
[19] AMARAL E P, CONCEIÇÃO E L, COSTA D L, et al. N-acetylcysteine exhibits potent anti-mycobacterial activity in addition to its known anti-oxidative functions[J]. BMC Microbiol, 2016, 16(1): 251.
[20] PANLILIO H, RICE C V. The role of extracellular DNA in the formation, architecture, stability, and treatment of bacterial biofilms[J]. Biotechnol Bioeng, 2021, 118(6): 2129–2141.
[21] MANOHARAN A, DAS T, WHITELEY G S, et al. The effect of N-acetylcysteine in a combined antibiofilm treatment against antibiotic-resistant[J]. J Antimicrob Chemother, 2020, 75(7): 1787–1798.
[22] TUCK B, WATKIN E, SOMERS A, et al. A critical review of marine biofilms on metallic materials[J]. NPJ Materials Degradation, 2022, 6(25): 1–12.
Effect of N-acetylcysteine combined with cefoxitin onin vitro drug susceptibility tests
WU Tong, GU Haiying
1.Health Science Center, Ningbo University, Ningbo 315211, Zhejiang, China; 2.Laboratory of Gastroenterology, the Affiliated Hospital of Medical School of Ningbo University, Ningbo 315020, Zhejiang, China
To conduct a combination susceptibility test of cefoxitin (FOX) with N-acetylcysteine (NAC) or NAC adjusted to neutral pH on() ATCC29213 and ATCC43300, aiming to evaluate the drugs effect and the acidic properties of NAC on.Minimal inhibitory concentration (MIC) of FOX and NAC were tested by broth microdilution method; Combining drug susceptibility experiment was tested by the checkerboard method. The biofilm biomass quantification was determined by crystal violet staining. Biofilm (BF) composition changes were visualized using confocal laser scanning microscopy. The experiment was performed again by using neutral NAC.MIC of FOX againstATCC29213 and ATCC43300 were 2μg/ml and 32μg/ml. MIC of NAC was 4mg/ml for both strains, while the MIC of neutral NAC was greater than 64mg/ml. Both strains show an additive effect between NAC and FOX when the pH was low, where the content of BF, the number of bacteria, and the polysaccharide component of BF decreased. However, the drug’s effects were shown as irrelevant or antagonistic when the pH was adjusted to neutral.NAC is able to increase the sensitivity ofto FOX and significantly destroys BF formation, and the acidity of NAC might be the key to its effects.
; Biofilm; N-acetylcysteine; Antibiofilm
R37
A
10.3969/j.issn.1673-9701.2023.27.022
谷海瀛,电子信箱:guhaiying@nbu.edu.cn
(2023–04–27)
(2023–08–22)

