地市级监测机构医疗器械不良事件风险管理工作实践与探索
史玉清 临沂市药物警戒中心 (山东 临沂 276000)
内容提要: 通过梳理总结临沂市药物警戒中心开展医疗器械不良事件风险管理的工作措施,分析当前地市级医疗器械不良事件监测工作的形势要求,探索基于风险管理理念开展地市级医疗器械不良事件监测的方法路径,以期为地市级监测机构医疗器械不良事件监测工作深入发展提供经验参考。
任何上市的医疗器械都是获益大于风险的风险可接受产品,医疗器械不良事件监测是医疗器械上市后安全监管的重要一环。2018年,国家市场监督管理总局、国家卫生健康委员会以第1号令的形式公布《医疗器械不良事件监测和再评价管理办法》[1],为地市级监测机构开展医疗器械不良事件监测工作提供了根本遵循。近年来,临沂市药物警戒中心以服务监管、服务产业、服务公众为目标,推动全市各级医疗机构积极上报医疗器械不良事件报告,深入开展风险信号挖掘,充分发挥医疗器械不良事件监测作为医疗器械监管的前沿哨兵作用,形成了以风险管理为核心的监测工作模式。通过总结分享临沂市医疗器械不良事件监测工作经验做法,为地市级监测机构开展医疗器械不良事件监测工作提供参考。
1.医疗器械风险管理相关概念
1.1 风险信号的概念
风险通常具有两个要素,一是损害发生的概率,即损害发生的经常性,二是损害的后果,即损害的严重性。因此,医疗器械不良事件风险信号主要围绕这两个要素来确定。
1.2 风险管理的概念
临沂市开展的医疗器械不良事件风险管理工作主要包括对风险信号的挖掘、识别、评估以及控制等过程。
2.地市级监测机构开展医疗器械风险管理的目的和意义
2.1 落实服务医疗器械上市后安全监管职责
医疗器械不良事件监测是上市后监管的重要手段之一。通过不良事件监测能及时准确发现相关产品的临床使用情况,通过相关评价和后期处置,能及时管控风险和及时处置相关产品[2]。《医疗器械不良事件监测和再评价管理办法》中也明确地市级监测机构应协助开展本行政区域内医疗器械不良事件监测相关技术工作。因此,地市级监测机构作为从事医疗器械不良事件监测工作的基层单位,也是发现、调查、处置医疗器械风险的一线单位,开展风险管理工作是落实好《医疗器械不良事件监测和再评价管理办法》,为监管部门提供有力技术支撑的重要抓手。
2.2 强化监测机构能力建设
2021年5 月,《国务院办公厅关于全面加强药品监管能力建设的实施意见》[3]中提出“建设国家药物警戒体系”,明确要求“加强药品、医疗器械和化妆品不良反应(事件)监测体系建设和省、市、县级药品不良反应监测机构能力建设”。地市级监测机构在省级和县级监测技术机构间起着承上启下的中间枢纽,而医疗器械不良事件监测工作经过10余年发展,已从报告信息收集发展到报告信息利用阶段,对地市级监测机构的能力要求越来越高。通过开展风险管理,对风险信号进行挖掘、识别、评估以及控制,可以进一步锻炼提升地市级监测机构的监测能力。
2.3 推动医疗机构落实报告职责
通过开展风险管理工作,特别是在风险信号现场调查环节,加强与监测一线的沟通交流,推动医疗机构健全完善不良事件管理工作制度程序,提高医护人员对医疗器械不良事件监测工作的思想认识。同时,通过风险信号的处置反馈,帮助医疗机构解决因不良事件产生的实际困难,使医疗机构因为参与风险管理工作而有获得感和价值感,从而推动医疗机构深入开展医疗器械不良事件监测,进一步产生正向循环。
2.4 推动医疗器械上市许可持有人落实主体责任
通过开展风险管理工作,建立起与风险信号所涉医疗器械上市许可持有人的沟通渠道,通过经常性沟通,帮助持有人打消担心医疗器械不良事件报告会影响企业或产品形象等思想顾虑,提高其主动参与监测报告的积极性,推动医疗器械上市许可持有人树牢主体责任意识。
3.临沂市医疗器械风险管理工作措施
3.1 风险信号挖掘
3.1.1 强化医疗机构监测报告收集医疗机构是医疗器械不良事件的主要发生地及救治地,而医疗器械不良事件监测个例报告收集是开展风险信号挖掘的基础,如果医疗机构连个例报告收集都做不到位,出现错报、漏报甚至虚假报告,风险信号挖掘工作就无从谈起。2006年,临沂市正式启动医疗器械不良事件监测工作,通过强化监测机构建设、构建监测网络、加强人才培养和宣传培训,以及联合卫生健康部门共同发文督导、考核、表扬等,推动临沂市各级医疗机构对医疗器械不良事件监测工作的重视程度逐步提高,并采取了许多有效措施调动上报监测个例报告的积极性,具有代表性的是临沂市某医院将医疗器械不良事件监测纳入医院质量管理体系及绩效考核中,设定奖励制度,每上报1份合格的报表给予一定金额的奖励,年底对评选出的监测先进个人予以额外物质奖励[4]。临沂市的监测报告数量从2006年的52份,增长至每年6000份左右,监测报告质量也是逐年提升,这为开展风险信号挖掘提供了坚实的基础。
3.1.2 加强个例报告分析评价
市县两级监测机构承担着督促指导医疗机构上报报告、对报告进行核实调查等基础性工作,是接触医疗器械不良事件的第一线,因此,监测机构的个例报告分析评价能力直接关系到能否及时发现风险。临沂市药物警戒中心通过派员到生产企业、到医院、到上级监测机构学习,以及成立监测专家库,定期组织专家咨询会等方式提升分析评价能力,从日常监测报告审核评价中发现的风险信号逐年增多。同时,通过市县两级监测机构定期到医疗机构开展风险信号挖掘工作督导,并将风险信号挖掘情况纳入监测工作考核,临床一线主动挖掘风险的意识和能力越来越强。
3.1.3 承担省级专业评价平台建设
由于医疗器械的特殊性,往往在大型医疗机构所使用的医疗器械种类和数量较多,特别是大型有源医疗器械、高值医用耗材等,都是风险信号的潜在热点。为此,在上级监测机构的大力支持下,从2014年起,临沂市药物警戒中心联合市内3家三甲医院承担了山东省医疗器械不良事件专业评价平台建设工作,先后对注射泵、输液泵、监护仪、呼吸机、静脉留置针等医疗器械开展专业评价。通过专业评价平台建设,培育出一批热衷医疗器械上市后安全性研究的临床、医疗器械维修和使用专家,调动和发挥临床医护人员、耗材管理人员、医疗设备工程师的积极性,3家共建医院每季度都能挖掘上报至少2个高质量风险信号。
3.2 风险信号识别与评估
3.2.1 现场调查核实
对于通过个例报告分析评价、医疗机构主动提报、外省市告知等方式收到的疑似风险信号,临沂市药物警戒中心制定了医疗器械风险信号调查程序,目的是确认疑似风险信号的真实性,并深挖其他潜在的风险。根据程序,市县监测机构要在收到疑似风险信号的3个工作日内到发生地进行现场调查核实,调查工作主要包括以下几个方面。
第一,真实性核实。①查看医疗器械不良事件原始报告表,向有关医务人员确认事件经过。②查看不良事件涉及产品或库存样品。③了解不良事件详细情况,包括患者自身情况、器械使用时间、使用目的、使用情况、不良事件情况、采取治疗的措施和时间,不良事件好转时间,使用者操作情况,器械(药)联合使用情况以及其他需要详细说明的情形。
第二,调查风险产生原因。①询问相关负责人医疗器械在医院的使用情况包括购入数量、已使用量、库存量、在各个科室使用情况、有无此类或其他不良事件发生以及医疗仪器设备使用维修记录等。②查看医疗器械的实际使用环境,确认是否由环境因素引起不良事件的可能性。③与风险信号所涉医疗器械上市许可持有人沟通,告知其风险信号发生情况,了解医疗器械相关产品特点、操作使用要求及培训情况等,确认是否由设计、生产、培训等环节引起不良事件的可能性。
第三,提取相关材料。包括:①报告单位的不良事件情况说明。②患者病历。③采购相关资质说明(需提供相关证明材料)。④经销商名称及联系方式(或售后)。⑤产品说明书以及其他警示性说明等资料。⑥产品数码照片或其他影像资料(不良事件涉及产品及关键部位、标签标识、使用过程视频、产品电镜下图片等)。⑦追溯条码标签、植入性医疗器械使用登记表等。
3.2.2 分析评估
对于经现场调查后确认为疑似风险信号的医疗器械,临沂市药物警戒中心会根据风险信号两要素及主要情形,再结合以下工作进一步分析评估:①查询风险信号所涉医疗器械在国家医疗器械不良事件监测信息系统中的报告情况,并进行统计分析。②查询文献,通过查阅中国知网、万方数据库中风险信号所涉医疗器械不良事件的相关文献,分析不良事件发生的原因。③查询医疗器械所涉国际标准、国家标准、行业标准等,明确风险信号所涉医疗器械是否符合现行标准要求。④咨询专家库专家,通过咨询风险信号所涉医疗器械相关领域的专家,进一步明确不良事件发生原因,并深挖潜在的其他风险。
3.2.3 召开专家咨询会
经过分析评估后,认为需要进一步深挖风险、征求专业意见的风险信号,临沂市药物警戒中心会在每个季度的最后一个月月初组织召开风险信号专家咨询会,召集监管人员、专家库专家、生产企业人员进行会商座谈,由风险信号提报单位制作汇报课件介绍风险信号基本情况、风险点、控制措施建议等,咨询会将收集与会人员的意见建议,会后,临沂市药物警戒中心会整理汇总各方面意见,起草风险信号调查报告。
3.3 风险控制
临沂市药物警戒中心会在风险信号调查报告中提出风险控制措施建议,并将报告上报市级药品监管部门和省级监测机构。风险控制措施建议主要包括:①从督促持有人落实主体责任角度,会建议持有人深入调查风险信号发生原因,必要时主动对产品发出警告提醒,甚至退换货或召回,进一步改进生产工艺或流程。②从服务监管角度,会建议监管部门在必要时对风险信号所涉医疗器械进行监督抽检,甚至对所涉上市许可持有人进行飞行检查,明确在生产环节、流通环节是否存在违法违规情况。③从保障医疗安全角度,会建议医疗机构密切关注风险信号所涉医疗器械的使用情况,做好日常维修保养和储存管理,规范临床使用操作,如有不良事件发生及时上报,必要时及时停用该医疗器械。
4.开展风险管理工作取得的成效
2018 年以来,临沂市共收集医疗器械不良事件风险信号319个,调查撰写风险分析报告并上报市级药品监管部门、省级监测技术机构108个,其中医用血管造影X射线机(DSA)透视模式成像模糊临床使用风险和疑似球管质量风险,电子内窥镜金手指漏水,呼吸机、婴儿培养箱设计风险,正压静脉留置针聚集性不良事件等66个风险信号被省级监测机构关注。临沂市药品监管部门依据一次性无菌溶药注射器筒壁有墨斑且易剥落、正压静脉留置针聚集性不良事件等风险信号开展监督抽样5次,赴生产企业进行飞行检查1次,充分发挥了服务监管的前沿哨点和侦察兵作用。近5年(2018年~2022年)风险信号挖掘情况如表1所示,部分风险信号举例如表2所示。
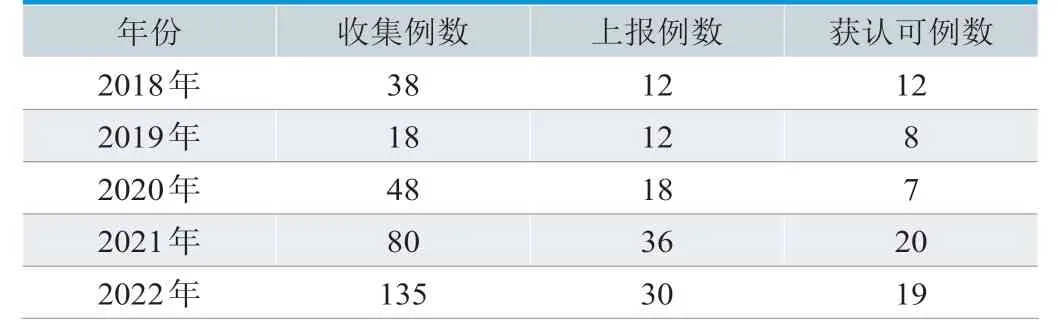
表1. 临沂市近5年风险信号挖掘情况(n)

表2. 部分风险信号举例
5.体会与思考
5.1 市县两级监测机构建设是开展风险管理工作的基础
强化市县两级监测技术机构建设对于提高报告率以及保证报告的真实、完整、准确具有十分重要的现实意义,是开展风险管理工作的基础。但是当前,部分地市级监测机构在改革中被不同程度弱化,独立设置的市级监测机构减少县级监测机构力量大大削弱,专业技术人员配备不足,监测能力仅能满足于个例报告的收集和审核评价,可能会导致该发现的风险无法及时发现,该处置的风险无法妥善处置,这对地市级监管部门落实医疗器械上市后安全监管职责会造成一定程度的负面影响。
5.2 要进一步提高医疗机构对风险管理工作的认识
近几年,临沂市药物警戒中心通过宣传培训、组织专家,咨询会、信号处置情况反馈等措施,不断提高医疗机构对风险管理工作的认识。但是在日常的督导中发现,虽然医护人员对上报医疗器械不良事件报告都能树立“可疑即报”观念,但是对风险信号的认识仍不足,无法第一时间上报风险信号,可能导致在调查时,耗材类医疗器械已被废弃或销毁,设备类医疗器械已被返厂维修,监测机构无法获取第一手资料,进而影响对风险信号的分析评价。
5.3 部分上市许可持有人对不良事件监测仍认识不足
在开展风险管理工作过程中,特别是在风险信号调查中,能感受到大部分持有人对医疗器械不良事件监测的认识在逐步提高,能够积极配合地市级监测机构开展风险管理工作。但是仍有部分持有人对不良事件监测的认识不足,仍存在担心医疗器械不良事件报告会影响企业或产品形象等思想顾虑,主要表现在:①报告评价过程中骚扰医护人员,2019年国家医疗器械不良事件监测系统改版上线后,要求持有人对收到的每一份报告进行评价,并对持有人公开报告填报人员的联系方式,新系统上线这一功能的初衷是方便持有人快速高效地调查不良事件,但是部分持有人利用这一功能在深夜甚至凌晨拨打填报人员电话进行调查,或者持续拨打恶意骚扰,严重影响填报人员的工作生活,进而影响其报告积极性。②持有人在系统内填写的不良事件处理意见中,不良事件发生情况调查与实际完全不符,并将发生原因恶意推向医护人员使用原因。
6.小结
做好个例医疗器械不良事件报告的收集,保证每一例报告的真实、完整、准确是地市级监测机构开展风险管理的基础性工作。与药品不良反应监测报告的市、县两级两次审核不同,新版国家医疗器械不良事件监测系统取消了县级审核,从医疗机构上报报告到上市许可持有人评价报告只有市级审核这一次审核,这在方便地市级监测机构直接对接上报单位,更利于快速发现风险信号的同时,也对地市级监测机构的审核质量提出更高要求。地市级监测机构一方面要从风险管理工作中积累经验和提升能力,做到快速、准确地从个例报告中发现问题和风险,另一方面要通过风险管理工作,进一步加强对医疗机构的宣传培训和督导,促使其不断提升报告质量。
在医疗器械不良事件风险管理研究中,许多省级监测机构提出了风险定量或半定量评估分析方法,这为地市级监测机构深入开展风险管理工作,提高风险管理水平提供了具体的方法指导。

