半自动化学发光免疫分析仪注册审评要点分析
吴林蔚 陈虹蓁 赖锦坝 李风梅 李小江 王小良 广东省药品监督管理局审评认证中心 (广东 广州 510080)
内容提要: 基于医疗器械法规和配套指导性文件的更新,根据现行相关法规指南的要求,从注册审评的角度出发,对半自动化学发光免疫分析仪的综述资料、非临床资料、产品说明书等方面进行要点分析,以期为企业申请注册该类产品时提供参考。
化学发光免疫分析是将具有高灵敏度的化学发光测定技术与高特异性的免疫反应相结合,将发光物质或酶标记在抗原/抗体上,通过免疫反应从样本中分离待测组分,再通过加入发光剂来发生化学发光反应,从而显示分离的待测组分,最后以测定发光强度得出待测组分的含量,在临床上用于检测分析各种抗原、半抗原、抗体、酶、激素、维生素、脂肪酸和药物等。《医疗器械注册与备案管理办法》[1]已于2021年10月1日发布施行,随后国家药品监督管理局和国家药品监督管理局器审中心相继发布相关的配套指南文件,本文将基于现行相关法规指南的要求,从注册审评的角度出发,对半自动化学发光免疫分析仪的综述资料、非临床资料、产品说明书等方面进行要点分析,以期为企业申请注册该类产品时提供参考。
1.国内半自动化学发光免疫分析仪产品监管概况
本文阐述的产品半自动化学发光免疫分析仪是指以手工或者其他方式完成加样本、加试剂、混匀、洗涤、孵育等部分或全部流程,然后仪器自动进行测试、计算和报告结果的化学发光免疫分析仪。
1.1 管理类别
根据《医疗器械分类目录》[2],半自动化学发光免疫分析仪的管理类别为Ⅱ类,分类编码为22-04-02。
1.2 产品名称
参考目前已上市同类产品名称以及行业标准YY/T 1174[3],建议企业将产品命名为半自动化学发光免疫分析仪。若有其他命名情形的,企业需根据相关指导原则提交充分且详细的确定依据。
1.3 国内“半自动化学发光免疫分析仪”获批准产品
在国家药监局官网的数据查询页面查找产品名称为“半自动化学发光免疫分析仪”的产品,经查可知已获批准产品共17个,涉及的厂家见表1。17个已获批准产品均为国产产品,无进口产品。
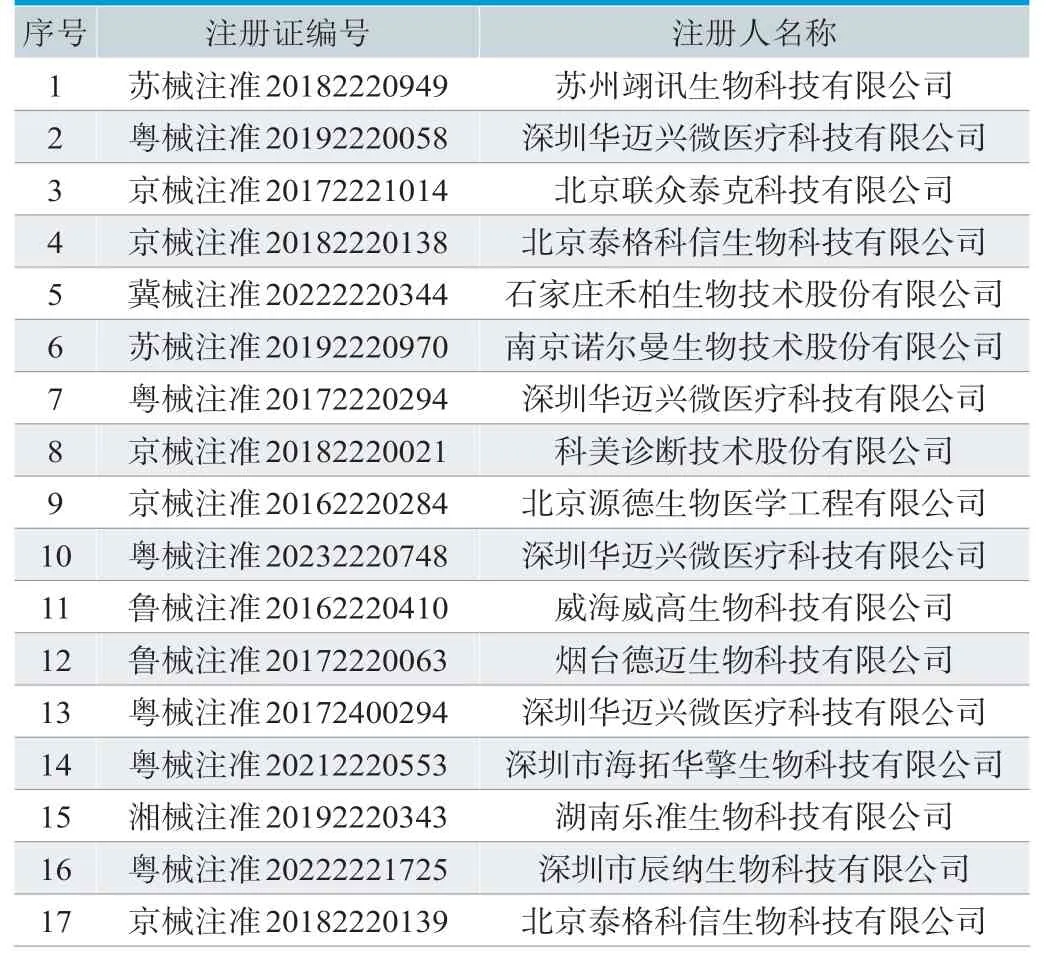
表1. 国内“半自动化学发光免疫分析仪”获批准产品
2.半自动化学发光免疫分析仪产品结构组成及功能
2.1 结构组成
该类产品主要由控制模块、检测模块、数据处理模块、显示及打印模块组成。
检测模块:主要功能是将采集到的光信号转化为可读取的数字信号。一般包括以下结构:①光电倍增管或其他高灵敏度传感器;②传感器驱动电路、信号处理电路等外围电路;③滤光片、反光镜等光学器件;④测量暗室及其他机械零件。以光电倍增管为例,光信号经PMT转化为电信号,再经过放大、甄别、分频等处理,最后转化为计数值,示意图见图1。
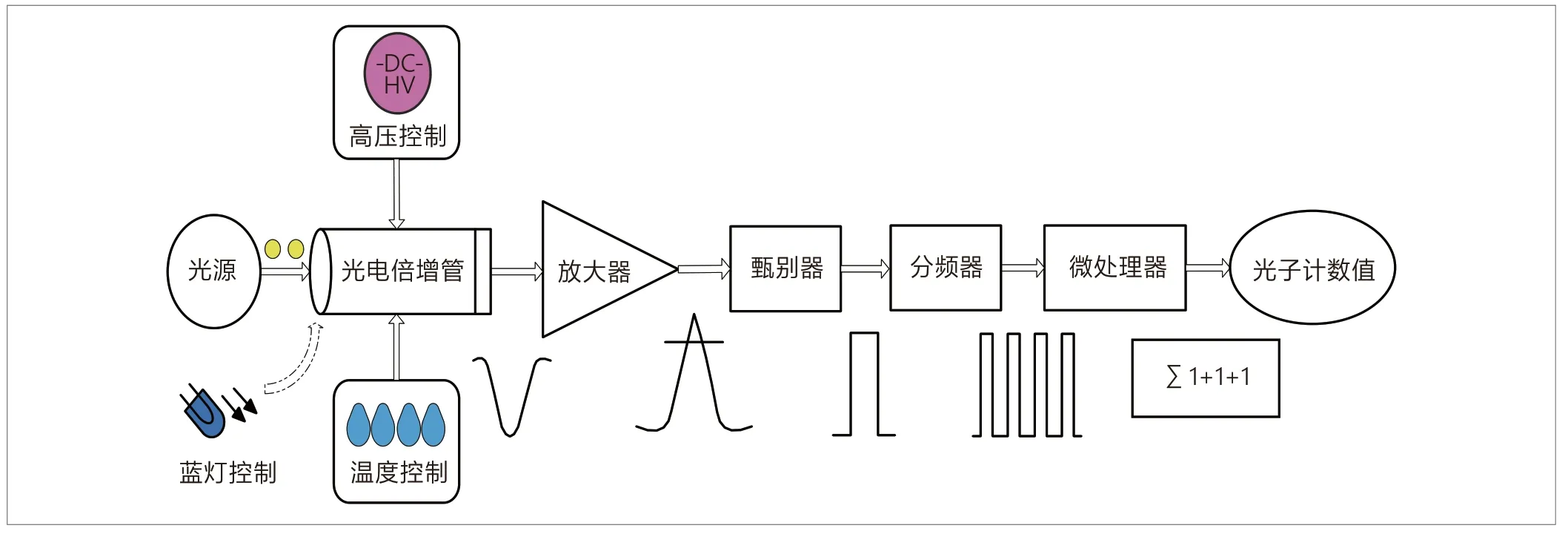
图1. 半自动化学发光免疫分析仪产品结构组成示意图
控制模块:一般可分为加样模块、孵育模块、磁分离模块、液路模块等模块,主要功能是控制各运动部件对反应容器实施加试剂、孵育、磁分离清洗等动作过程。一般包括以下结构:①电机、泵、阀、风扇、加热器件等执行元件;②执行元件控制电路;③执行机械零件;④电源。反应容器一般有单管式和微孔板式,单管式为单孔,仅支持单个测试;微孔板式为多个孔,并拼接成一板,可支持多个测试。
数据处理模块:主要功能是对光信号计数值进行浓度换算、分析、传输,读取样本条码信息,连接实验室信息管理系统获取样本信息及传输结果等。一般包括以下结构:①处理器及外围电路;②通信网络;③其他数据获取及处理模块。
显示模块:主要功能是提供人机交互界面,常用的触控显示屏,可显示样本、试剂、仪器运行状态等信息,也可通过显示屏对仪器进行加载样本、耗材、开关机等操作。
打印模块:主要功能是打印样本分析结果报告,常用于热敏打印机,也可外接其他打印设备。
建议企业采用图文形式来说明产品结构组成具体情况,并且确保申报材料中不同资料关于结构组成部件的描述保持一致,例如申请表、综述资料、说明书等资料。
2.2 工作原理
化学发光免疫分析一般包括两个主要部分,分别是免疫反应系统和化学发光分析系统。一方面,免疫反应系统和放射免疫测定中的抗原抗体反应系统相同;另一方面,化学发光系统则是利用某些化合物(发光剂或者发光底物)经过氧化或催化后从基态跃迁到电子激发态,当其衰退到基态时以发射光子形式来释放能量,也即是发光,然后再利用发光信号能量仪测量光量子的产额。将发光物质标记在抗原(化学发光免疫分析)或者抗体上(免疫化学发光分析),或者酶作用于发光底物,产生的光量子的强度与待测物的浓度可成比例。
建议企业结合产品实际情况详细描述产品的工作原理、所使用的方法学以及发光剂或者发光底物。
2.3 适用范围
企业需明确产品的预期用途,建议至少考虑方法学、样本类型、定量和/或定性分析等内容。方法学应根据采用的发光剂类型来明确具体方法;样本类型包括血浆、血清、尿液等临床分析常见样本类型;定量和/或定性分析根据产品实际情况来确定。企业还需明确产品预期使用地点例如医疗机构等,以及使用环境例如空间要求、温度、湿度、电源要求等。
2.4 产品优势特点
虽然该类产品目前已获批准产品数量不多,但基于其自身特点,仍然是部分急诊科、社康、乡镇卫生院或其他小型医疗机构的首选。该类产品具有以下特点:①高性价比。首先,从方法上来看,相对于胶体金、免疫荧光这些方法学,该类产品的方法学更优和灵敏度更高;其次,相对于全自动化学发光免疫分析仪,半自动化学发光免疫分析仪的构造更简单,仪器成本更低,应用环境要求也更宽松,更容易实现基层推广;再次,目前市场上陆续出现了配套该类产品的单人份试剂,避免测试量少而造成浪费。②灵活小巧。该类产品体积小、占地面积小,重量轻、操作简单。③易于维护。该类产品易损易耗件更少,无需人为频繁维护,降低了维护成本。基于前述优势,该类产品仍有它独特的市场需求,不少国产厂家仍然在研发升级该类产品。
3.非临床资料
3.1 产品技术要求
产品技术要求应根据编写指导原则要求来编写,主要包括型号/规格及其划分说明、性能指标、检验方法等内容。
型号/规格及其划分说明部分需明确各型号/规格间的差异,一般建议以表格形式予以说明。此外,还需说明软件组件的信息,包括软件名称、型号规格(若不适用可省略)、发布版本、版本命名规则。
性能指标、检验方法可参考YY/T 1174[3]来制定,至少包括测光值重复性、测光值稳定性、线性范围、孔间干扰(不适用于单管式分析仪)、最低响应值、外观等内容。安全要求考虑采用国家/行业标准GB 4793.1[4]、GB 4793.9[5]和YY 0648[6]。若产品有温控模块,还需考虑采用国家标准GB 4793.6[7]。电磁兼容性要求考虑采用国家标准GB/T 18268.1[8]和GB/T 18268.26[9]。软件功能要求建议根据《医疗器械软件注册审查指导原则(2022年修订版)》[10]来制定,包括软件的功能、使用限制、接口、访问控制、运行环境(若适用)、性能效率(若适用)等要求,需明确软件组件全部临床功能纲要的要求。
3.2 检验报告
关于检验报告企业可以提交自检报告或者委托检验报告。注册自检应按国家药监局《关于发布<医疗器械注册自检管理规定>的公告(2021年第126号)》[11]的规定来执行。注册申请人委托有资质的检验机构检验,建议需对受托检验机构的资质、检验能力、检验范围进行评价,并提交对检验机构的评价意见。
3.3 研究资料
3.3.1 产品性能研究
3.3.1.1 各组成模块性能的研究资料
建议企业根据产品结构组成和各主要组成模块的情况提供详细的研究资料,至少考虑主要关键模块如检测模块、控制模块和数据处理模块。
3.3.1.2 临床项目分析性能的研究资料
建议企业提供产品代表性临床项目的分析性能研究资料,考虑产品的方法学、适用的样本类型、可检测项目类型等实际情况,采用临床样本并选取代表性的临床项目进行研究,对主要性能进行系统性评估。
3.3.2 软件
3.3.2.1 软件研究
企业需根据《医疗器械软件注册审查指导原则(2022年修订版)》[10]提供自研软件研究报告,包括基本信息、实现过程、核心功能、结论等内容,详尽程度取决于软件安全性级别(严重、中等、轻微)。考虑到该产品软件分析的结果对检测结果会产生影响,其软件安全性级别建议至少为中等。此外,还需提交GB/T 25000.51[12]自测报告。
3.3.2.2 网络安全
含有软件组件的产品如果具备电子数据交换、远程控制或者用户访问功能,企业还需根据《医疗器械网络安全注册审查指导原则(2022年修订版)》[13]要求提供网络安全研究资料,包括基本信息、实现过程、漏洞评估、结论等内容,详尽程度取决于软件安全性级别。
3.4 其他资料
化学发光免疫分析仪已列入《免于临床评价医疗器械目录》[14](以下简称“目录”),而该类产品属于化学发光免疫分析仪的范畴,因此,一般情况下该类产品可按免于临床评价提交其他资料。企业应按照《列入免于临床评价医疗器械目录产品对比说明技术指导原则》[15]的要求提交对比说明资料,证明产品与《目录》所述的产品具有等同性。
产品相关信息与《目录》所述内容的对比资料,建议重点从结构组成、反应原理、样本类型等方面进行对比。
产品与《目录》中已获准境内注册医疗器械的对比说明,对比项目建议重点关注工作原理、结构组成、性能要求、适用范围、使用方法等方面。工作原理对比时建议企业至少明确所使用的方法学、发光剂或者发光底物、免疫反应模式、光信号与检测物质浓度的关系等内容。在结构组成对比时应详细分析两个产品的组成模块,建议附上实物图或者产品示意图来阐述分析。性能要求对比时参考行业标准YY/T 1174[3]的要求来逐项进行比对,此外对于产品的其他功能指标、软件指标也建议详细列明来对比分析。适用范围对比时建议重点考虑样本类型、检测物质类型。使用方法对比时考虑产品的工作环境、操作人员要求等。对比存在差异时企业应提交相应的分析研究资料,确保差异不影响产品的安全有效性。
若申请产品不在《免于临床评价医疗器械目录》[14]的产品“化学发光免疫分析仪”描述范围之内,或无法证明其与《目录》所述的产品具有等同性,则建议按相关指导原则进行临床评价。
4.产品说明书
编写说明书应符合《医疗器械说明书和标签管理规定》[16]和相关标准的要求,重点考虑描述以下内容:①结构组成。建议企业采用图文形式来说明产品的结构组成具体情况。②工作原理。建议企业采用图文形式来详细描述工作原理。③性能指标。企业应阐述清楚产品基本参数、正常工作条件、电气安全、电磁兼容信息、整机性能指标等内容。④使用说明。建议企业采用图文形式详细描述与适配试剂的具体操作方法,同时人机交互界面如何操作也采用图文形式进行详细描述。⑤软件。建议企业根据《医疗器械软件注册审查指导原则(2022年修订版)》[10]对软件的全部功能进行描述,同时明确软件的发布版本。若产品还涉及医疗器械网络安全,需根据《医疗器械网络安全注册审查指导原则(2022年修订版)》[13]提供网络安全说明和使用指导。
5.小结
随着医疗器械法规和配套指导性文件的更新,本文是基于现行相关法规指南的要求,分析半自动化学发光免疫分析仪产品的注册审评要点,希望为企业申请注册该类产品时提供参考以及编写注册申报资料起到指导作用。

