蓖麻RcSRS家族鉴定及表达模式分析
徐兴源, 李艳肖, 朱梦洋, 向殿军, 刘 鹏
(内蒙古民族大学农学院/内蒙古民族大学科尔沁沙地生态农业国家民委重点实验室, 内蒙古 通辽 028000)
SRS(SHI-related sequence)基因,也被称为短节间(STY)基因,编码植物特有的一类转录因子,在应对各种刺激信号的特异性反应中有着至关重要的作用。第1个SRS基因是在拟南芥(Arabidopsisthaliana)中发现的,被命名为LRP1基因[1]。SRS基因拥有2个特殊的结构域:环形锌指结构域(C-X2-C-X7-C-X-H-X2-C-X2-C-X7-C-X2-H)[2-3]和IGGH结构域[4]。其中,环形锌指结构域是RING结构域(C3H2C3或C3HC4)的一种,保守的RING结构域最早在动物非洲爪蟾(Xenopuslaevis)中被发现,其中有1个DNA结合基序[5],该结构域能与RNA、蛋白质等互作,参与细胞的生理和生化过程[6];而IXGH结构域是同源异构化所必需的[7]。除了这两个保守结构域之外,其余的蛋白质是高度分化的[8]。
SRS基因在植物器官的生长[9]、心皮发育[10]和信号转导[11]等方面均有重要作用。目前,SRS家族已在拟南芥、水稻(OryzasativaL.)、棉花(Gossypiumspp.)和大麦(HordeumvulgareL.)等不同植物中被鉴定和表征。拟南芥中有11个SRS家族成员被报道,其11个成员均拥有环形锌指结构域和IGGH结构域,其中侧根原基1(LRP1)会与SHI、SRS3和SRS6等形成复合体[4,12-14],从而影响侧根和不定根原基的发育,还能影响染色质的修饰和生长素信号传导[15]。据报道,拟南芥SRS5基因是光形态建成的正调控因子,可直接与光形态建成基因(如HY5、BBX21和BBX22)的启动子结合,激活其表达,促进光形态建成[15-19]。
SRS家族可参与并影响植物的生物合成。如:拟南芥的STY1和STY2基因可以调节生长素的生物合成,并以剂量依赖的方式协同调控拟南芥雌蕊、雄蕊和叶片的发育[8],其中STY1基因主要在发育的雌蕊中表达[20-21]。另外,STY1基因突变后会造成雌蕊发育不良,叶片的发育也会受到影响[8,22]。
SRS家族还参与多种非生物胁迫诱导[23-24]。例如,在紫花苜蓿(Medicagosativa)的茎组织中,有27个MsSRS基因的表达受到冷胁迫和盐胁迫的诱导,呈现出不同的表达模式,表明MsSRSs可能在冷胁迫和盐环境下在苜蓿的茎组织中发挥作用[23]。大豆(Glycinemax)SRS家族的21个成员在干旱、盐和外源ABA诱导下也表现出不同的表达模式,其中GmSRS18在盐胁迫下显著表达[24]。然而,蓖麻(Ricinuscommunis)的SRS家族成员的鉴定和相关的研究却鲜有报道。
蓖麻是大戟科蓖麻属植物,在工业[25]、医药[26]和航天[27]等诸多领域都有应用,在环境保护和修复等方面也发挥着积极作用。蓖麻适应环境能力强,在盐碱、贫瘠和污染严重的环境下依然能正常生长[28-30],而SRS家族在应对低温、盐和干旱胁迫的过程中起着重要的作用[23-24]。本研究从蓖麻全基因组数据中检索出蓖麻的SRS基因,并对筛选出的蓖麻SRS基因进行系统的生物信息学分析。根据课题组在蓖麻转录组数据中检索出的RcSRS基因FPKM表达值,分析其在不同环境胁迫下的表达模式,为后续深入研究RcSRS基因在蓖麻中的功能提供理论依据。
1 材料与方法
1.1 蓖麻SRS家族成员筛选与理化性质分析
从油料作物数据库(http://oilplants.iflora.cn/)获取蓖麻的基因组序列文件、蛋白质序列文件和基因组注释文件。在Rice Geneme Annotation Project 数据库(http://rice.uga.edu/)中获得的日本晴水稻SRS基因家族蛋白质序列作为靶标序列进行本地Blastp比对;并使用hmmer软件,以PF05142模型检索出含有该结构域的蛋白质序列。结合BLASTP和hmmer的结果,删除冗余序列后将获取的蛋白序列上传到NCBI-CD SEARCH 和SMART(https://smart.embl-heide-lberg.de/)网站,确保所筛选的蓖麻SRS蛋白质序列准确,最终得到5个蓖麻RcSRS家族成员。蓖麻RcSRS家族成员的理化性质分析在ExPASy网站 (https://web.expasy.org/)完成。用WoLF PSORT(https://wolfpsort.hgc.jp/)来预测RcSRS的亚细胞位置。RcSRS蛋白质的磷酸化位点预测在NetPhos3.1 (https://services.healthtech.dtu.dk/service.php?NetPhos-3.1)网站完成。
1.2 蓖麻RcSRS家族成员的高级结构分析
RcSRS蛋白质的二级和三级结构预测分别使用SOPMA (https://npsa-prabi.ibcp.fr/cgibin/npsa_automat.pl? page=npsa_sopma.html)和SWISS-MODEL(https://www.swissmodel.expasy.org/)在线网站完成,再由SAVES v6.0(https://saves.mbi.ucla.edu/)在线工具对三级结构模型进行打分。
1.3 蓖麻RcSRS家族成员系统进化和基因结构分析
使用MEGA11.0软件对RcSRS蛋白质进行进化树的构建。使用MEME(https://meme-suite.org/meme/doc/meme.html)在线软件预测RcSRS蛋白质的保守基序,最大Motif数量设置为10,其他参数默认。使用TBtools软件完成基因结构和保守基序的可视化。
1.4 蓖麻RcSRS家族在染色体上的定位和共线性分析
利用TBtools软件提取出RcSRS家族成员在染色体上的位置信息和共线性关系信息,最终使用Advanced Circos程序可视化结果。
1.5 蓖麻RcSRS启动子的顺式作用元件分析
先从蓖麻的基因组中获取RcSRS基因转录起始上游1 500 bp的序列,提交至PlantCare(https://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测RcSRS启动子顺式作用元件的组成。
1.6 蓖麻与日本晴水稻物种间SRS蛋白质的聚类分析
把日本晴水稻的OsSRS蛋白质序列和蓖麻的RcSRS蛋白质序列整合到同一个文件中,然后用MEGA11.0软件构建进化树,将结果提交到iTol(https://itol.embl.de)工具中进行美化处理。
1.7 蓖麻RcSRS家族成员的表达模式分析
以蓖麻品种“通篦5号”为试验材料,选取籽粒饱满,大小、光泽和斑纹一致的蓖麻籽种子。后续种子的培养,植株的胁迫处理,总RNA的提取,cDNA文库的构建等参照李艳肖等[31]的方法。从RNA-Seq数据中筛选出RcSRS基因的胁迫表达量数据;并下载Brown等[32]蓖麻的RNA-Seq原始数据,经质控后筛选出RcSRS基因的组织表达量数据。将上述最终得到的胁迫表达量数据和组织表达量数据提交到TBtools软件进行热图可视化处理。
2 结果与分析
2.1 蓖麻RcSRS家族成员信息和理化性质分析
根据基因在染色体上的位置,把从蓖麻中筛选到的5个RcSRS家族成员依次命名为RcSRS1、RcSRS2、RcSRS3、RcSRS4、RcSRS5,并对其蛋白质进行基本理化性质分析(表1)。RcSRS蛋白质的氨基酸数量为199~350个;分子质量为22.11~37.87 kD;理论等电点在6.65~9.20之间,除了RcSRS3外均是碱性蛋白质(pI>7);脂肪酸介于47.97~61.54之间;除RcSRS1之外,其余均是不稳定性蛋白质;RcSRS蛋白质为亲水性蛋白质;RcSRS蛋白质的亚细胞预测结果显示,定位于细胞核的有4个(RcSRS2、RcSRS3、RcSRS4、RcSRS5)、定位于细胞膜的有1个(RcSRS1)。
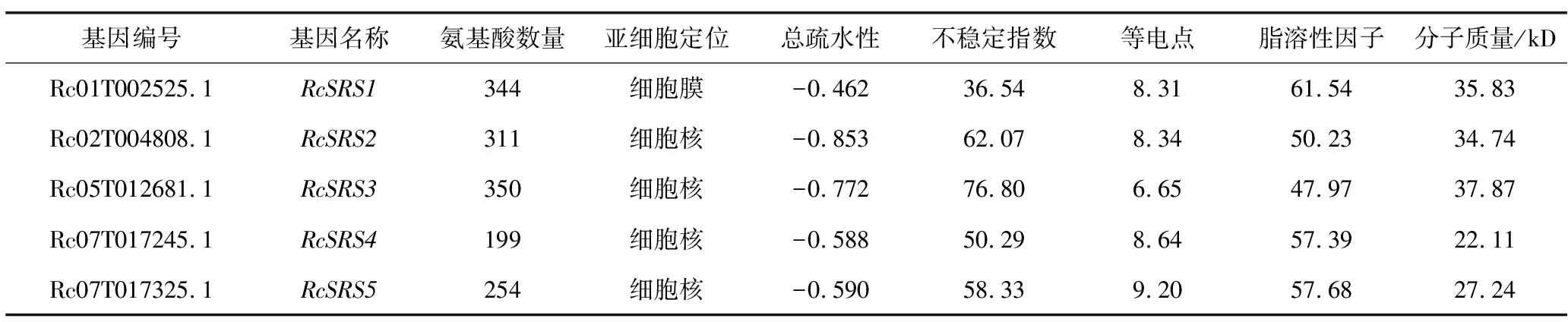
表1 蓖麻RcSRS家族成员的基本信息
RcSRS蛋白质的磷酸化位点预测结果(图1)表明,潜在的丝氨酸磷酸化位点数为12~30个,苏氨酸磷酸化位点数目为8~17个,酪氨酸磷酸化位点数为2~5个。
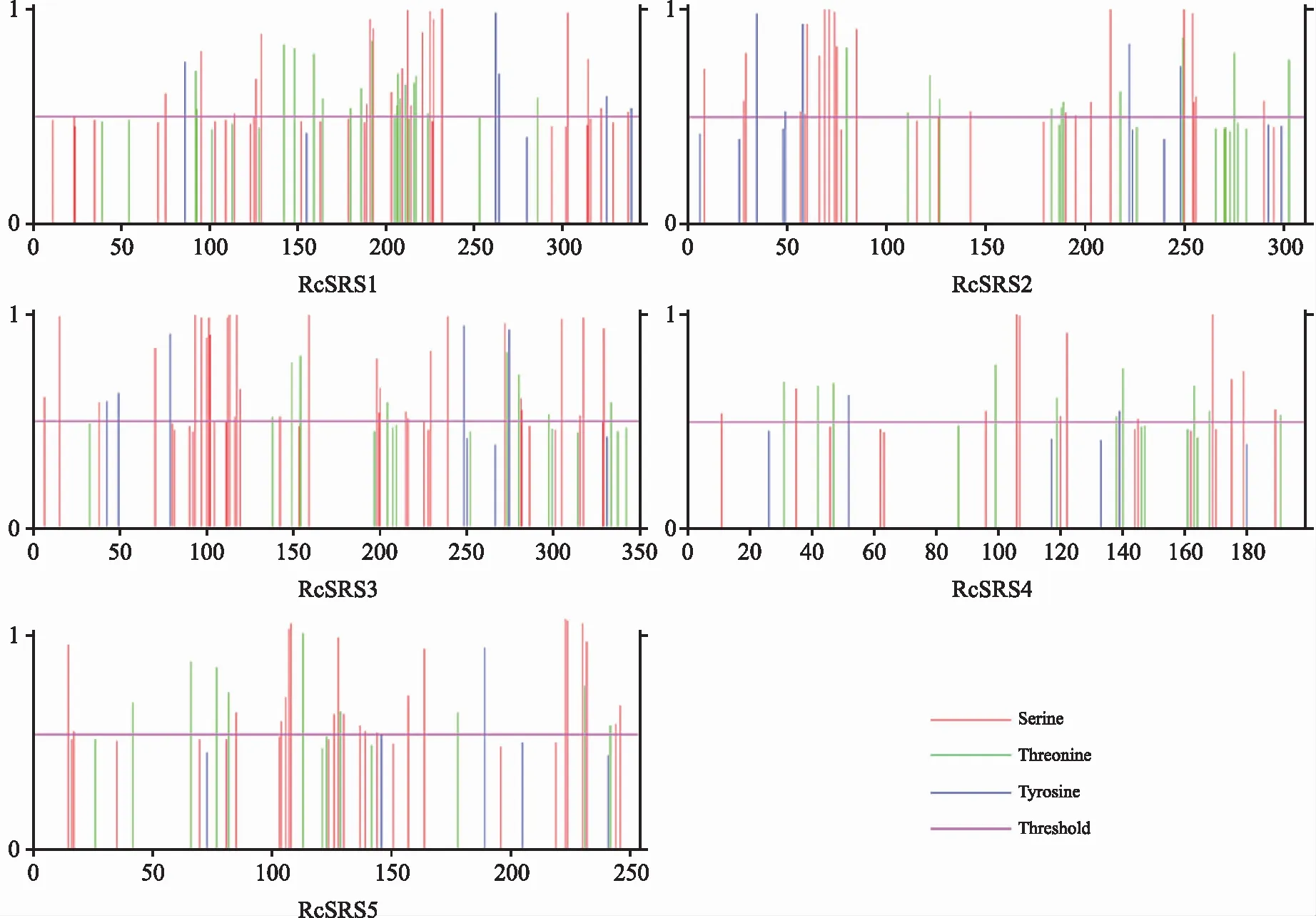
图1 蓖麻RcSRS蛋白质的磷酸化位点
2.2 蓖麻RcSRS家族成员的高级结构分析
RcSRS蛋白质的二级和三级结构预测结果(表2,图2)显示,RcSRS蛋白质主要以不规则卷曲为主,除RcSRS1外,其余RcSRS蛋白质均无β折叠结构;SAVES v6.0 模型检测结果(图2右)显示,RcSRS1、RcSRS2和RcSRS3蛋白质的氨基酸残基中有66.7%位于core区域,22.2%位于次允许区域;编码RcSRS4和RcSRS5蛋白的氨基酸残基中有57.1%位于core区域,28.6%位于次允许区域,表明RcSRS蛋白质的三级结构模型构建结果合理。
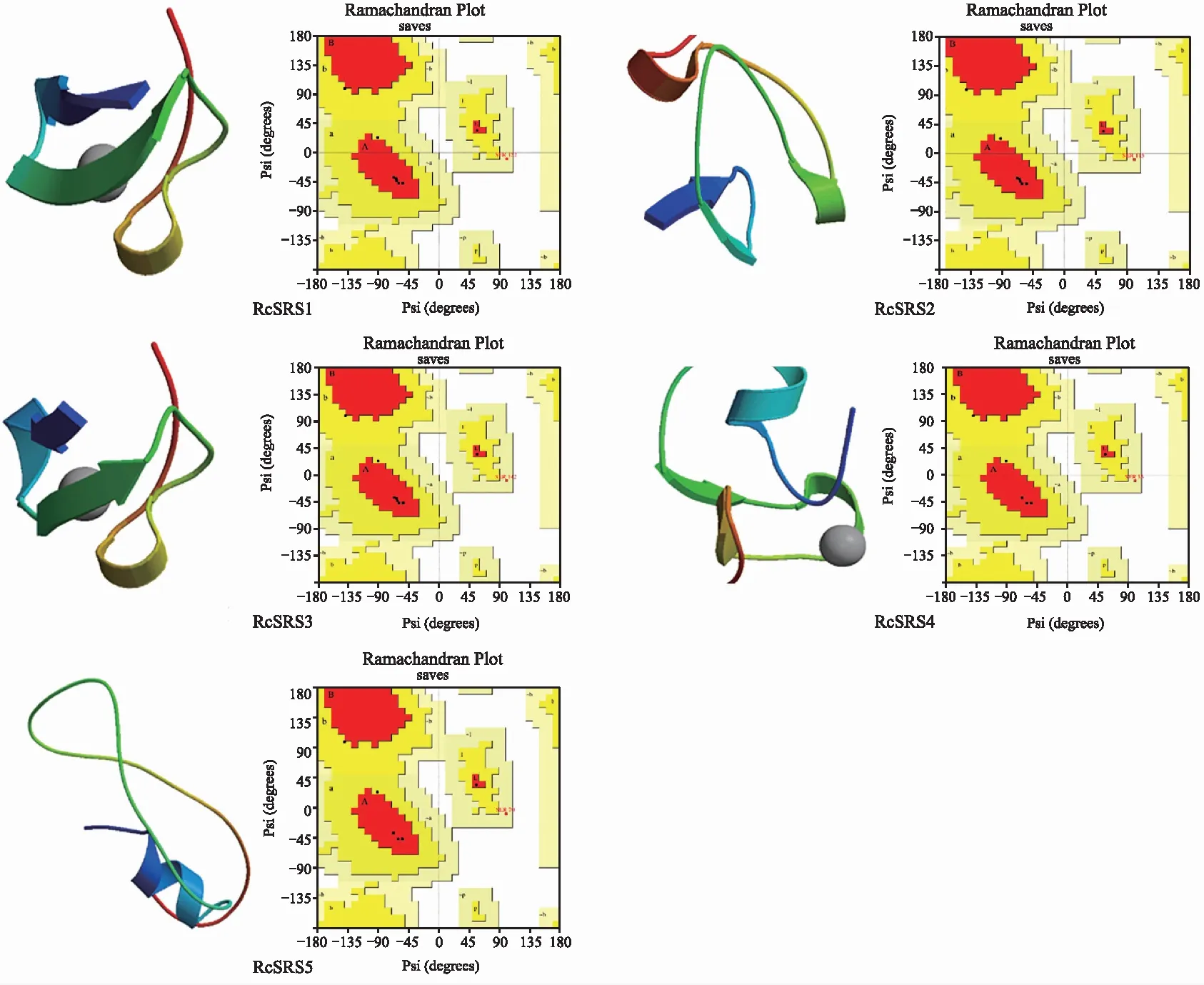
注:左为蛋白质的三级结构预测;右为蛋白质的三级结构检测。

表2 蓖麻RcSRS蛋白质的二级结构
2.3 蓖麻RcSRS家族成员系统进化、保守基序和基因结构分析
进化树结果(图3)表明,5个蓖麻RcSRS蛋白被聚为3组。其中RcSRS2和RcSRS3在类群Ⅰ中,RcSRS4在类群Ⅱ中,RcSRS1和RcSRS5则在类群Ⅲ中。保守基序预测结果显示,RcSRS蛋白质的保守基序的种类和数目均不相同,其中RcSRS1和RcSRS5基序数目最少,均有4个;RcSRS2和RcSRS3的保守基序数目最多,均有8个。基因结构预测结果显示,RcSRS基因结构较为简单,仅RcSRS5含有3个外显子,RcSRS1、RcSRS2、RcSRS3、RcSRS4均仅有2个外显子,说明RcSRS基因在结构上具有保守性。

图3 蓖麻RcSRS家族成员系统进化和基因结构分析
2.4 蓖麻RcSRS家族在染色体上的定位和共线性分析
图4结果表明,蓖麻RcSRS基因分布在4条染色体上,其中Chr7上拥有两个RcSRS基因。RcSRS家族成员存有3对共线性关系,分别是RcSRS2~RcSRS3、RcSRS2~RcSRS5和RcSRS3~RcSRS5,说明RcSRS基因在进化过程中存在基因间的复制现象。
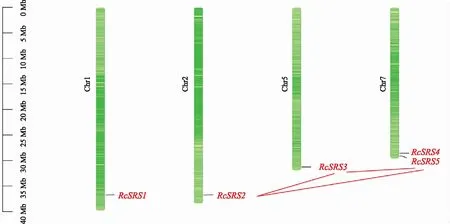
图4 蓖麻RcSRS家族在染色体上的定位和共线性分析
2.5 蓖麻RcSRS家族顺式作用元件分析
对RcSRS启动子区域的顺式作用元件进行预测,结果(图5)表明,RcSRS拥有多个与逆境胁迫响应、防御反应和应激反应等相关的顺式作用元件。其中RcSRS2的顺式作用元件数量和种类都是最多的;光响应元件在RcSRS启动子中数量最多,说明光在RcSRS基因表达调控的过程中发挥着重要作用;RcSRS4除了光响应元件外仅有1个厌氧诱导相关元件,说明不同的RcSRS基因对逆境胁迫和激素处理的应答模式存有差异;另外,RcSRS2、RcSRS3、RcSRS5启动子中都含有干旱胁迫响应元件,说明它们可能均响应干旱胁迫。RcSRS的顺式作用元件分析说明,RcSRS家族基因在调控蓖麻的生长和发育以及在胁迫响应等方面均起着重要的调控作用。
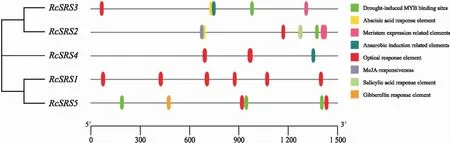
图5 蓖麻RcSRS家族顺式作用元件分析
2.6 蓖麻与日本晴水稻SRS家族成员间的聚类分析
蓖麻(5个)与日本晴水稻SRS(5个)家族成员的聚类结果(图6)表明,10个SRS蛋白质被聚为三类(类群Ⅰ~类群Ⅲ)。每个亚家族的SRS成员数不等,RcSRS蛋白质只分布于类群Ⅰ和类群Ⅲ中,在类群Ⅲ中分布最多(有3个),分别是RcSRS2、RcSRS3、RcSRS5,在类群Ⅰ中分布最少(只有2个),分别是RcSRS1和RcSRS5。以上结果表明,RcSRS和OsSRS在进化关系上比较近,有较高的同源性。
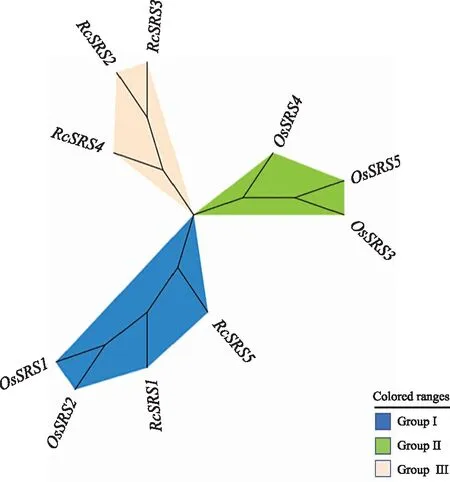
图6 蓖麻与日本晴水稻SRS家族成员间的聚类分析
2.7 蓖麻RcSRS家族成员的表达模式分析
2.7.1蓖麻RcSRS家族成员在不同组织中的表达模式分析
蓖麻RcSRS基因的表达模式分析(图7)表明,RcSRS1基因在胚乳、萌芽的种子、叶片中都表达;RcSRS5基因在雄花中表达水平最高,表明RcSRS5基因可能参与并影响雄花的发育;RcSRS2、RcSRS3、RcSRS4基因在不同组织的表达量都很低或不表达。综上,RcSRS基因拥有组织表达的特异性。
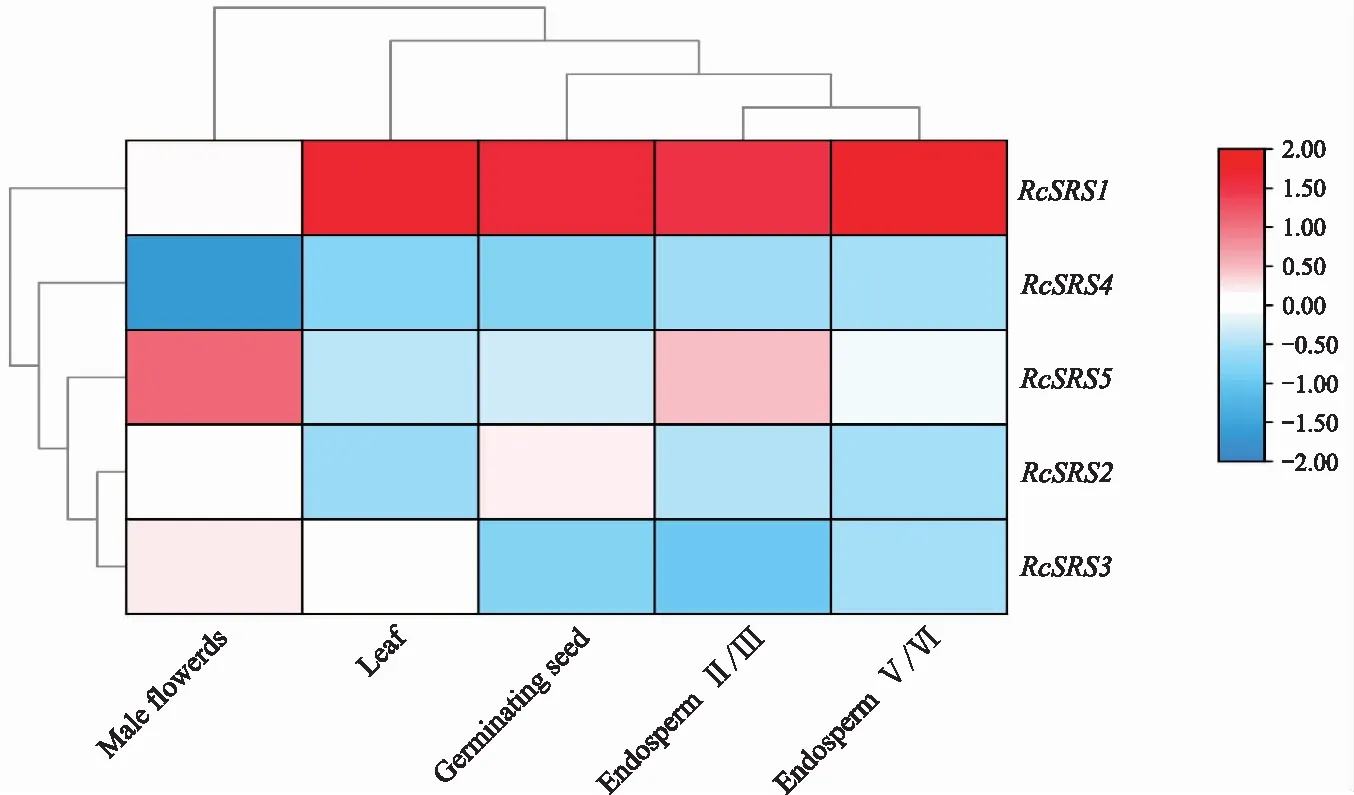
图7 蓖麻RcSRS基因在不同组织器官中的表达分析
2.7.2蓖麻RcSRS家族成员在非生物胁迫下的表达分析
蓖麻RcSRS家族成员的非生物胁迫表达分析(图8)显示,在干旱胁迫和盐胁迫处理下只有4个基因表达,分别是RcSRS1、RcSRS2、RcSRS4、RcSRS5,其中RcSRS5在干旱胁迫和盐胁迫处理下12 h和24 h的表达量较0 h处理下呈上调表达模式。在低温胁迫处理下只有3个基因表达,分别是RcSRS1、RcSRS2、RcSRS3,他们在低温胁迫处理下12 h和24 h的表达量较0 h处理下均呈下调表达模式。综上,RcSRS基因在蓖麻抵御非生物胁迫过程中具有重要作用。
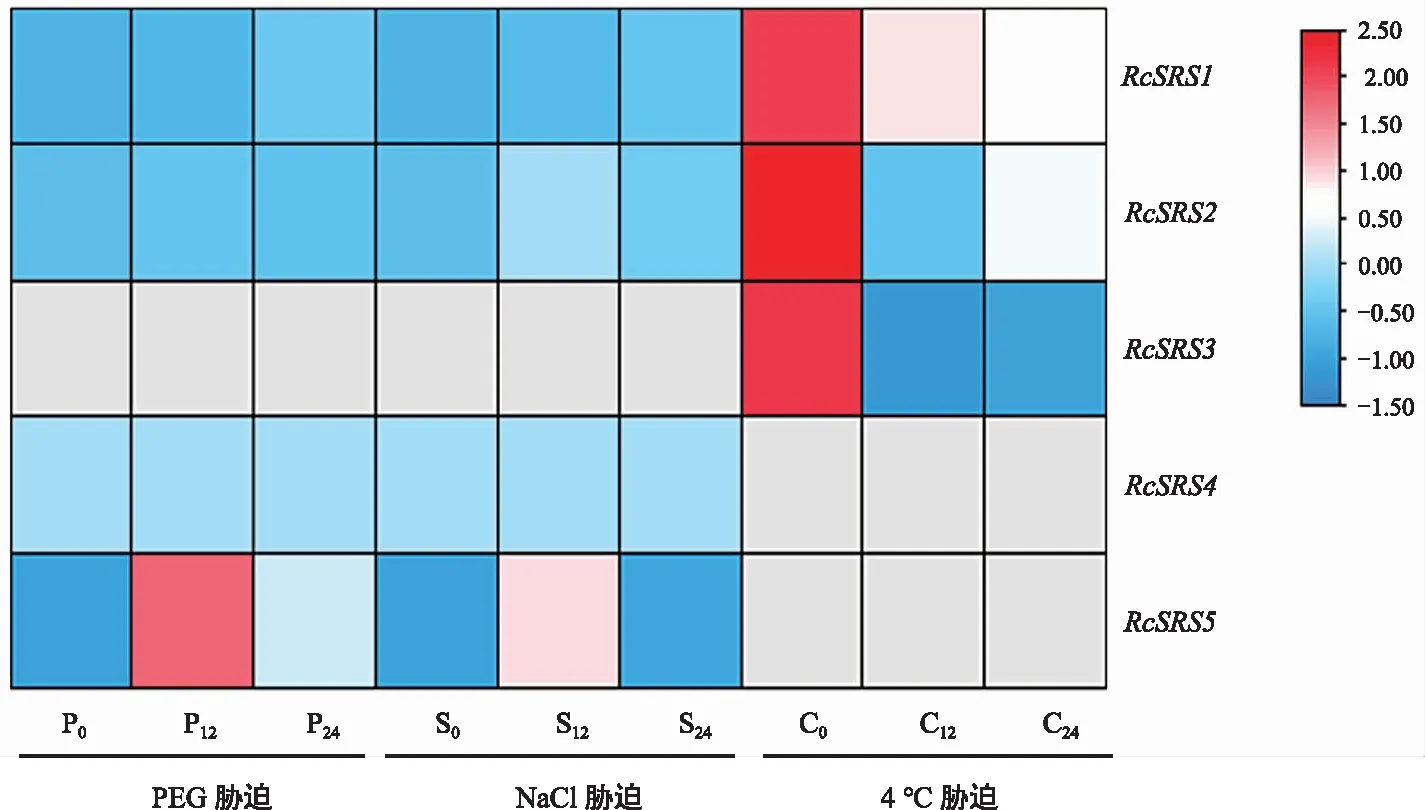
注:0,12和24代表非生物胁迫时长,灰色表示未检测到。
3 讨 论
SRS基因在进化的过程中发生了变化,不同物种中SRS基因的数量不尽相同,在拟南芥[2]、苹果[30]和陆地棉[34-35]中分别含有11,11,27 个成员。本研究在蓖麻中共鉴定到5个RcSRS成员,除RcSRS1之外,其余编码的蛋白质均是不稳定性蛋白;不同的RcSRS家族成员所编码的蛋白质理化性质均存在差异,可以推测出他们在植物体内的功能也不尽相同;对基因结构分析表明,位于同一亚家族的基因家族成员具有相似的基因结构,说明同一类群的成员具有相近的进化关系或功能;对水稻和蓖麻的SRS蛋白质进行发育树分析,结果显示,RcSRS蛋白质成员只在类群Ⅰ和类群Ⅱ,表明该家族在进化过程中较为保守,同一聚类中的成员在进化上同源,在结构上表现出相似性。
He等[36]研究发现,SRS家族在叶和花的生长和发育过程中起着重要的作用。在藜麦(Chenopodiumquinoa)中,除CqSRS08外所有的CqSRSs基因在花中都高表达,CqSRS08则只在叶片中高表达[19]。在拟南芥中,STY1和STY2在花的发育阶段高表达,可以通过调节生长素合成的方式来影响雌蕊的发育,并影响柱头的形成[8,15]。蓖麻RcSRS家族的不同组织和器官中的表达分析发现,RcSRS家族成员主要在叶和花中高表达,这与张雪等[34]和赵坤宇,陈甜甜[35]在棉花中的研究结果相一致。在拟南芥中,SRSs已经被证明在叶和花的生长发育中起到了关键的调控作用[8]。RcSRSs在叶和花中的表达远高于其他组织,表明RcSRS主要参与了叶和花的生长和发育。
Ma等[37]研究表明,在植物抵御非生物胁迫的过程中,SRS家族基因同样起着重要的作用。在苹果中,11个SRS成员在盐胁迫、ABA胁迫下均有明显响应[34]。在白香草木樨(Melilotusalbus)中有39个MaSRS基因含有ABRE作用元件,其与植物耐盐胁迫密切相关,其中MaSRS4和MaSRS32在盐胁迫下相对表达量均高于未处理的植株,在低温胁迫下表达量较低,而MaSRS48在低温下则显著表达[38]。在蓖麻研究中发现,RcSRS1在低温胁迫下下调表达,表明该基因可能在蓖麻抵御低温胁迫的过程中发挥作用,可作为后续研究RcSRS家族基因在蓖麻抵御低温胁迫作用中的候选基因。分析发现RcSRS1在启动子顺式作用元件中含有较多的光响应元件,其在低温胁迫下的下调表达情况可能与之相关,这与李艳肖等[31]的研究结果相一致。综上可以看出,RcSRSs基因能响应非生物胁迫,但其作用机理尚不明确,还待进一步研究。

