基于COX2-PGE2途径探讨盆痛灵对气滞血瘀型EM大鼠的镇痛作用
李宣儒 夏玉 王丽 余思云 刘晓庆 付金荣



【摘要】目的:采用夾尾联合自体移植的方法,建立气滞血瘀型内异症(EM)大鼠模型,探讨盆痛灵方对其的镇痛作用及其机制。方法:EM造模后随机分组,A组(EM造模1周后夹尾),B组(EM造模不夹尾),C组(EM造模1周后夹尾加中药盆痛灵干预),另设假手术组:D组(假手术1周后夹尾),E组(假手术不夹尾)。通过观察大鼠的日常行为特征,测量大鼠不同时间点痛阈,检测大鼠血液流变学指标,对气滞血瘀型EM疼痛模型的模型质量进行评价。测量大鼠给药前后内异灶体积。ELISA检测大鼠雌二醇(E2)与前列腺素E2(PGE2)水平,免疫组化、RT-qPCR检测大鼠环氧合酶-2(COX-2)蛋白和COX-2mRNA的表达。结果:A组(EM+夹尾)、D组(假手术+夹尾)夹尾造模后舌色瘀紫,暴躁易怒。A组(EM+夹尾)与B组(EM不夹尾)比较, D组(假手术+夹尾)与E组(假手术不夹尾)比较:其他条件相同时,进行夹尾造模的组痛阈更低(P<0.05),血液流变学水平上升(P<0.05), COX-2蛋白,COX-2mRNA和E2,PGE2表达增高(A:P<0.05,P<0.001,P<0.001,P<0.01/ D:P<0.01,P<0.01, P<0.001,P<0.001)。C组(EM+夹尾+中药)治疗后舌色淡粉,性格温和。与A组(EM+夹尾+生理盐水)比较,其内异灶缩小(P<0.001);给药4周后痛阈升高(P<0.001);血液流变学水平下降(P<0.05);COX-2蛋白,COX-2mRNA和E2,PGE2表达降低(P<0.001,P<0.01,P<0.001,P<0.001)。结论:采用夹尾联合自体移植可成功制造气滞血瘀型EM大鼠疼痛模型,通过大鼠行为学特征,血液流变学,痛阈三方面对模型质量进行评价。盆痛灵方能改变大鼠行为学特征,缩小内异灶体积,改善血液流变学水平,提高痛阈值,其作用机理为通过抑制大鼠体内COX-2,PGE2和E2的表达水平,从而起到镇痛作用。
【关键词】盆痛灵方;气滞血瘀;E2;COX-2;PGE2
【中图分类号】R285.5【文献标志码】 A【文章编号】1007-8517(2023)18-0012-07
DOI:10.3969/j.issn.1007-8517.2023.18.zgmzmjyyzz202318004
Study on the Analgesic Effect of Pentongling Formula on Rats with EM of Qi Stagnation and
Blood Stasis Syndrome Based on COX2-PGE2 PathwayLI Xuanru XIA Yu WANG Li YU Siyun LIU Xiaoqing FU Jinrong
1.Longhua Clinical Medical College,Shanghai University of Traditional Chinese Medicine,Shanghai 200032,China;
2.Shanghai Ninth Peoples Hospital,Shanghai JiaoTong Univesity School of Medicine,Shanghai 200011,China;
3.Department of Gynecology,Longhua Hospital,Shanghai University of Traditional Chinese Medicine,Shanghai 200032,ChinaAbstract:Objective The rat model of endometriosis (EM) with qi stagnation and blood stasis was established by tail clamping combined with autotransplantation, and the analgesic effect and mechanism of Pentongling Recipe were discussed. Methods After EM modeling, they were randomly divided into A group (EM modeling with tail clamping after one week), B group (EM modeling without tail clamping) and C group (tail clipping after one week of EM modeling,and treat with traditional Chinese medicine). Set up sham operation group: D group (sham operation with tail clipping) and E group (sham operation without tail clipping). By observing the daily behavior characteristics of rats, measuring the pain threshold of rats at different time points, and detecting the hemorheology indexes of rats, the model quality of endometriosis pain model with qi stagnation and blood stasis was evaluated. The volume of endometriosis foci in rats was measured before and after administration.The levels of estradiol (E2) and prostaglandin E2(PGE2) in rats were detected by ELISA, and the expressions of cyclooxygenase-2(COX-2) protein and COX-2mRNA in rats were detected by immunohistochemistry and RT-qPCR.Results Group A (EM+tail clipping) and group D (sham operation+tail clipping) had purple tongue color and irritability after tail clipping. Compared with group A (EM+tail clipping)and group B(EM without tail clipping),group D (sham operation+tail clipping) and group E (sham operation without tail clipping),the pain threshold of the model group with tail clipping was lower when other conditions were the same (P<0.05),the level of hemorheology increased(P<0.05), the expression of COX-2 protein,COX-2mRNA,E2 and PGE2 increased (A: P<0.05, P<0.001,P<0.001, P<0.01/ D:P<0.01, P<0.01, P<0.001, P<0.001).Group C (EM+tail clipping+traditional Chinese medicine) had light pink tongue and mild personality after treatment. Compared with group A (EM+tail clipping+normal saline),its ectopic focus volume were smaller(P<0.001);Pain threshold increased after 4 weeks (P<0.001).The level of hemorheology decreased (P<0.05);The expression of COX-2 protein,COX-2mRNA,E2 and PGE2 decreased(P<0.001,P<0.01,P<0.001,P<0.001).Conclusion The pain model of EM rats with qi stagnation and blood stasis can be successfully made by autologous intimal transplantation combined with tail clamping method. The model quality was evaluated by behavioral characteristics, hemorheology and pain threshold of rats. Pentongling recipe can change the behavioral characteristics of rats, reduce the volume of endometriosis foci, improve the level of hemorheology, and increase the pain threshold. Its mechanism is to relieve pain by inhibiting the expression levels of COX-2, PGE2 and E2 in rats.
Keywords:Pentongling Formula;Qi Stagnation and Blood Stasis;E2;COX-2;PGE2
子宫内膜异位症(endometriosis,EM)是妇科常见的疑难杂症,在全世界育龄期妇女中占10%,是导致痛经和慢性盆腔疼痛的主要原因之一[1]。其反复发作的疼痛严重影响女性的身心健康,使部分患者出现抑郁焦虑倾向,故如何缓解患者的疼痛,提高患者生活质量已成为临床治疗EM的关键。课题组前期研究[2]证实盆痛灵可以缓解EM大鼠的疼痛,本研究在前期EM造模的基础上加入夹尾,建立病证结合的气滞血瘀型EM大鼠疼痛模型,以进一步探究盆痛灵对气滞血瘀型EM大鼠的镇痛作用及其机制。
1材料与方法
1.1动物9周龄清洁级SD雌性大鼠,规格为(180±20)g,购自北京维通利华实验动物有限公司,合格证号:SCXK(浙)2019-0001,动物实验严格遵守上海中医药大学实验动物伦理委员会的要求(No.PZSHUTCM201106008)。
1.2药物盆痛灵颗粒剂(三棱,莪术,延胡索,川楝子,虎杖),龙华医院中药房提供,符合质检标准。按成年人体重为50 kg计算,每日生药量为51 g,SD大鼠按人体每日用药量的6.25倍进行换算,故每日给药量为6.375 g·kg·d。
1.3主要试剂和仪器试剂:反转录试剂盒PrimeScript RT reagent Kit(批号:RR037A,TaKaRa公司),熒光定量PCR试剂盒 TB Green® Premix Ex Taq(批号:RR420A,TaKaRa公司),辣根过氧化物酶标记山羊抗兔IgG(H+L)(批号:A0208,碧云天), Cox2(D5H5)XP® Rabbit mAb#12282(批号:12282S,CST),Trizol(批号:G8011-100mL,Adamas life),大鼠前列腺素E2(PGE2)酶联免疫分析(批号:MM-0068R1,酶免),大鼠雌二醇(E2)酶联免疫(批号:MM-0575R1,酶免)。仪器:VonFrey纤维丝(型号:NC12775-99,NorthCoast),全自动血流变测试仪(型号:ZL9100C,北京众驰伟业科技发展有限公司),PCR基因扩增仪(型号:PROFLEX,赛默飞),实时荧光定量基因扩增仪(型号:7500,赛默飞),低温高速离心机(型号:Centrifuge 5810 R,Eppendorf),酶标仪(型号:Synergy H1,BioTek Instruments,Inc.)等。
1.4分组、造模和给药方法通过自体内膜种植法[3]对大鼠进行EM造模,取造模成功的30只大鼠,随机分成A组(EM造模1周后夹尾),B组(EM造模不夹尾)和C组(EM造模1周后夹尾加中药盆痛灵干预)。另设假手术组(结扎后剪下单侧的一段子宫,不进行内膜种植)20只:随机抽取10只作为D组(假手术1周后夹尾),剩余10只为E组(假手术不夹尾)。
在开腹造模1周后,大鼠腹部伤口基本愈合,开始对A组、C组和D组进行夹尾造模:用纱布包裹书夹(纱布是为了控制书夹力度,防止大鼠尾部皮肤受损),夹住大鼠的尾部,大鼠被夹后情绪暴躁,会与其他大鼠发生打斗,此时可以把书夹松开,每次刺激30 min,每日2次,持续刺激3周[4]。
2周后各组大鼠进行二次开腹,EM模型大鼠内异灶向上凸起且内含透亮液体视为造模成功。夹尾造模的大鼠通过观察其行为学特征(舌紫,暴躁等气滞血瘀之象),血液流变学(升高)和痛阈(变小)的变化判断其模型质量。
所有大鼠均采用直肠给药,A组、B组、D组、E组给予1 mL 0.9%生理盐水。C组给予盆痛灵,按照《药理实验方法学》[5]换算,剂量为每日6.375 g·kg(临床等效量),配成1 mL药液。各组大鼠灌肠均每次1 mL,每日1次,持续4周。末次给药后,采集大鼠血液、腹腔液、子宫内膜组织。
2检测指标及方法
2.1痛阈测量搭建老鼠足底触觉痛觉测试凿孔台,该设备分为凿孔台和鼠笼。大鼠放于鼠笼适应环境30 min,按照Dixon的“up&down”法,使用VonFrey纤维丝从2.0 g的力度开始刺激大鼠脚掌中部的皮肤,观察大鼠是否有缩足舔爪等躲避反应,并进行记录[6]。如大鼠无反应为阴性反应(记为“o”),使用大一级的纤维丝继续刺激。大鼠出现缩足为阳性反应(记为“x”),使用小一级力度的纤维继续刺激。当大鼠阴性反应和阳性反应(“ox”或“xo”)交替出现时,再连续往后测 4 次,得到一串以“o”和“x”组合而成的序列,以该序列和最后一根纤维丝的刺激力规格,计算得出痛阈。测量时间为各组大鼠造模前(术前痛阈,术D0),以及二次开腹术后第 1天、第 3天、第 5天 、第 7天 、第14天、第21天和第28天(术D1、术D3、术D5、术D7、术D14、术D21、术D28)。
2.2内异灶体积测量游标卡尺测量内异灶的最大横径,和与之垂直的纵径,计算体积。
2.3血液流变学检测腹主动脉取血4 mL,放入肝素抗凝负压采血管中,采用全自动血流变测试仪检测凝血四项。
2.4免疫组化检测子宫内膜组织中COX-2蛋白的表达对大鼠子宫内膜组织进行包埋,切片,脱蜡复水,抗原修复,血清封闭。加一抗,湿盒4 ℃孵育过夜。加二抗,湿盒37 ℃内孵育45 min。DAB显色,苏木精复染,盐酸乙醇分化,梯度乙醇脱水,二甲苯透明,中性树胶封片,显微镜下观察及拍片,每张切片拍摄5个视野(x200),使用Image-pro软件对COX-2蛋白进行积分光密度(IOD)的计算。
2.5ELISA检测腹腔液中E2、PGE2的水平取大鼠腹腔液,配置试剂备用。在待测样品孔中加样品稀释液40 μL,再加待测样品10 μL。混匀,除空白孔外每孔加入酶标试剂100 μL,贴封板膜,37 ℃孵育60 min。弃去孔内液体,甩干,加洗涤液洗涤5次,拍干。每孔先加入显色剂A50 μL,再加入显色剂B50 μL,混匀,37 ℃避光显色15 min。加终止液50 μL,以空白孔调零,450 nm波长测量各孔的OD值。
2.6RT-qPCR检测子宫内膜组织中COX-2mRNA的表达50 mg大鼠组织加入1 mLTrizol,冰上静置,加入氯仿,离心,加入等体积预冷的异丙醇,离心,加入等体积乙醇洗涤,离心,溶解于DEPC水中,以紫外分光光度计测其浓度和OD260/OD280、OD260/OD230。使用反转录试剂盒PrimeScriptT RT reagent Kit合成cDNA,β-actin作为内参,扩增引物由生工生物工程合成,引物序列见表1,使用荧光定量PCR试剂盒TB Green® Premix Ex TaqTM进行实时荧光定量PCR。每组设3个复孔,采用2-的方法计算其COX-2mRNA表达量。
2.7统计学分析使用SPSS 26.0版本进行统计分析,当数据为计量资料时,如满足正态性和方差齐性,以均数加减标准差(x±s)进行描述,两组间比较使用两独立样本t检验,多组间比较用单因素方差分析,进一步两两组间比较使用SNK检验。满足正态分布但方差不齐时,使用校正t检验。不满足正态分布且方差不齐时,使用非参数检验。双变量均满足正态分布时,相关性分析采用Pearson法检验,双变量不符合正态分布时,相关性分析采用Spearman法检验。均采用双侧检验,当P≤0.05时,表示差异有统计学意义。
3结果
3.1气滞血瘀型疼痛模型大鼠的行为学特征A组与D组爪甲舌色瘀紫,耳缘发紫,尾部有暗紫色瘀斑,眼睛突出,暴躁易怒,攻击性强,易激惹[7],体型偏瘦,食少,饮水多。C组用药后4周爪甲舌色呈粉红色,性情温和,体型圆润,B组与E组无明显特征。
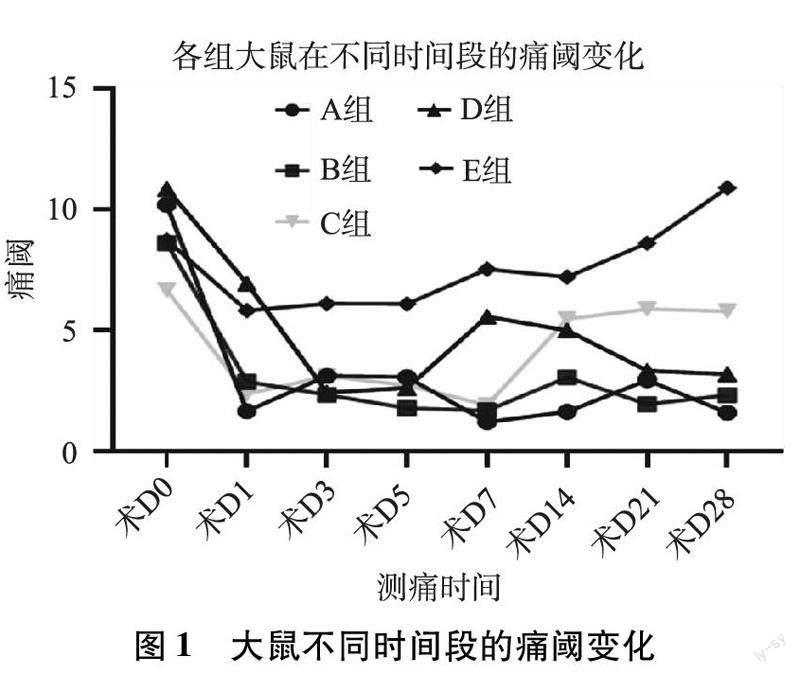
3.2大鼠不同时间段的痛阈变化各组大鼠术D痛阈无统计学差异(P>0.10)。E组术D、术D与术D的痛阈无统计学差异(P>0.05),可证明假手术造模和生理盐水灌肠对痛阈无影响。B组术D痛阈小于E组(P<0.05),可证明EM造模可降低大鼠痛阈,使大鼠的疼痛敏感度升高。D组术D痛阈小于E组(P<0.05),提示单纯夹尾也可以降低大鼠痛阈,提高大鼠疼痛敏感度。D组术D痛阈大于B组(P<0.05),说明EM造模降低痛阈的效果高于夹尾。A组术D痛阈小于D组(P<0.01)与B组(P<0.05),提示相较于单纯的夹尾或EM造模,夹尾联合EM造模降低大鼠痛阈的效果最好。A组术D痛阈与术D无统计学差异(P>0.50),小于B组术D(P<0.05);D组术D痛阈与术D无统计学差异(P>0.05),小于E组术D(P<0.001),术D时夹尾造模已停止2周,痛阈仍持续下降,说明该造模具有持续性。C组术D大于A组术D(P<0.001),提示盆痛灵可治疗气滞血瘀型EM。见表2。
如图1,E组和C组在术后先下降,后逐渐上升,高于其他3组。D组在术后先下降,后缓慢上升,又在气滞血瘀的造模过程中下降。A组和B组术后基本呈下降趋勢,前者整体较后者更低。
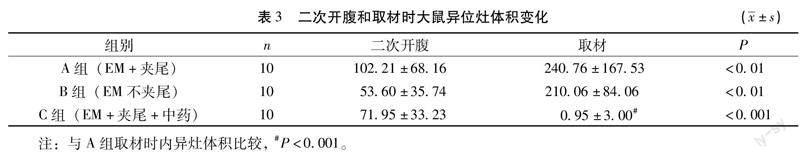
3.3盆痛灵对大鼠异位灶体积的影响如表3,A组、B组在二次开腹时的异位灶体积小于其取材时(P<0.01),提示此两组异位灶体积随着时间变化逐渐增大,生理盐水灌肠无治疗作用。C组在二次开腹时的异位灶体积大于其取材时(P<0.001),小于A组取材时(P<0.001),提示盆痛灵可缩小异位灶体积。
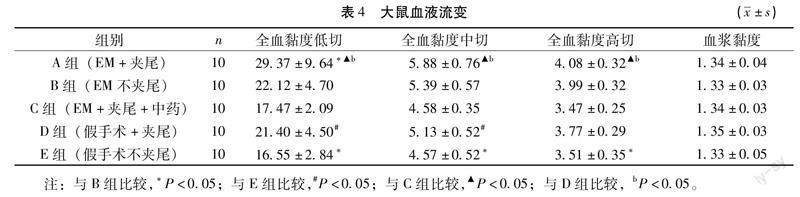
3.4大鼠血液流变学变化如表4,B组全血黏度低、中、高切大于E组(P<0.05),提示大鼠经EM造模后血液黏度变高。A组全血黏度低切大于B组(P<0.05),D组全血黏度低、中切大于E组(P<0.05),提示大鼠经过夹尾造模后,红细胞聚集性变高,血液黏度变高。D组全血黏度低、中、高切小于A组(P<0.05),与B组无统计学差异(P>0.05),提示夹尾联合EM造模相较于单纯的EM造模或夹尾,可以进一步提高大鼠血液黏度。C组全血黏度低、中、高切小于A组(P<0.05),全血黏度低、中、高切和血浆黏度均与E组无统计学差异(P>0.10),提示盆痛灵可以改善气滞血瘀型EM大鼠的血液黏滞程度。
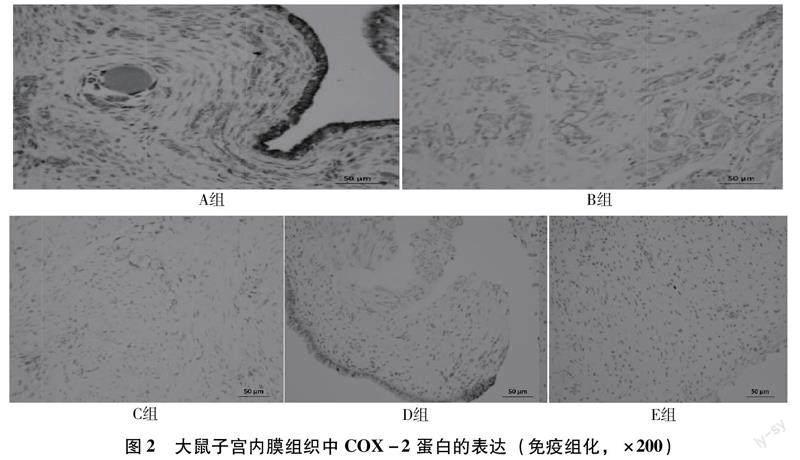
3.5免疫组化检测大鼠子宫内膜组织中COX-2蛋白的表达COX-2主要在大鼠异位子宫内膜组织的腺上皮细胞与间质细胞的胞浆中进行表达,在正常子宫内膜上表达较弱。它在A组表达最为明显,B组其次,在D组的阳性表达较前两者减弱,在C组和E组里基本无明显阳性表达,如图2所示。
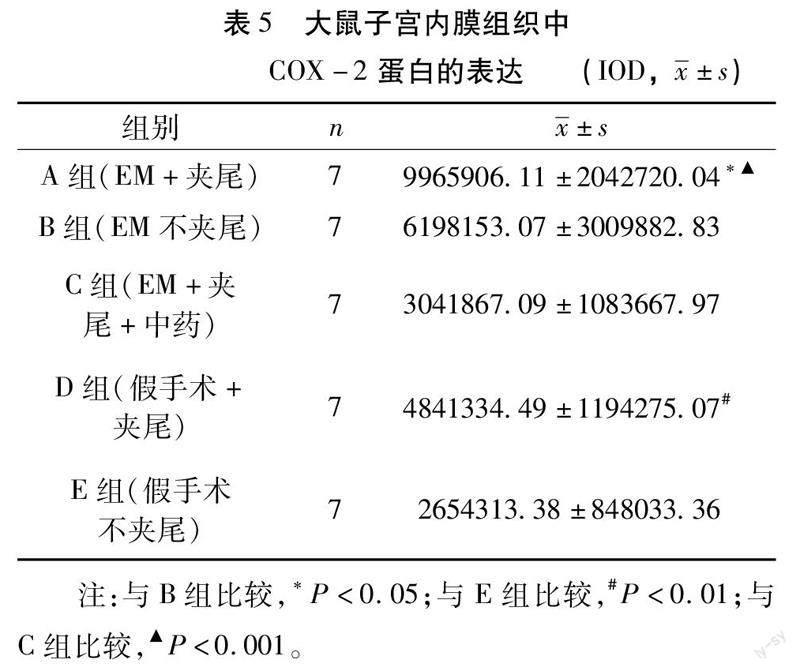
如表5,A组的COX-2蛋白表达高于B组(P<0.05),D组高于E组(P<0.01),提示经过夹尾造模后,大鼠子宫内膜组织中COX-2蛋白的表达水平升高。C组和E组无统计学差异(P>0.05),低于A组(P<0.001),提示盆痛灵可以降低COX-2蛋白表达水平。
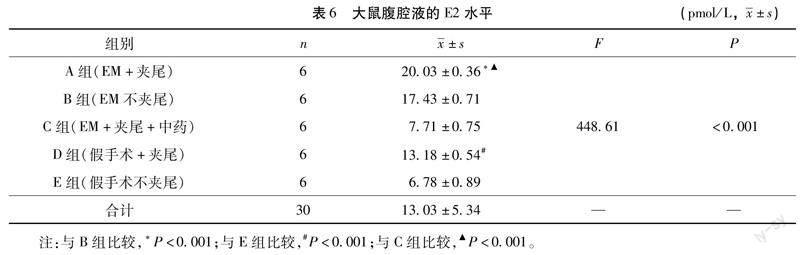
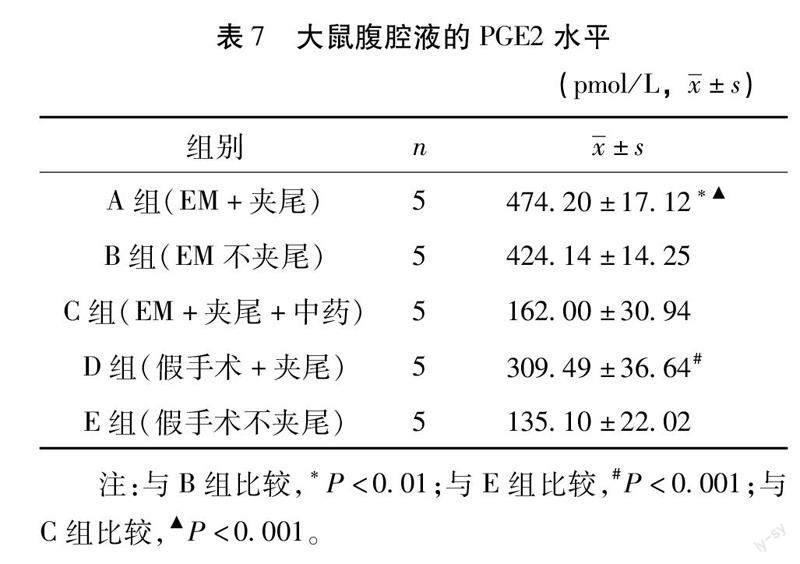
3.6ELISA检测大鼠腹腔液中E2,PGE2的水平如表6与表7,A组高于B组(E2:P<0.001;PGE2:P<0.01),D组高于E组(P<0.001),提示经过夹尾造模后,大鼠E2,PGE2水平增高。C组和E组无统计学差异(E2:P>0.05;PGE2:P>0.5),低于A组(P<0.001),提示盆痛灵可降低气滞血瘀型EM大鼠的E2,PGE2水平。
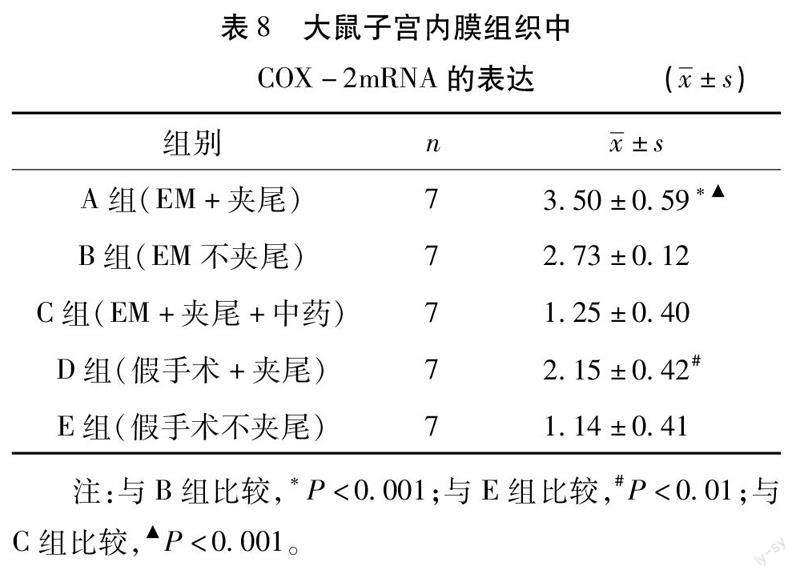
3.7RT-qPCR检测大鼠子宫内膜组织中COX-2mRNA的表达见表8,A组的COX-2 mRNA大于B组(P<0.001),D组的COX-2 mRNA高于E组(P<0.01),提示经过夹尾造模后,大鼠COX-2 mRNA表达升高。C组与E组无统计学差异(P>0.05),低于A组(P<0.01),证明盆痛灵可降低气滞血瘀型EM大鼠COX-2 mRNA表达水平。
3.8各检测指标与痛阈的相关性分析见表9,COX-2蛋白、COX-2 mRNA、E2和PGE2的表达水平与痛阈之间均存在显著相关及负相关关系,表明COX-2蛋白、COX-2 mRNA、E2和PGE2的表达水平越高,大鼠痛阈越低,疼痛越严重。
4讨论
目前临床上尚无能彻底治愈EM的药物,故人们一直致力于新药物的研发。疼痛是EM最主要的症状,构建符合EM临床发病特点的动物模型是药物研发的基础,所以创建理想的EM疼痛动物模型是值得关注的问题。
当前EM模型多着重于EM疾病本身,尚未见有针对EM疼痛的模型报道。课题组前期研究[2]已证实通过自体内膜移植可成功建造EM模型大鼠。本研究在前期研究基础上首次加入夹尾,建立病证结合的气滞血瘀型EM大鼠疼痛模型, 通过机械测痛,检测血液流变和观察行为学特征对该模型质量进行评价。该疼痛模型在西医理论复制疾病模型的基础上,运用中医理论构建证候模型的方法加重大鼠疼痛度,旨在为EM疼痛防治研究提供稳定性高,重复性好且与临床实际更吻合的动物模型。
本研究中,夹尾后的大鼠爪、甲、舌、耳,尾部的颜色发紫,且伴有眼突,暴躁易激,是持续疼痛导致的气滞血瘀之象;比较各组痛阈,与单纯夹尾或EM造模相比,夹尾联合EM造模的大鼠痛阈最低,说明夹尾作为一种辅助手段,联合EM造模可最大程度降低大鼠痛阈,增高其痛觉敏感度;比较各组血液流变学,夹尾联合EM造模的大鼠全血黏度上升程度最高,提示大鼠红细胞聚集性变高,红细胞积聚形成血瘀,使血液黏度变高[9],符合气滞血瘀状态。该模型夹尾造模结束于术D14,血液流变水平和痛阈(术D28)的结果均是在夹尾造模停止2周后测得的,说明其气滞血瘀状态具有持续性,不会随物理刺激的停止而消失,故具有一定推广性。
有研究证实,COX-2与PGE2在EM中与疼痛呈正相关。COX-2通过生成PGE2,参与炎症反应,加重EM的疼痛[10-11]。PGE2升高可加速E2的合成[12],E2可介导ERβ上调COX-2表达,而COX-2又刺激炎性介质PGE2产生[13-14],三者相互作用,使EM患者感到疼痛。
观察各组COX-2蛋白、COX-2 mRNA、E2和PGE2表达水平及各指标与痛阈的相关性分析可发现:夹尾后大鼠各项指标表达皆有上升,痛阈变低,疼痛程度加重,其中夹尾联合EM造模的大鼠各指标表达水平最高,痛阈最低。使用盆痛灵治疗后,大鼠各项指标表达皆下降,痛阈变高,疼痛得到缓解。
盆痛灵方由三棱、莪术、虎杖、延胡索和川楝子组成,具活血行气、祛湿止痛之功[15-16]。前期研究[17]表明盆痛灵可缓解EM盆腔疼痛,本实验大鼠治疗后,爪甲舌色呈粉红,性温体圆;血液流变水平下降;内异灶缩小;痛阈升高,大鼠疼痛得到缓解,盆痛灵方的作用机理可能是通过COX2-PGE2信号通路,抑制PGE2的表达水平,从而起到镇痛作用。参考文献
[1]中国医师协会妇产科医师分会,中华医学会妇产科学分会子宫内膜异位症协作组.子宫内膜异位症诊治指南(第三版)[J]. 中华妇产科杂志,2021,56(12):812-824.
[2]付金荣,朱姗,徐英,等.盆痛灵灌肠对子宫内膜异位症模型大鼠疼痛行为的影响及其机理探讨[J].中医药学报,2020,48(1):17-21.
[3]BERKLEY K J,DMITRIEVA N,CURTIS K S,et al. Innervation of ectopic endometrium in a rat model of endometriosis[J]. Proc Natl Acad Sci USA,2004,101(30):11094-11098.
[4]王婷婷,贾乘,陈宇,等.大鼠气滞血瘀证模型的建立及影响因素分析[J].中国中药杂志,2012,37(11):1629-1633.
[5]徐叔云,卞如濂,陈修.药理实验方法学[M].3版.北京:人民卫生出版社,2002:202-203.
[6]范成雷. BoNT/A关节腔注射对佐剂性关节炎疼痛大鼠背根神经节中TRPV1表达的影响[D].青岛:青岛大学,2017.
[7]郑跃,刘丽,刘建秋.气滞血瘀型慢性输卵管炎症大鼠模型的建立與评价[J].中国比较医学杂志,2019,29(2):58-65,83.
[8]刘楠,姜云耀,李莹,等.气滞血瘀证动物模型研究现状[J].中国实验方剂学杂志,2018,24(1):217-226.
[9]凌爽,毕悦,李孟,等.补阳还五汤对气虚血瘀模型大鼠血液流变学的影响[J].中医药信息,2021,38(4):29-32.
[10]汪逸纯,张真真,万贵平.子宫内膜异位症致疼痛的发生机制及治疗方法研究进展[J].中国医药科学,2021,11(4):39-42.
[11]ZIDAN H E, REZK N A, ALNEMR A A, et al. COX-2 gene promoter DNAmethylation status in eutopic and ectopic endometrium of Egyptianwomen with endometriosis[J]. J Reprod Immunol,2015(112):63-67.
[12]齐之迎,尹利荣.子宫内膜异位症盆腔痛患者血清雌二醇与TNF-α水平变化的研究[J].天津医药,2014,42(2):138-140.
[13]GONALVES R M,DELGOBO M,AGNES J P,et al. COX-2 promotes mammary adipose tissue inflammation, local estrogen biosynthesis, and carcinogenesis in high-sugar/fat diet treated mice[J].Cancer Lett,2021(502):44-57.
[14]ZHEN L Z,LI Y H,YAO H S, et al. Cyclooxygenase-2 in Endometriosis[J].Int J Biol Sci,2019,15:2783-2797.
[15]徐英,付金荣,沈宇凤,等.盆痛灵方对子宫内膜异位症大鼠神经生长因子及其受体表达的影响[J].上海中医药大学学报,2019,33(6):44-49.
[16]章仕雯,付金荣,徐英,等.盆痛灵方对子宫内膜异位症模型大鼠镇痛作用机制的研究[J].中国中西医结合杂志,2021,41(12):1461-1467.
[17]徐英.基于神经生长因子探讨盆痛灵方对子宫内膜异位症大鼠疼痛的镇痛作用机理[D].上海:上海中医药大学,2020.
(收稿日期:2023-01-12编辑:刘斌)

