蛋黄蛋白肽纳米颗粒对姜黄素的包埋与递送特性
梅钰琪,高亚轩,杨韵仪,杜振亚,万芝力,杨晓泉
(华南理工大学食品科学与工程学院,食物蛋白与胶体研究中心,广东省天然产物绿色加工与产品安全重点实验室,广东 广州 510640)
姜黄素(curcumin,Cur)是一种主要存在于姜黄属植物根茎中的天然二酮类化合物,具有多种生理功能,如抗菌、抗炎、抗氧化、清除自由基、保护心血管和抗癌等,因此被广泛用于功能性食品的开发[1-5]。功能性食品中生物活性物质的有效性取决于其溶解性、稳定性、吸收和生物利用度[2],而Cur的溶解性较差,很难被小肠上皮细胞直接吸收,且其疏水性会导致其被外排系统排出,难以发挥应有的药理效应[6]。此外,Cur分子的双酮结构易发生互变异构,酚羟基则极易参与自由基反应,导致其分子结构在光、温度、湿度等外界环境因素的影响下发生变化和降解[7]。以上问题极大地限制了Cur在医药、功能性食品和常规食品中的加工和应用。为了提高Cur的溶解性,同时实现Cur在制备、储存和使用过程中活性的长期稳定,研究人员采取了多种措施,包括包封技术、纳米技术、化学修饰等手段[1,8-9]。相对于Cur的化学修饰,通过物理包埋构建的纳米递送体系具有绿色、安全的优势,在医药、食品加工领域中具有更广泛的应用前景。
在过去的几十年里,由于蛋白基纳米颗粒无毒、可生物降解以及良好的生物相容性,被公认为是一种理想的递送系统[10-12]。蛋白质是否可用于构建蛋白基纳米载体,主要取决于其自身部分活性基团能否同生物活性物质通过非共价相互作用与Cur结合形成Cur纳米颗粒,进而达到对疏水性活性物质输送的目的[5,13]。到目前为止,已有广泛的研究以食源性蛋白质作为载体制备复合Cur纳米颗粒提高其水溶性和生物利用度,包括酪蛋白、乳清蛋白和大豆蛋白等水溶性蛋白,以及玉米醇溶蛋白、小麦醇溶蛋白等水不溶性蛋白[1,11,13-16]。蛋白基纳米颗粒可以通过反溶剂沉淀和化学交联等多种方法制备,但该过程涉及危险化学剂或有机溶剂的使用,在一定程度上限制了其在食品工业中的应用[17]。为了解决这一问题,有研究人员基于蛋白自组装策略来制备Cur纳米颗粒。蛋白质或亚基的自组装过程受pH值、温度、离子强度、浓度、溶剂介电常数等因素的影响,其自组装形成各种有序纳米结构是一个热力学平衡过程,这是各种吸引和排斥相互作用之间微妙平衡的结果[14,18]。Pan Kang等[14]将Cur晶体溶解于pH 12.0的溶液,然后加入到质量分数2%酪蛋白酸钠溶液中,强碱可以使酪蛋白酸钠胶束解离,在搅拌过程中酪蛋白酸钠的疏水性基团与Cur结合,再调节pH值至中性,解离的酪蛋白酸钠又重新自组装,形成复合纳米颗粒。Wang Yuexi等[18]利用自组装策略并以蛋清蛋白作为载体制备复合黄素纳米颗粒,提高了Cur的水溶性、抗氧化能力及热稳定性。
蛋黄富含蛋白质和磷脂等活性物质,具有优良的油-水界面吸附能力和乳状液的抗聚结能力,促使其广泛应用于蛋黄酱、沙拉酱和烘焙食品中[19-21]。蛋黄蛋白中非极性氨基酸和芳香氨基酸含量较高,占总氨基酸组成的40.63%,蛋白质C端含有芳香氨基酸或者序列中含有疏水性氨基酸的肽可能具有较高的两亲性自组装能力和界面活性[22]。工业萃取脱磷脂和蛋黄油之后剩下的脱脂蛋黄粉蛋白含量较高,质量分数在50%~80%之间,但功能性质极差,几乎不溶于水,无法直接应用于食品工业。当前研究主要集中在利用蛋白酶水解将脱脂蛋黄粉转换为生物活性肽,研究其抗氧化、降血压、抗癌等生理功能[19,23-25],而关于其胶体特性的研究比较匮乏。本课题组前期研究证实了通过定向限制性酶解获得的蛋黄蛋白肽(egg yolk peptide,EYP)可通过两亲性自组装形成平均粒径为25 nm的球形胶束状纳米颗粒,并将其作为界面稳定剂制备出粒径小于200 nm的皮克林纳米乳液[26]。但目前还鲜见利用两亲性EYP来构建生物活性物质(如Cur)纳米输送体系的研究报道。在前期研究基础上,本研究继续利用胰蛋白酶水解脱脂蛋黄粉,得到的两亲性EYP在水相中可通过疏水相互作用自组装成EYP胶束状纳米颗粒(egg yolk peptide micellar nanoparticles,EYPNs),通过调节pH值控制EYPNs的自组装行为,进而构建EYPNs复合Cur纳米颗粒输送体系,以期扩大脱脂蛋黄粉在功能性纳米胶体领域的应用范围。
1 材料与方法
1.1 材料与试剂
蛋黄蛋白(蛋白质量分数90.7%)由广州白云山汉方现代药业有限公司提供的脱脂蛋黄粉(蛋白质量分数80.4%)通过交替3 次水洗(1∶5,m/V)和无水乙醇洗(1∶5,m/V)后冻干得到。
胰蛋白酶(250 U/mg) 上海阿拉丁生化科技股份有限公司;Cur(生物试剂,纯度98%) 上海源叶生物科技有限公司;预染中等分子质量标准蛋白Marker(10~180 kDa) 上海升正公司;预染超低分子质量蛋白质Marker(3.3~31.0 kDa) 北京索莱宝科技有限公司;尼罗红和芘荧光探针(纯度>99%) 美国Sigma-Aldrich公司;其他试剂均为国产分析纯;实验用水为超纯水。
1.2 仪器与设备
DELTA冷冻干燥机 德国Christ公司;L-8900全自动氨基酸分析仪、F-7000荧光分光光度计 日本Hitachi公司;Genesys 10S紫外分光光度计 美国Thermo公司;Minn-Sub Cell蛋白电泳仪 美国Bio-Rad公司;Nicolet Avatar 360傅里叶变换红外光谱仪、原子力显微镜(atomic force microscope,AFM) 德国Bruker公司;X’pert Powde多位自动进样X射线衍射仪(X-ray diffractometer,XRD) 荷兰PANalytical公司;OCA20视频光学接触角测量仪 德国Dataphysics公司;Nano-ZS Zeta纳米粒度仪 英国Malvern公司;SAXSess/PW3830小角度静态光散射检测器 美国Viscotek公司;JEM-2100F透射电子显微镜、JFC-1200场发射扫描电子显微镜(field emission-scanning electron microscope,FESEM) 日本JEOL公司;TANKPE060纯水机 法国Millipore公司。
1.3 方法
1.3.1 EYPNs的制备
根据Du Zhenya等的方法[26]制备EYPNs。将1.1节中制得的蛋黄蛋白分散于去离子水中获得质量分数为4%的蛋白悬浮液,使用1 mol/L的NaOH溶液调节pH值至8.0。加入1%(以蛋白质量计)的胰蛋白酶,在40 ℃水浴锅中搅拌2 h以充分水解,期间保持pH 8.0不变,酶解结束后调节pH值至7.0并沸水浴15 min以灭酶。水解样品在8 000×g转速下离心20 min,所得上清液过膜(0.65 μm)后,在4 ℃下透析(截留分子质量100 Da)48 h。最后,将样品冷冻干燥并置于-20 ℃保存备用。由于EYP在水相中具有很强的自组装能力,当EYP的质量浓度高于其临界胶束质量浓度(约0.1 mg/mL)时,就可以自组装形成胶束EYPNs。
1.3.2 EYPNs-Cur的制备
通过pH值诱导共组装法制备EYPNs-Cur。配制不同质量分数(0.5%、1.0%、2.0%、3.0%、4.0 %)的EYPNs溶液,搅拌2 h后置于4 ℃冰箱水化过夜。使用2 mol/L的NaOH溶液调节pH值至12.0,加入一定量的Cur粉末,使其质量浓度为0.5 mg/mL,在避光条件下剧烈搅拌使Cur完全溶解,然后使用2 mol/L的HCl溶液将pH值调至7.0。在10 000 r/min下离心20 min除去不溶性颗粒后,将上清液通过0.45 μm的微孔滤膜进一步除去杂质,将其储存于4 ℃冰箱或冻干成粉状以供后续使用。在相同条件下配制单独的0.5 mg/mL Cur溶液作为对照。
1.3.3 Cur的溶解度及包埋率测定
使用紫外分光光度法测定Cur的质量浓度及其包埋率。首先测定一系列质量浓度Cur标准品-无水乙醇溶液在426 nm波长处的吸光度,得到Cur的标准曲线方程为Y=6.227 7X+0.004 5(R2=0.999)。吸取一定体积的EYPNs-Cur溶液于离心管中,加入5 倍体积的无水乙醇以萃取Cur,在涡旋器上充分振荡后离心(10 000 r/min、20 min)。所得上清液经无水乙醇适度稀释后测定其426 nm波长处吸光度,以无水乙醇作为空白,对照组使用去离子水为空白。Cur溶解度用上清液中Cur的质量浓度表示。包埋率采用公式(1)计算。
式中:m为上清液中Cur质量/g;m0为Cur初始质量/g。
1.3.4 粒径和Zeta电位测定
使用Nano-ZS Zeta纳米粒度仪测定样品的粒径分布、Zeta电位和多分散性指数(polydispersity index,PDI)。使用pH 7.0、0.1 mol/L的磷酸盐缓冲液将EYPNs-Cur液体样品稀释100 倍后进行测定。分散相折射率设置为1.42,连续相(磷酸盐缓冲液)折射率设置为1.33,测试温度为25 ℃。
1.3.5 FE-SEM观察
将游离Cur和EYPNs-Cur溶液稀释至适当倍数,吸取5 μL样品滴加至云母片上,置于通风橱中干燥过夜。对于冻干后的粉末样品,直接蘸取适量粉末均匀固定在导电胶上,喷金后进行FE-SEM观察。
1.3.6 AFM观察
将新制备的游离Cur和EYPNs-Cur溶液稀释至适当倍数,然后吸取4 μL样品滴到新制的云母片上,通风橱中过夜干燥后,采用AFM观察颗粒形貌。
1.3.7 荧光光谱测定
配制1.0 mg/mL的EYPNs溶液(溶剂为pH 7.0、0.1 mol/L磷酸盐缓冲液),添加等体积一系列质量浓度(0~40 μg/mL)的Cur无水乙醇溶液(猝灭剂),采用荧光分光光度计测定在280 nm激发波长、260~500 nm发射波长下的荧光光谱,激发和发射狭缝宽度均设置为5 nm,扫描速率固定在240 nm/min,并以EYPNs磷酸盐缓冲液作为空白扣除。根据Stern-Volmer方程(式(2))描述荧光猝灭程度。
式中:F0和F分别表示缺少和存在猝灭剂时的荧光强度;[Q]是猝灭剂浓度/(mol/L);KSV是Stern-Volmer猝灭常数/(L/mol);kq是双分子猝灭速率常数/(L/(mol·s));τ0是在缺少猝灭剂时荧光的寿命(生物大分子的荧光寿命一般为10-8s)。
1.3.8 傅里叶变换红外光谱分析
将冻干后的EYPNs-Cur/YPNs/Cur粉末/物理混合粉末样品与溴化钾按照质量比1∶100混合均匀后压片测定,扫描波数范围为4 000~400 cm-1。
1.3.9 XRD分析
将冻干EYPNs-Cur/YPNs/Cur/物理混合粉末样品装入样品盘中,在Cu Kα X射线(λ=0.154 18 nm)和加速电压40 kV以及40 mA条件下,利用直径0.3 mm的单帽准直器在300 s内收集XRD图。
1.3.10 储存稳定性测定
贮藏过程中为抑制微生物的生长,在EYPNs-Cur溶液中加入0.02%(以溶液总质量计)叠氮化钠。将复合纳米颗粒置于透明玻璃瓶中密闭保存,分别设定温度4 ℃和25 ℃,采用定期取样的方法测定其粒径、电位和PDI以及Cur溶解度的变化。作为对照,测定相同条件下且不含EYPNs的Cur溶液。
1.3.11 复溶性测定
将冻干的EYPNs-Cur用去离子水配制成质量浓度为5 mg/mL的溶液后测定其粒径分布以及Cur溶解度。
1.3.12 体外生物可及性
根据刘春[11]的方法进行体外模拟消化,并稍作修改。取10 mL新配制的样品与40 mL HCl溶液(0.1 mol/L、pH 1.5)混合均匀并用4 mol/L HCl溶液调节pH值为1.5,置于37 ℃恒温水浴锅中孵育10 min,加入10 mg胃蛋白酶继续孵育60 min。经胃蛋白酶消化后,用4 mol/L NaOH溶液将pH值调为7.0,并加入250 mg胆汁提取物孵育10 min,然后再加入10 mg胰蛋白酶继续孵育60~180 min,消化液10 000 r/min离心20 min后按1.3.3节方法测定上清液中的Cur质量浓度。Cur生物可及性按式(3)计算。
1.4 数据处理与分析
以上所用定量分析的实验至少设定3 次平行实验,利用SPSS 13.0软件进行数据分析,作图均采用Origin 8.5软件进行。
2 结果与分析
2.1 EYPNs-Cur的结构表征
通过pH值诱导共组装的方法自下而上制备EYPNs-Cur,制备工艺环保、简单,未使用有机溶剂,且无需复杂的分离过程。通过将EYPNs溶液pH值调至12.0,促使EYPNs解离并使Cur实现足够程度的质子化[14],增加其溶解度,再将pH值回调至7.0,诱导EYPNs重新自组装形成胶束,从而封装Cur。如图1A所示,随着EYPNs添加量的增加,溶液颜色逐渐变深,表明Cur被包封的量不断提高。在中性水溶液中,Cur的溶解度很低,经测定仅为0.13 μg/mL,EYPNs具有较强增溶Cur的能力,当EYPNs质量分数为0.5%时,Cur溶解度(50 μg/mL)明显提升。随着EYPNs质量分数的进一步增加(0.5%~4.0%),Cur的包埋率和溶解度不断升高;当EYPNs质量分数为4.0%时,Cur溶解度(434.35 μg/mL)与对照样相比提高了3 339 倍,且溶液呈均一、分散状态。一般而言,较小的粒径和绝对值较高的Zeta电位意味胶体稳定性较高。由图1B、C可知,水中游离的Cur粒径呈双峰分布,粒径分别为几百纳米到几微米,这表明Cur在水中的存在形式为不均匀的聚集体;并且Cur的Zeta电位仅为-6.9 mV,说明游离Cur在水相中极不稳定。而EYPNs-Cur的粒径分布均为单峰,平均粒径为106.9~126.0 nm,Zeta电位为-20 mV左右。综上,通过EYPNs自组装形成的EYPNs-Cur具有优异的溶解度和胶体分散性。

图1 Cur的包埋率、溶解性(A)及Cur、EYPNs-Cur的粒径分布(B)、Zeta电位(C)Fig. 1 Encapsulation efficiency (EE) and water solubility of Cur (A),particle size distribution of Cur and EYPNs-Cur composite nanoparticles (B),and zeta potential of Cur and EYPNs-Cur nanoparticles (C)
如图2A所示,游离Cur聚集成大的片状结构,这是由于游离的Cur在水中几乎不溶解,以聚集体形式存在;EYPNs-Cur呈球状结构,平均粒径约为120 nm,和纳米粒度仪测定结果基本一致,但也出现了少量不规则聚集,造成粒径变大,很有可能是由于自然风干过程引发EYPNs-Cur出现轻微的聚集。AFM显示出类似的结果,由图2B可知,在游离Cur中观察到大量微米级聚集体,这也是游离Cur粒径测定时出现双峰的原因,EYPNs-Cur复合物则呈类似于球形的纳米结构且分布相对均匀。

图2 Cur和EYPNs-Cur的微观结构Fig. 2 Microstructure of Cur and EYPNs-Cur nanoparticles
冻干后的样品FE-SEM图像如图2C所示,游离Cur冻干后进一步聚集,形成较为致密的蜂窝状结构,出现大量不规则棒块状颗粒,EYPNs-Cur冻干后结构相对松散,能观察到大量球状纳米颗粒,同时有大块片状结构出现,这与文献[27]的报道结果一致,可能是由于冷冻干燥过程造成部分纳米颗粒结构的改变。
2.2 EYPNs和Cur的相互作用分析
蛋白质的内源荧光光谱法是研究水溶液中蛋白质与小分子结合情况的一种方便的方法。不同Cur添加量对EYPNs发射光谱的影响如图3A所示。不添加Cur的纯EYPNs溶液中,在280 nm波长处被激发后,在350 nm波长处出现了一个较高强度的荧光光谱峰。加入少量Cur(10 μg/mL)后,EYPNs的荧光强度即出现大幅减弱,随着Cur质量浓度(10~40 µg/mL)的进一步增加,EYPNs的荧光强度逐渐减弱并逐渐猝灭,最大发射波长变化不大,这说明Cur分子通过疏水相互作用与EYPNs结合,但对于其所处的微环境无明显影响。荧光猝灭可以分为动态猝灭和静态猝灭,分别对应生物聚合物与猝灭剂之间的碰撞和生物聚合物与猝灭剂之间形成复合物两种方式使荧光猝灭[14]。通过线性回归计算得到EYPNs和Cur之间复合的双分子猝灭速率常数kq为1.10×1013L/(mol·s),远大于最大动态猝灭速率常数2.0×1010L/(mol·s)[5],因此Cur诱导EYPNs的荧光猝灭属于静态猝灭。

图3 表征EYPNs和Cur相互作用的光谱图Fig. 3 Spectrograms characterizing interaction between EYPNs and Cur
如图3B所示,游离Cur在3 510 cm-1处出现的特征吸收峰,对应于Cur中酚羟基(—OH)的拉伸振动。物理混合后Cur的多处特征峰(3 510、1 628、870、710 cm-1)有所减弱但是并没有消失,这可能是因为EYPNs具有较高的峰形,会掩盖部分Cur的指纹区使其特征峰强度降低,这表明物理混合并不会使EYPNs与Cur发生相互作用。EYPNs-Cur在3 510 cm-1处的—OH拉伸振动峰消失,说明Cur和EYPNs之间可能存在氢键相互作用。Cur分子在1 427、1 154 cm-1和855 cm-1处的特征峰主要与芳香环和环间链的振动有关[28],Cur指纹图谱区域(500~1 300 cm-1)吸收峰的强度和数量在EYPNs-Cur中均出现明显降低,表明Cur的疏水基团可能通过疏水相互作用与蛋白质相互作用。此外,Cur-EYPNs与EYPNs的峰形完全一致,这表明Cur与EYPNs通过非共价相互作用结合后完全被封装起来。
XRD被广泛应用于活性物质包埋体系或生物聚合物结晶度的研究。由图3C可知,游离Cur是高度结晶结构,其衍射峰与文献[29]报道的Cur特征峰一致,EYPNs为无定形结构。经过简单的物理混合后,Cur的结晶峰强度有所减弱,但是大部分衍射峰并没有消失,这可能是由于EYPNs会掩盖部分Cur造成其衍射峰强度降低;EYPNs-Cur的XRD光谱未显示任何衍射峰,与EYPNs几乎完全一致,表明Cur被EYPNs完全封装,这与文献[30-31]报道的结果一致。
2.3 EYPNs-Cur的储存稳定性
如图4A~C所示,在25 ℃下贮藏1 个月的过程中,EYPNs质量分数为0.5%和1.0%时,EYPNs-Curs的粒径基本不变,2.0%和3.0% EYPNs组的粒径略微增加,而4.0% EYPNs组的粒径快速增加,且在结束时增至0 d时的约2 倍。PDI结果显示,除了4.0% EYPNs组增大至0.417,其他样品都小于0.3,表明样品具有较为均一的粒径分布。所有样品经储存1 个月后外观无明显变化,未发生聚集和沉淀,只有4.0% EYPNs组的样品颜色轻微变浅。以上结果表明,除4.0% EYPN组的复合纳米颗粒发生了轻微聚集外,其他样品都显示出良好的胶体稳定性。

图4 EYPNs-Cur在25 ℃贮藏期间的粒径分布(A)、外观(B)、PDI(C)和Cur溶解度(D)的变化Fig. 4 Particle size distribution (A), appearance (B), PDI (C) and Cur water solubility (D) of EYPNs-Cur composite nanoparticles during storage at 25 ℃
Cur在水溶液中的稳定性较差,短时间内会迅速发生降解,并呈pH值依赖性:在pH值为3.0~6.5时,Cur的半衰期为100~200 min;在pH值为7.2~8.0时,Cur的半衰期急剧缩短至1~9 min[32]。因此,评价Cur在储存期间的保留率至关重要。如图4D所示,Cur封装于EYPNs中大大提高了其降解稳定性。在25 ℃下不避光贮藏1 个月后,EYPNs-Cur中的Cur含量基本未发生改变,只在3.0%、4.0% EYPNs组出现了Cur轻微降解(溶解度分别为322.25~288.00、434.35~393.25 μg/mL)的情况,但其Cur保留量依然高达90%左右。这主要是由于当EYPNs荷载的Cur量较大时,在25 ℃透明玻璃瓶中不可避免地受光照的影响使部分Cur发生降解。Prasad等[6]报道通过反溶剂构建的Cur纳米颗粒在72 h后Cur的保留率降至60%,表明本研究中构建的EYPNs-Cur可以有效保护Cur免受光照和氧化剂等的影响而降解。可能的稳定机制如下:一方面归因于两亲性EYP自身具有一定的抗氧化能力[33];另一方面,EYPNs与Cur相互作用所结合,起到了“固定”Cur的作用,降低其迁移率,从而降低了其化学反应性;此外,结合XRD结果,Cur被完全封装于EYPNs的胶束内部,形成了物理屏障,从而保护Cur不被降解。

在室温25 ℃不避光条件下,EYPNs-Cur已经显示出良好的储存稳定性,但较高浓度纳米颗粒的粒径会有所增加,为了更好地实现纳米颗粒的长期稳定,进一步考察低温贮藏条件下EYPNs-Cur的粒径分布及Cur溶解度变化情况,结果如图5所示。所有样品在4 ℃下贮藏1 个月后,粒径均无明显变化,范围为105~135 nm,且PDI变化也很小,PDI最高不超过0.24,这表明在低温条件下储存,所有样品都具有优异的胶体稳定性。此外,EYPNs-Cur的外观在储存1 个月后与第1天相比无肉眼可见的差异。所有复合纳米颗粒的Cur几乎没有发生降解,表明低温贮藏能有效抑制Cur的降解,这主要是由于低温可以抑制复合纳米颗粒奥斯瓦尔德熟化过程和降低Cur的氧化速率。

图5 EYPNs-Cur在4 ℃贮藏期间的粒径分布(A)、外观照片(B)、PDI(C)和Cur溶解度(D)变化Fig. 5 Particle size distribution (A), appearance (B), PDI (C) and Cur water solubility (D) of EYPNs-Cur composite nanoparticles during storage at 4 ℃
2.4 EYPNs-Cur的冻干复溶性
Chen Feiping等[1]研究发现,大豆蛋白-Cur复合物冻干后的颗粒尺寸相对于冻干前会显著增加,这是因为冻干过程中的温度改变会引起蛋白质的表面特征发生明显变化,进而导致蛋白质聚集。因此本实验考察了冻干后EYPNs-Cur的粒径分布和Cur溶解性情况,以评估EYPNs-Cur的冻干稳定性。如图6A所示,与冻干前(图1A)相比,复溶后的EYPNs-Cur溶液外观无明显变化,整体均一澄清,无肉眼可见的聚集、沉淀出现,呈现出良好的再分散性,且同一EYPNs质量分数组的样品复溶后的溶解性与冻干前无明显差异。粒径分布的结果(图6B)也与冻干前(图1B)基本一致,这表明冻干过程对复合纳米颗粒的胶体分散性没有明显影响,未引发不可逆的颗粒聚集。因此,本研究制备的EYPNs-Cur可适用于多种应用场景,并且具有保存和运输条件上的优势。

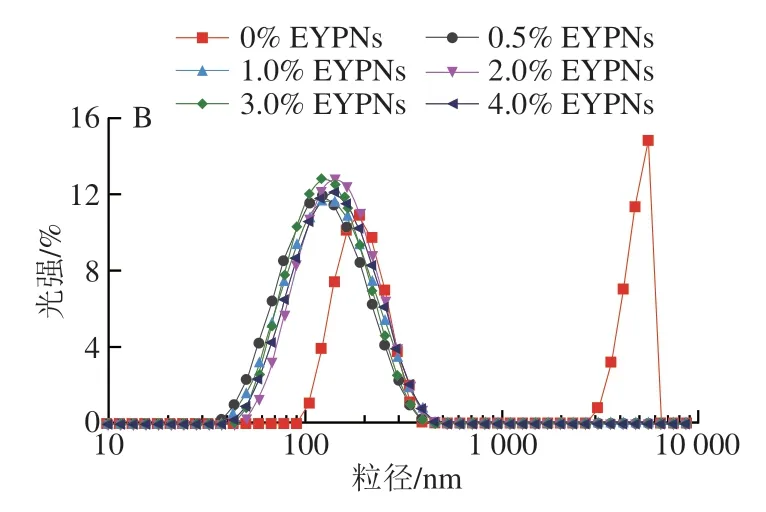
图6 冻干游离Cur和EYPNs-Cur粉末的复溶性(A)及粒径(B)分布Fig. 6 Reconstitution property (A) and particle size distribution (B) of free Cur and EYPNs-Cur nanoparticles
2.5 EYPNs-Cur的生物可及性
在消化过程中脂溶性物质经过胆酸盐乳化后,可形成稳定的复合胶束并通过小肠细胞屏障进而转运到血液循环中参与多种生命活动[11,31,34]。Cur的生物可及性主要取决于其在消化液中的溶解性,Cur含量越高表示其生物可及性越高[30]。游离Cur和EYPNs-Cur在整个模拟消化过程中Cur保有量的变化如图7所示,在模拟胃消化阶段,游离Cur和复合纳米颗粒在消化液中的生物可及性均较低,分别为0.3%~0.6%和4.4%~4.9%,虽然在数值上并不高,但EYPNs-Cur却显著高于游离Cur。在模拟肠消化阶段,两组样品在消化液中的Cur保有量均增大,游离Cur和EYPNs-Cur中的Cur生物可及性分别为30.2%~40.9%和66.3%~73.6%。相较于游离Cur,自组装形成EYPNs-Cur后,Cur的生物可及性提高近1 倍,这表明EYPNs-Cur可以显著提高Cur的生物可及性。值得注意的是,EYPNs-Cur在模拟消化过程中依然有约30%的Cur未得到利用,原因可能是EYPNs在长达1 h酸性条件下发生聚集并导致复合纳米颗粒沉淀。此外,胃蛋白酶也会水解部分EYPNs使EYPNs-Cur失稳并释放部分Cur,而Cur在酸性环境中溶解性较差。整体来看,将Cur包载于EYPNs中能大幅提升其在消化液中,增加其生物可及性。就EYPNs-Cur而言,如果采用特定的材料封装让其安全穿过胃并进入肠道内释放,其生物可及性将会大幅度提高。

图7 游离Cur和EYPNs-Cur在体外消化过程中Cur生物可及性的变化Fig. 7 Changes in the bioaccessibility of free Cur and EYPNs-Cur during simulated gastrointestinal digestion
3 结 论
本研究采用工业生产蛋黄卵磷脂和蛋黄油产生的副产物脱脂蛋黄蛋白粉为原料,通过胰蛋白酶水解得到两亲性EYP及其自组装形成的胶束状纳米颗粒(EYPNs),用于构建稳定的共组装EYPNs-Cur复合纳米颗粒输送体系。结果表明,EYPNs和Cur之间存在较强的疏水相互作用,Cur通过与EYPNs共组装形成纳米颗粒对Cur进行包埋,可使Cur溶解度大幅提高,同时使其即使经过长达1 个月的不避光贮藏也不发生降解。此外,Cur与EYPN共组装后的体外消化生物可及性大幅提高,由30.2%~40.9%增加至66.3%~73.6%。本研究表明,由兼具生物活性与两亲性的EYP自组装形成的纳米胶束颗粒是一种新型高效的纳米递送载体,可大幅提升疏水性功能因子的水溶性、稳定性和生物可及性,在功能性食品与营养品以及生物医药等领域具有重要的应用价值。

