系统性炎症指标对下肢动脉硬化闭塞症患者发生肌少症的预测价值
聂璐, 杨启帆, 郑维淼, 徐强
(1. 江苏大学附属武进医院介入血管科, 江苏 常州 213017; 2. 徐州医科大学武进临床学院, 江苏 常州 213017; 3. 江苏大学附属人民医院消化科, 江苏 镇江 212002)
下肢动脉硬化闭塞症(arteriosclerosis obliterans,ASO)是动脉粥样硬化的一种常见疾病,表现为下肢动脉狭窄或闭塞引发的缺血性病变。近年来,受我国人口老龄化影响,ASO的发病率持续上升,尤其在70岁及以上的老年人中高达15%~20%[1]。这种疾病导致下肢血流减少,限制了腿部肌肉的能量和氧气供应,从而影响其功能和质量,进一步可能引发肌少症这种骨骼肌疾病[2-3]。肌少症是一种进行性且全身性疾病,以肌肉质量和功能的快速丧失为特点,可能导致患者跌倒、肌肉功能下降及死亡[4]。相较于普通老年人群,ASO患者中肌少症的发病率显著增高(10%vs35%)[5-6],并且它被视为ASO不良预后的独立危险因素。对于ASO患者,研究发现患有肌少症者的死亡率、心血管并发症和截肢率明显高于未患肌少症的患者[7-8]。慢性炎症被认为是ASO和肌少症的共同病理机制[6]。评估全身炎症常用的指标包括全身免疫炎症指数(SII)、血小板/淋巴细胞比值(PLR)、中性粒细胞/淋巴细胞比值(NLR)、淋巴细胞/单核细胞比值(LMR)和C反应蛋白(CRP),这些指标因经济高效和无创性而受到青睐[9-10]。虽然某些文献指出这些指标与肌少症之间存在相关性,但主要集中于肿瘤领域,如胃癌和肾癌[11-12]。目前,尚未有研究明确揭示系统性炎症指标与ASO患者中肌少症风险的关系。因此,本研究旨在探索系统性炎症指标对ASO患者发生肌少症的预测价值,以期为肌少症的治疗策略提供新方向。
1 资料与方法
1.1 研究对象
本回顾性研究纳入2019年5月1日至2023年7月1日在江苏大学附属武进医院及南京医科大学附属常州第二人民医院收治的251例经下肢动脉CTA确诊的ASO患者,其中,男183例,女68例。所有诊断均基于2016年中华医学会外科学分会血管外科组发布的ASO诊疗指南[1],该指南要求患者必须表现出对应的临床症状及下肢CTA的成像特征。研究纳入标准如下:① ASO确诊患者;② 年龄超过40岁。排除标准包括:① 存在严重意识障碍或健康状况极差;② 存在恶性肿瘤或心、肝、肾功能衰竭;③ 处于大动脉炎活动期或有其他感染性疾病;④ 合并炎症性肠病等自身免疫性疾病;⑤ 合并遗传性肌肉病变或其他神经肌肉疾病;⑥ 由其他疾病导致的长期卧床或肌肉萎缩;⑦ 患有原发性肌少症,即与年龄相关的肌肉丧失而无其他明确疾病或因素;⑧ 缺乏完整的临床资料。本研究经上述两家医院伦理委员会的批准(审批号2023-SR-095),并严格遵循赫尔辛基宣言。
1.2 肌少症的定义
多项研究已证实CT图像第三腰椎(L3)水平的总肌肉横截面积与全身肌肉质量存在显著相关性[13]。为此,本研究使用3D Slicer软件(版本5.1.0,美国)对ASO患者的CT扫描图像进行细致勾勒,进而半自动地测量L3椎体下缘双侧腰大肌的横截面积,见图1。采用以下公式计算腰大肌指数(PMI),PMI=(左侧腰大肌面积+右侧腰大肌面积)/身高2,单位:cm2/m2。参考相关文献设定性别特异性的PMI临界值[14-15]:男性PMI<5.5 cm2/m2及女性PMI<4.0 cm2/m2诊断为肌少症。
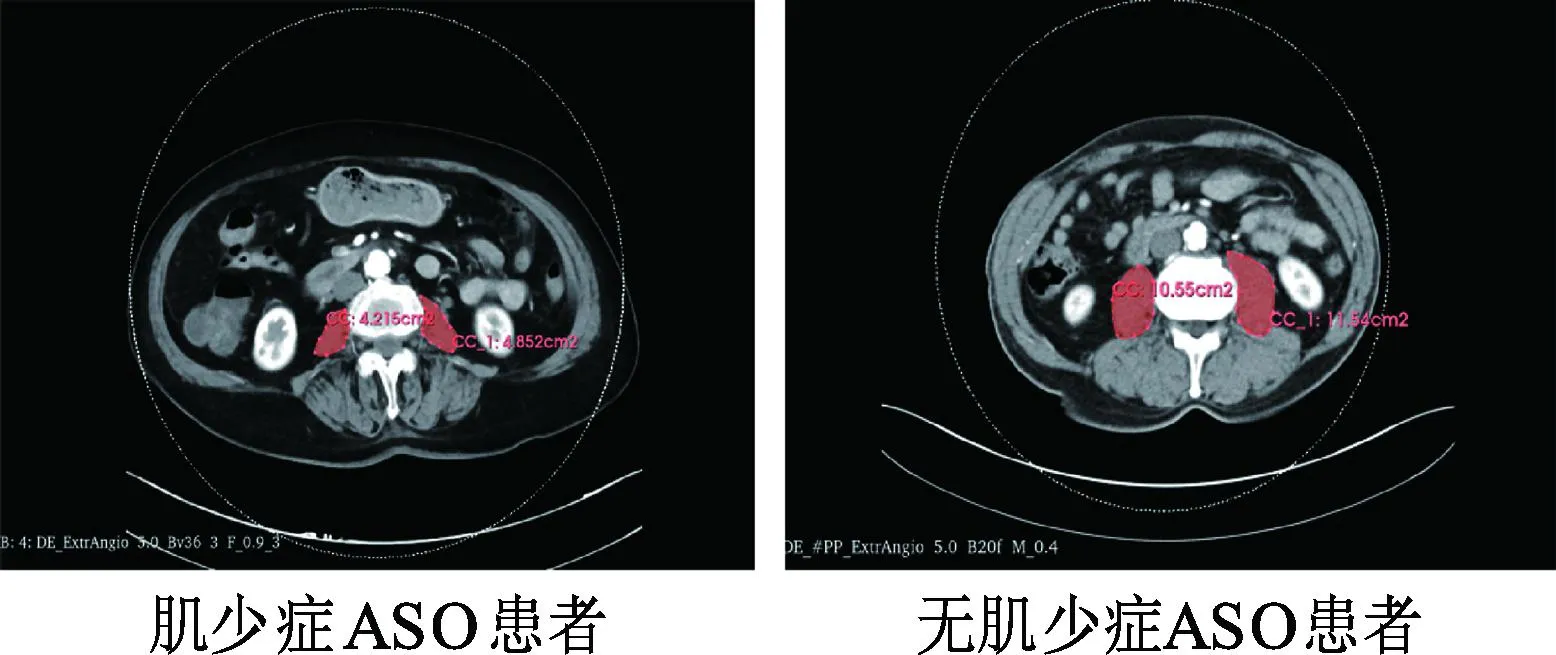
图1 第三腰椎水平的CT图像测量腰大肌面积
1.3 方法
收集所有患者的基础临床信息,包括年龄、性别、体重指数(BMI)、糖尿病、高血压、吸烟、饮酒及用药的病史等。从电子病历数据库提取患者入院24 h内完善的血常规数据,包括中性粒细胞、淋巴细胞、单核细胞、血小板和CRP。基于这些结果,计算如下指标:SII(血小板计数×中性粒细胞计数/淋巴细胞计数)、PLR(血小板计数/淋巴细胞计数)、NLR(中性粒细胞计数/淋巴细胞计数)、LMR(淋巴细胞计数/单核细胞计数)。
1.4 统计学分析
2 结果
2.1 一般情况
共纳入251例ASO患者,其中男183例(72.9%),女68例(27.1%),中位年龄为73.0岁,中位BMI值为22.6 kg/m2。共有98例(39.0%)患者诊断出肌少症,肌少症组的中位年龄明显高于非肌少症组,中位BMI值明显低于非肌少症组,差异均有统计学意义(P<0.001);吸烟、饮酒、糖尿病、高血压、冠心病、脑卒中及用药情况,两组比较均无统计学差异,见表1。此外,与非肌少症组相比,肌少症组的SII、PLR、NLR和CRP明显升高,LMR明显降低,差异均有统计学意义(P<0.01),见表2。
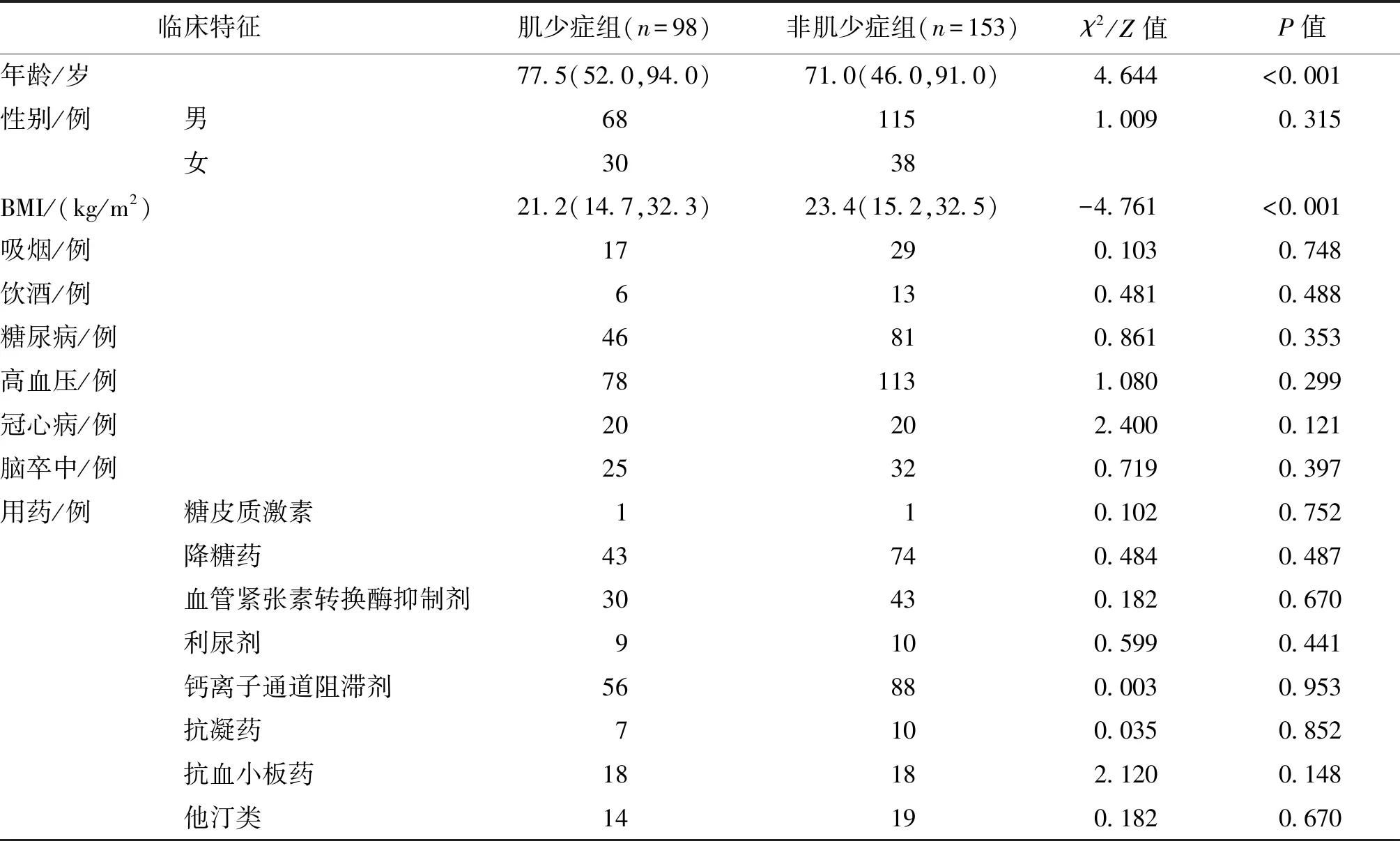
表1 肌少症组与非肌少症组一般资料比较

表2 肌少症组与非肌少症组系统性炎症指标比较
2.2 多因素Logistic回归分析ASO患者发生肌少症的影响因素
单因素分析中,年龄、BMI、SII、PLR、NLR、LMR和CRP是存在显著差异的影响因素。将这些指标纳入多因素Logistic回归分析显示,高龄、低BMI、高SII是ASO患者发生肌少症的独立危险因素,OR(95%CI)分别为1.057(1.023~1.093)、0.851(0.775~0.934)和1.001(1.000~1.002),见表3。

表3 肌少症影响因素的多因素Logistic回归分析
2.3 年龄、BMI、SII单项指标及联合预测肌少症发生的效能
ROC曲线分析显示,年龄的曲线下面积(AUC)为0.674(95%CI:0.604~0.743),BMI的AUC为0.678(95%CI:0.609~0.747),SII的AUC为0.644(95%CI:0.574~0.714)。3项指标联合预测模型的AUC为0.746(95%CI:0.683~0.808),见图2和表4。
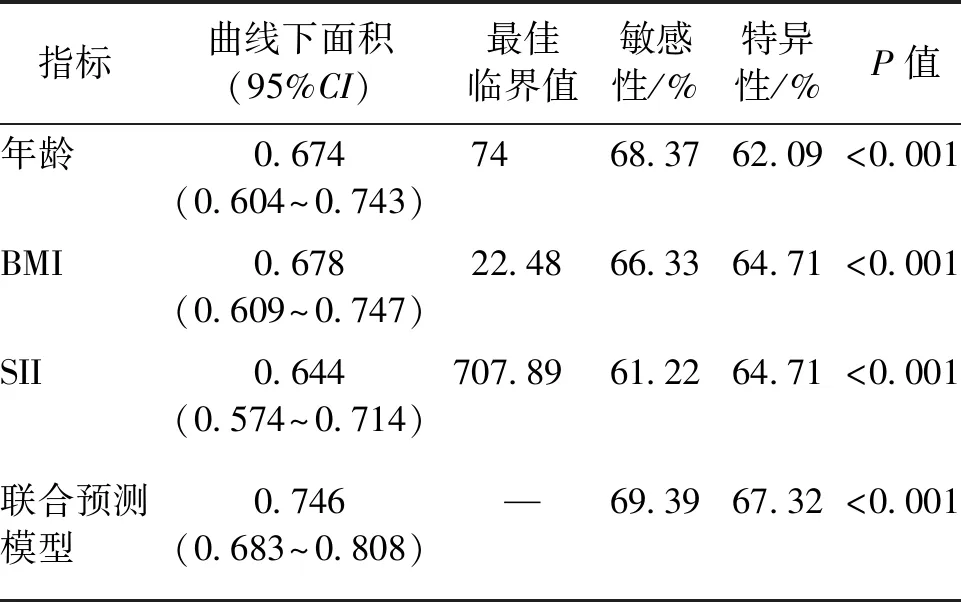
表4 单项指标及联合预测肌少症发生的ROC曲线参数

图2 单项指标及联合预测肌少症发生的ROC曲线
3 讨论
ASO是老年人群中的常见疾病。慢性炎症、氧化应激及骨骼肌的线粒体损伤均可能增加ASO患者并发肌少症的风险[6]。因此,对ASO患者进行肌少症的早期检测和预警显得尤为重要。本研究结果显示,年龄、BMI、SII是ASO患者发生肌少症的独立风险因素。
本研究中高龄ASO患者更易发生肌少症,这与Volpato等[16]研究结果一致。这种趋势可能与年老所带来的体力活动减少、肌肉纤维数量下降、激素水平降低及炎症标志物增加有关[17]。其他因素如营养不足、骨质疏松、神经肌肉退行性变以及某些遗传因素也对肌少症的发病率有显著影响[18]。鉴于高龄ASO患者通常机能下降、运动能力减退并伴有其他基础疾病,因而面临更高的肌少症风险。因此,针对这一患者群体,建议密切关注肌肉健康状况,并通过营养和运动教育介入,以降低肌少症的发病率。
本研究结果还显示,低BMI增加ASO患者的肌少症风险。Matsubara等[19]研究指出,BMI低于22.0 kg/m2的ASO患者中,肌少症的发病率较高。但在以往的研究中,BMI与肌少症之间的关系尚未达到共识[20]。低BMI可能暗示营养状况不佳,从而增加肌少症的风险。而高BMI则可能与肌少症合并肥胖有关,这两种情况可以相互影响。肌少症与肥胖之间的复杂关系涉及多种病理生理因素,包括炎症、氧化应激、胰岛素抵抗、激素水平变化以及体力活动的降低[21]。本研究中,合并肌少症ASO患者BMI普遍偏低,这可能与亚洲人的体质有关。但在西方,肌少症合并肥胖的情况较为常见。因此,临床医生需要对低BMI患者进行肌肉健康评估,同时认识到肌少症和肥胖可以共同存在。
本研究揭示了系统性炎症指标与ASO患者肌少症风险的紧密联系。肌少症组ASO患者SII、PLR、NLR和CRP水平明显高于非肌少症组,而LMR水平明显低于非肌少症组。系统性炎症指标已被证实与多种疾病的进展和预后关联[22-23]。例如,乔建兵等[24]研究发现NLR和PLR与晚期非小细胞肺癌患者的预后有关。Okugawa等[25]指出结直肠癌患者的PLR、SII增高和LMR降低与肌少症的风险有显著关联。本研究结果表明SII是ASO患者肌少症的独立危险因素,同时,ROC曲线证实了SII对ASO患者发生肌少症的预测价值,且SII联合BMI和年龄预测模型AUC为0.746,其预测效能优于任何单一指标。
本研究存在以下局限性:① 本研究为回顾分析,且样本量有限,确立因果关系的证据不够充分;② 肌少症的确诊完全基于CT图像,只反映了肌量,未涵盖肌肉力量和体能的全面评估;③ 系统性炎症指标受多重因素干扰,且代表的是患者的总体健康状况,尚需进一步通过大规模、多中心的研究来验证我们的发现。
综上所述,本研究明确了年龄、BMI、SII在预测ASO患者肌少症风险上的重要作用,为肌少症的早期诊断与干预提供了有益的依据。这些发现为肌少症的预防和治疗路径提供了新的方向。

