石膏中三氧化硫和二氧化硫的检测方法研究
王冠杰 王瑞海
(中国建筑材料检验认证中心有限公司 ,北京 100024 )
1 概述
随着国家对废物循环利用的鼓励和推广,工业副产石膏在水泥生产过程中得到广泛应用。石膏中的主要成分为硫酸钙,但工业副产石膏中也含有不稳定的亚硫酸钙,对石膏及石膏制品的物理性能产生一定影响。如何检测石膏尤其是工业副产石膏中硫酸钙和亚硫酸钙的含量越来越受得关注。在GB/T 5484-2000《石膏化学分析方法》中,三氧化硫的测定主要是盐酸溶解试样,硫酸钡沉淀的方法,美国试验与材料学会国际组织ASTM C471M-01(2006)《石膏和石膏制品的化学分析方法》也是采用上述方法。该试验没有考虑亚硫酸盐对三氧化硫的影响,同时标准中也没涉及到亚硫酸盐含量的检测方法。而日本工业标准JISR 9101-1995《石膏化学分析方法》规定若试样中含有亚硫酸钙,用过氧化氢对其氧化后,由此试样溶液测定三氧化硫含量,再减去二氧化硫的量。结合国内外相关标准及我国实际国情,提出将石膏中三氧化硫的测定分为含有亚硫酸钙和不含有亚硫酸钙两中情况。若石膏中不含有亚硫酸钙,可直接采用常规盐酸溶解法测定三氧化硫。石膏中含有亚硫酸钙,三氧化硫的测定方法采用过氧化氢氧化法测定的全硫减去二氧化硫的含量,并对过氧化氢氧化法的试验条件进行优化。同时提出石膏中二氧化硫的测定采用碘量法得到,并对试验条件进行优化。
2 测定原理
2.1 石膏中三氧化硫的测定原理
试样用盐酸分解,过滤后在酸性溶液中,用氯化钡溶液沉淀硫酸盐,经过灼烧后,以硫酸钡形式称量。测定结果以三氧化硫计。对于试样中含有亚硫酸钙的情况,称取试样,用过氧化氢氧化后,测定试样溶液中的三氧化硫和二氧化硫合量,再减去测得的二氧化硫的量。
2.2 石膏中二氧化硫的测定原理
往试样中加入过量的碘标准滴定溶液把亚硫酸钙氧化,然后酸化,用硫代硫酸钠标准滴定溶液返滴定过量的碘。
3 测定方法
3.1 试剂
3.1.1 氯化钡溶液(100g/L)。
3.1.2 pH4.3的缓冲溶液 将42.3g无水乙酸钠(CH3COONa)溶于水中,加入80mL冰乙酸(CH3COOH),加水稀释至1L。
3.1.3 碘标准滴定溶液[c(1/2I2)=0.1mol/L]
将40g碘 化 钾(KI)溶 于200mL水 中,再加入13g碘(I2),搅拌完全溶解后,加入1mL硫酸(1+2),用快速滤纸过滤后,再用水稀释至1000mL,摇匀,贮存于棕色瓶中。移取20.00mL碘标准滴定溶液于250mL锥形瓶中,加水稀释至100mL,用硫代硫酸钠标准滴定溶液滴定至浅黄色后,加入约2mL淀粉溶液,再继续滴定至蓝色消失,测定碘标准滴定溶液与硫代硫酸钠标准滴定溶液的体积比K1,碘标准溶液的浓度c(1/2I2)和碘标准溶液对二氧化硫的滴定度TSO2。
3.1.4 硫代硫酸钠标准滴定溶液[c(Na2S2O3)=0.1mol/L]
将25g硫 代 硫 酸 钠(Na2S2O3·5H2O)溶 于200mL无二氧化碳的水中,加入约0.2g无水碳酸钠(Na2CO3),溶解后再用无二氧化碳的水稀释至1000mL,摇匀,贮存于棕色瓶中。称取0.10g~0.12g(m3)已 于120℃烘 过2h的 碘 酸钾(KIO3,优级纯),精确至0.0001g,置于带磨口塞的250mL锥形瓶中,加入2g碘化钾(KI)和50mL水,摇动溶解后,加入10mL硫酸(1+2),用水冲洗瓶壁,用硫代硫酸钠标准滴定溶液滴定至浅黄色后,加入约2mL淀粉溶液,再继续滴定至蓝色消失。计算出硫代硫酸钠标准滴定溶液的浓度c(Na2S2O3)
3.1.5 试样1由石膏样品中加入一定量的亚硫酸钙配置而成。由于亚硫酸钙不稳定,石膏中的全硫测定结果以艾氏卡法测定结果为标准。
3.1.6 试样取自水泥厂用工业副产石膏。
3.2 测定三氧化硫的试验可行性设计及试验条件选择
3.2.1 方法可行性验证
石膏试样中如果含有亚硫酸钙,采用盐酸直接分解试样,在分解试样过程中,部分亚硫酸盐可能会被氧化成硫酸盐,使三氧化硫的测定结果偏高。对于含有亚硫酸钙的情况,为了准确测定三氧化硫的含量,需要测定试样中全硫含量,再减去二氧化硫的量求得三氧化硫的含量,工业副产石膏中除了含有硫酸盐和亚硫酸盐,其他硫化物等低价态元素的含量可忽略不计。我们通过艾氏卡法和过氧化氢氧化法对比全硫结果,检测过氧化氢氧化法是否可行。同时把过氧化氢氧化法测定得到的全硫减去碘量法测得的二氧化硫(两者硫的含量以三氧化硫计算)和盐酸直接分解试样测得的三氧化硫比较,验证如果试样中含有亚硫酸盐,盐酸直接分解试样测定三氧化硫方法是否可行。
(1) 艾氏卡法测定全硫
称取约0.2g试样1和试样2,分析步骤按GB/T 214—2007《煤中全硫的测定方法》进行测定,氯化钡(100g/L)的加入量改为缓慢滴加15ml。
(2) 过氧化氢法测定全硫
称 取 约0.2g试 样1和 试 样2,精 确 至0.0001g,置 于200mL烧 杯 中,加 入5mL过 氧化氢和15mL pH4.3的缓冲溶液(2.1.2),搅拌使试样完全分散,用平头玻璃棒压碎块状物,加水稀释至50mL,加热煮沸并微沸5min~10min,取下稍冷,在搅拌下加入10mL盐酸(1+1),将溶液加热煮沸并微沸5min。用中速滤纸过滤,用热水洗涤10~12次,滤液及洗液收集于400mL烧杯中,加水稀释至约250mL。以下分析步骤按标准进行沉淀、灼烧和称量硫酸钡。
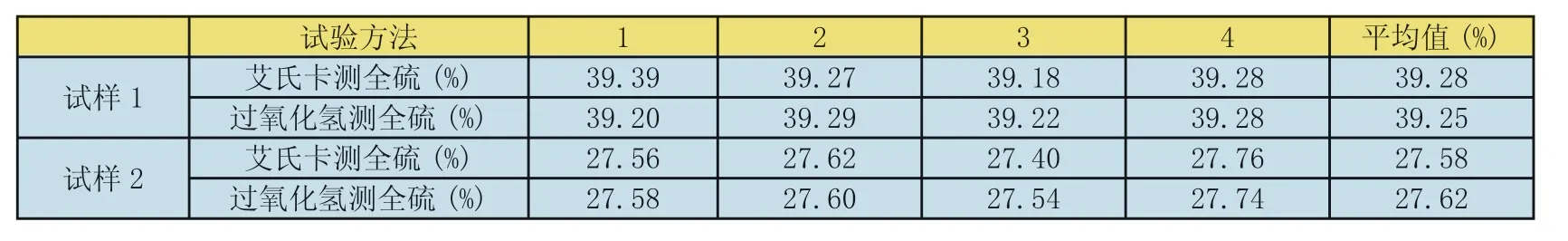
表1 艾氏卡法和过氧化氢氧化法测定的全硫结果对比(试验结果以三氧化硫计算)
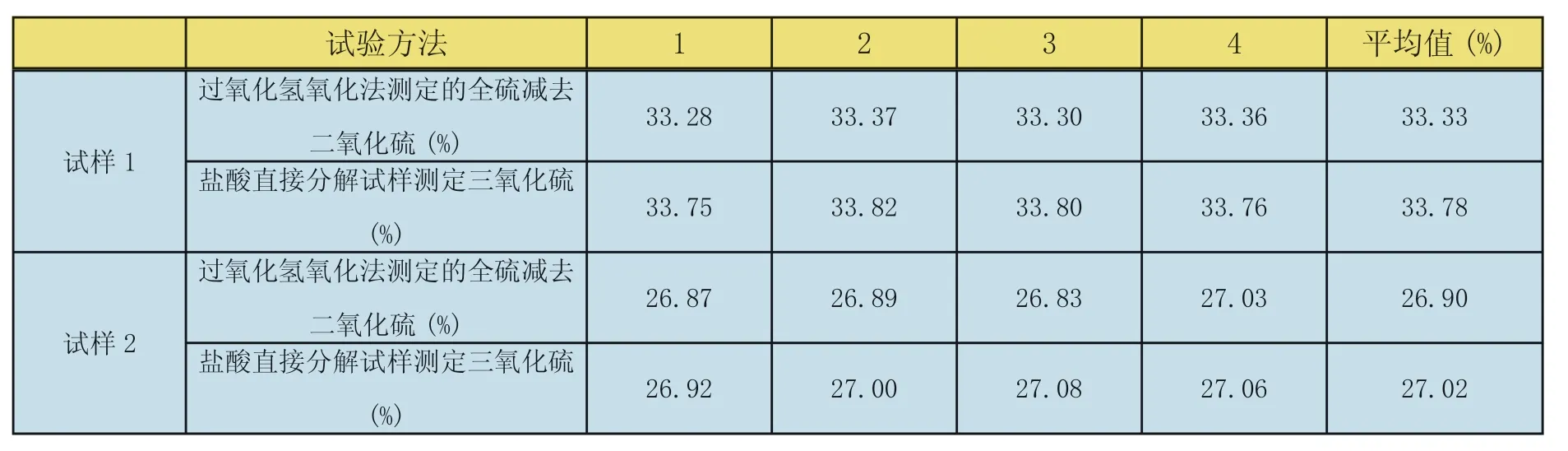
表2 三氧化硫测定结果对比
(3) 盐酸直接分解试样测定三氧化硫
称 取 约0.2g试 样1和 试 样2,精 确 至0.0001g,其余方法和GB/T 176-2008《水泥化学分析方法》中三氧化硫的测定……硫酸钡重量法一致。
(4) 全硫测定结果比较
艾氏卡法和过氧化氢氧化法测定的全硫结果对比,测定结果见表1。
通过表1可以看出,过氧化氢法测定全硫和艾氏卡法测定全硫得到的结果一致,说明过氧化氢法测定全硫的方法是可行的。
(5) 三氧化硫测定结果比较
三氧化硫指的是石膏中硫酸盐的含量。
碘量法测定二氧化硫含量(见本文2.5条),测定结果分别为4.73%、4.76%、4.74%、4.74%、4.74%,平均值为4.74%。
把过氧化氢氧化法测定得到的全硫减去碘量法测得的二氧化硫(两者硫的含量以三氧化硫计算,见本文2.5条)和盐酸直接分解试样测得的三氧化硫比较,测定结果见表2。
试验结论:硫酸钡直接沉淀法测定石膏中三氧化硫结果偏高,说明在操作过程中有一部分二氧化硫氧化成三氧化硫,因此,测定亚硫酸钙中的硫酸钙,应该采用过氧化氢氧化法测定得到的全硫减去碘量法测得的二氧化硫。
3.2.2 过氧化氢氧化法测定全硫试验条件的选择
(1) 加入过氧化氢后溶液的温度
方法一:称取约0.2g试样1,置于200mL烧杯中,加入5mL过氧化氢和15mL pH4.3的缓冲溶液(2.1.2),搅拌使试样完全分散,用平头玻璃棒压碎块状物,加水稀释至50mL,加热煮沸并微沸5min~10min,取下稍冷,在搅拌下加入10mL盐酸(1+1),将溶液加热煮沸并微沸5min。用中速滤纸过滤,用热水洗涤10~12次,滤液及洗液收集于400mL烧杯中,加水稀释至约250mL。以下分析步骤按标准进行沉淀、灼烧和称量硫酸钡。
方法二:加入5mL过氧化氢和15mL pH4.3的缓冲溶液(2.1.2),搅拌使试样完全分散,用平头玻璃棒压碎块状物,加水稀释至50mL,静置5min~10min,其他分析步骤同方法一,结果见表3。

表3 加入过氧化氢后溶液的温度对全硫测定结果的影响
通过对比可以得出试验结论:若试样中含有亚硫酸钙,必须通过加热煮沸并微沸5min~10min才能使亚硫酸钙完全转换成硫酸钙。
(2) pH4.3的缓冲溶液的加入量
固定其他试验条件,改变pH4.3的缓冲溶液的加入量,分别为5mL、10mL、15mL。试验结果见下表4。
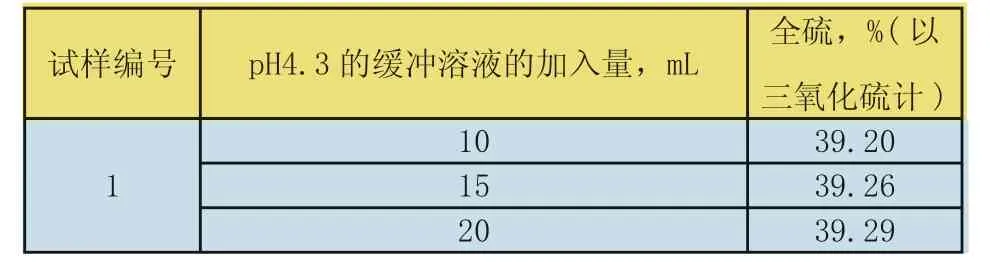
表4 pH4.3的缓冲溶液的加入量对全硫测定结果的影响
试验结论:pH4.3的缓冲溶液的加入量15mL~20mL,全硫测定的结果一致,参考日本工业标准JIS R9101-1995《石膏化学分析方法》,所以选择加入15mL pH4.3的缓冲溶液。
(3) 过氧化氢的加入量
固定其他试验条件,改变过氧化氢的加入量,分别为5mL、10mL、15mL。试验结果见下表5。
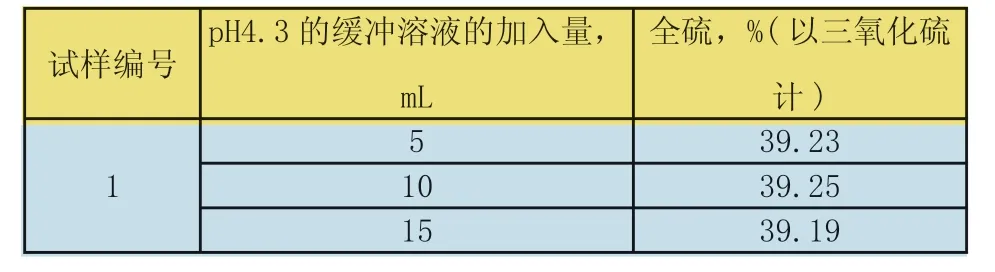
表5 过氧化氢的加入量对全硫测定结果的影响
试验结论:过氧化氢的加入量5mL~15mL,全硫测定的结果一致,所以选择加入5mL过氧化氢的加入量。
3.3 测定三氧化硫试验总结
3.3.1 试样中不含有亚硫酸钙的情况
从称取约0.2g试样,精确至0.0001g,置于200mL烧杯中,加入约40mL水,搅拌使试样完全分散,在搅拌下加入10mL盐酸(1+1),用平头玻璃棒压碎块状物。将溶液加热煮沸并微沸5min。用中速滤纸过滤,用热水洗涤10~12次,滤液及洗液收集于400mL烧杯中,加水稀释至约250mL。玻璃棒底部压一小片定量滤纸,盖上表面皿,加热煮沸,在微沸下从杯口缓慢滴加15mL氯化钡溶液(2.1.1),继续微沸数分钟至沉淀良好的形成,然后在常温下静置12h~24h或温热处静置至少4h(仲裁分析须在常温下静置12h~24h),此时溶液体积应保持在约200mL。用慢速定量滤纸过滤,以温水洗涤,用胶头擦棒擦洗烧杯及玻璃棒,洗涤至检验无氯离子为止。将沉淀及滤纸一并移入已灼烧恒量的瓷坩埚中,灰化完全后,放入800℃~950℃的高温炉内灼烧30min,取出坩埚,取出坩埚置于干燥器中冷却至室温,称量。反复灼烧,直至恒量。
结果计算按照GB/T 176-2008 《水泥化学分析方法》中三氧化硫的计算公式。
3.3.2 试样中含有亚硫酸的情况
从称取约0.2g试样(m3),精确至0.0001g,置于200mL烧杯中,加入5mL过氧化氢和15mL pH4.3的缓冲溶液(2.1.2),搅拌使试样完全分散,用平头玻璃棒压碎块状物,加水稀释至50mL,加热煮沸并微沸5min~10min,取下稍冷,在搅拌下加入10mL盐酸(1+1),将溶液加热煮沸并微沸5min。用中速滤纸过滤,用热水洗涤10~12次,滤液及洗液收集于400mL烧杯中,加水稀释至约250mL。以下分析步骤按2.3.1进行沉淀、灼烧和称量硫酸钡。
试样中三氧化硫的质量分数 wso3 按式(1)计算:

式中:
m3——灼烧后沉淀的质量,单位为克(g);
m03——空白试验灼烧后沉淀的质量,单位为克(g);
m4——试料的质量,单位为克(g);
wso2——按2.5测得的二氧化硫的质量分数,%;
1.25——二氧化硫对三氧化硫的换算系数。
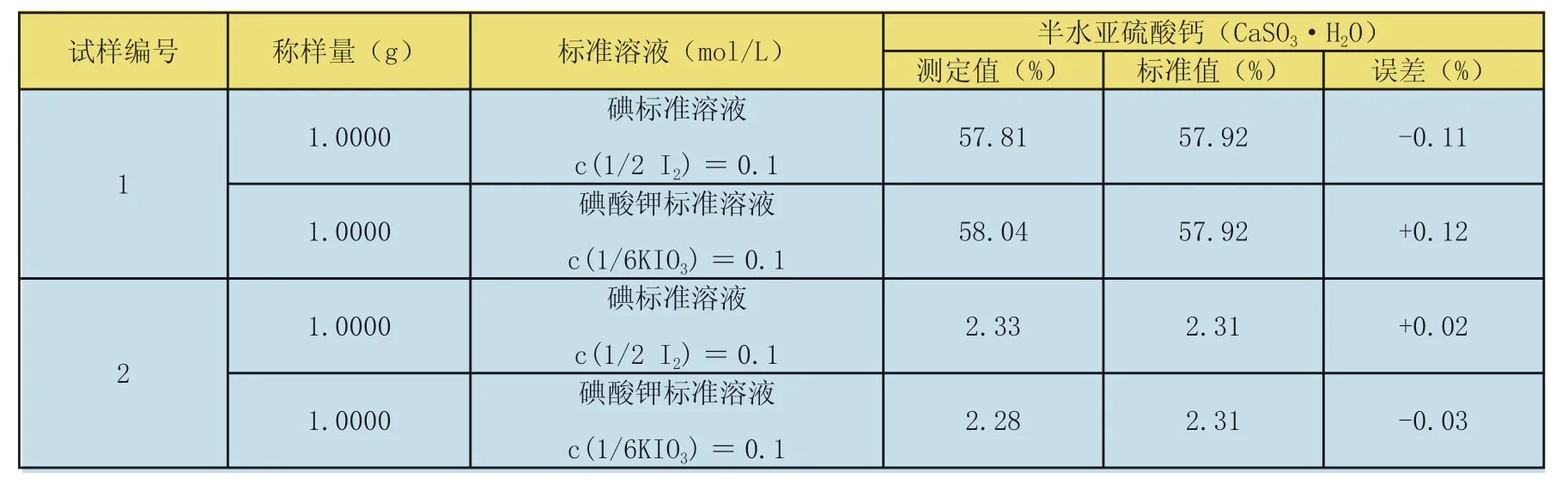
表6 碘标准溶液和碘酸钾标准溶液测定结果对比(以半水亚硫酸钙计)
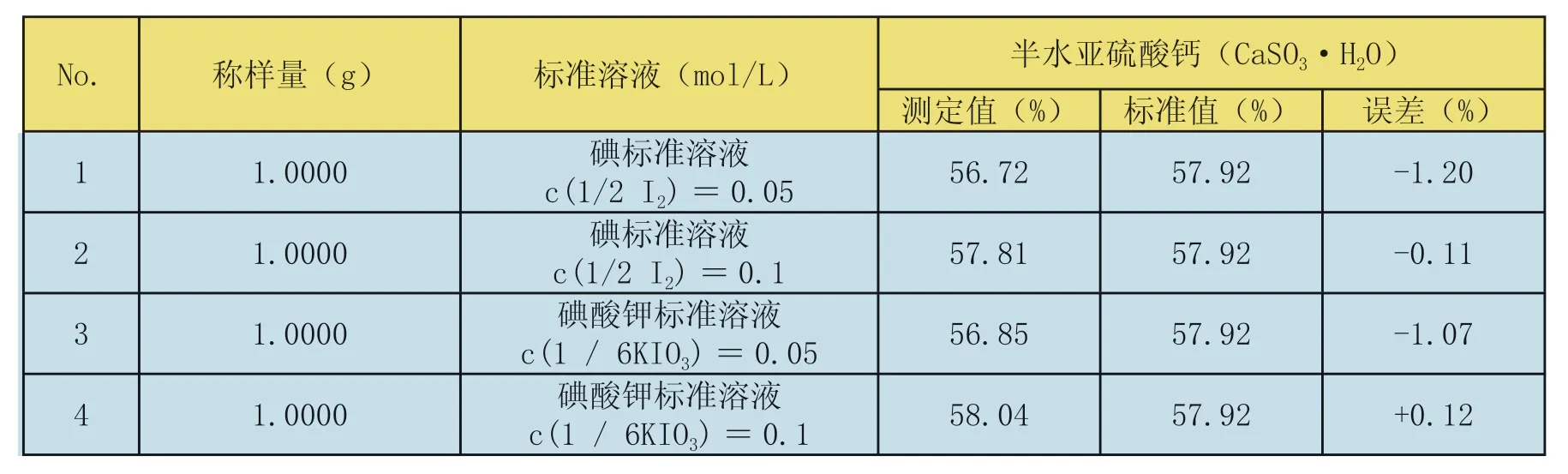
表7 不同浓度标准溶液对测定结果的影响(以半水亚硫酸钙计)
3.4 石膏中二氧化硫的试验条件优化
3.4.1 氧化剂的选择
称取约1g试样,精确至0.0001g,置于250mL干燥的带磨口塞的锥形瓶中,加入50mL水,摇动使试样分散,移入20.00mL碘标准滴定溶液(2.1.3)后摇匀,加入10mL硫酸(1+2),放入一根磁力搅拌棒,盖上瓶塞,把锥形瓶放在磁力搅拌器上,搅拌10min,于暗处放置5min。用水冲洗瓶塞和瓶壁,用硫代硫酸钠标准滴定溶液(2.1.4)滴定至浅黄色后,加入约2mL淀粉溶液,再继续滴定至蓝色消失。把碘标准溶液换成碘酸钾标准溶液进行测定,并对结果进行对比,见表6。
从表6可得出结论:采用碘酸钾标准溶液[c(1/6KIO3)=0.10 mol/L]和碘酸钾标准溶液[c(1/6KIO3)=0.1mol/L]的测定结果一致。
3.4.2 不同浓度标准溶液对测定结果的影响
采用碘标准溶液c(1/2I2)=0.05 mol/L和c(1/2I2)=0.1mol/L进行试验,返定滴定溶液分别为硫代硫酸钠标准滴定溶液c(Na2S2O3)=0.05mo1/L和c(Na2S2O3)=0.1mo1/L。用碘酸钾标准溶液c(1/6KIO3)=0.05 mol/L和c(1/6KIO3)=0.1mol/L进行试验,返定滴定溶液分别为硫代硫酸钠标准滴定溶液c(Na2S2O3)=0.05mo1/L和c(Na2S2O3)=0.1mo1/L。得到的测定结果见表7。
从表7可得出结论:采用碘酸钾标准溶液的配制[c(1/6 KIO3)=0.05 mol/L]和碘标准溶液的配制[c(1/2I2)=0.05 mol/L]的测定结果偏低,可能标准溶液的浓度低时氧反应不完全。所以标准溶液的浓度选择0.1mol/L。
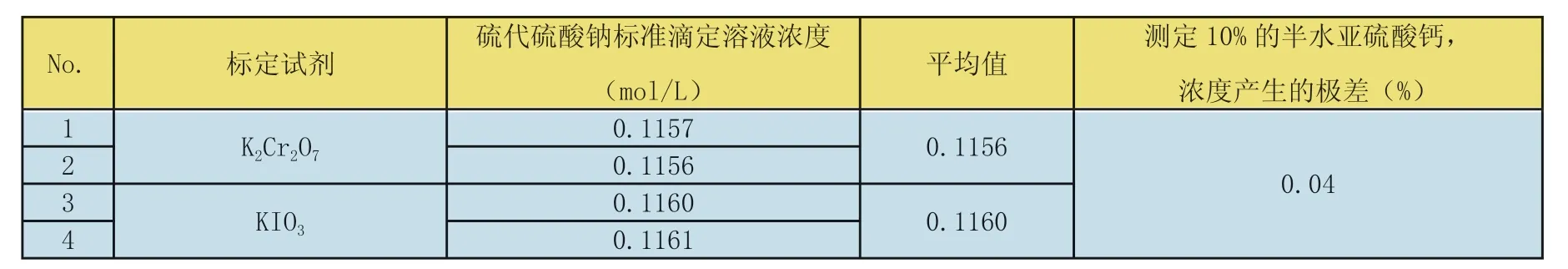
表8 标定硫代硫酸钠标准滴定溶液试剂的选择
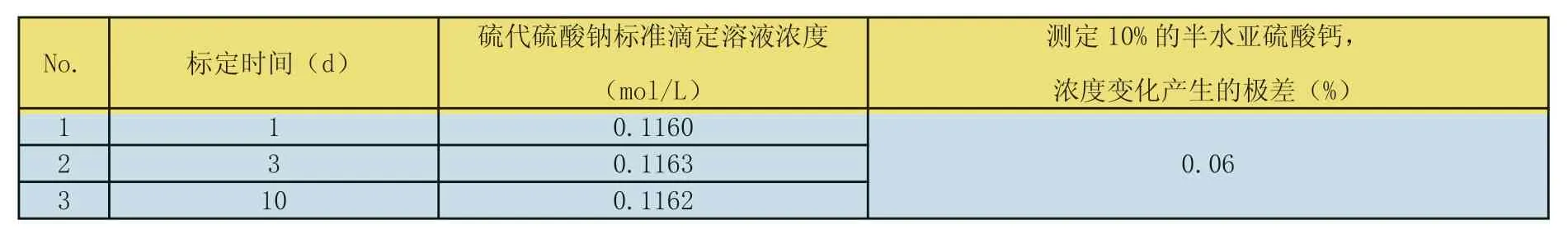
表9 硫代硫酸钠标准滴定溶液的稳定性
3.4.3 其他成分的干扰分析
本试验属于氧化还原反应,各氧化剂的标准电极电位如下:
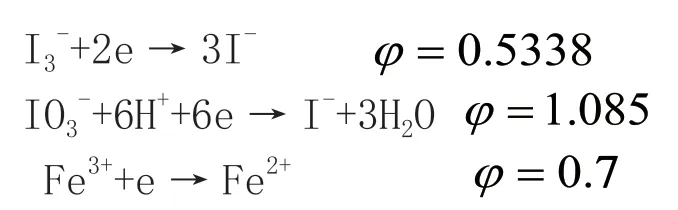
由于IO3-+6H++6e→I-+3H2O 标准电极电位φ=1.085较高,所以Fe2+等干扰成分增多,所以选择碘标准溶液作为氧化剂。
3.4.4 硫代硫酸钠标准滴定溶液的标定
(1) 标定试剂的选择
分别采用重铬酸钾(K2Cr2O7,基准试剂)和碘酸钾(KIO3),优级纯)标定硫代硫酸钠标准滴定溶液,标定的结果见表8。
从表8可得出结论:试验证明采用重铬酸钾(K2Cr2O7,基准试剂)和碘酸钾(KIO3)标定硫代硫酸钠标准滴定溶液,对测定结果的影响可忽略不计。考虑到测定终点的敏锐程度,采用重铬酸钾,由于绿色Cr3+的存在,终点前溶液呈暗灰色,终点不敏锐,另外Cr3+污染环境,所以采用碘酸钾作为标定试剂。
(2) 硫代硫酸钠标准滴定溶液的稳定性
不同时间段,对同一硫代硫酸钠标准滴定溶液浓度进行测定,得到表9。
从表9可得出结论:硫代硫酸钠标准滴定溶液放置1天后,已经基本达到稳定状态。
3.5 测定二氧化硫试验总结
3.5.1 测定二氧化硫试验步骤
称取约1g试样(m5),精确至0.0001g,置于250mL干燥的带磨口塞的锥形瓶中,加入50mL水,摇动使试样分散,移入20.00mL碘标准滴定溶液(2.1.3)后摇匀,加入10mL硫酸(1+2),放入一根磁力搅拌棒,盖上瓶塞,把锥形瓶放在磁力搅拌器上,搅拌10min,于暗处放置5min。用水冲洗瓶塞和瓶壁,用硫代硫酸钠标准滴定溶液(2.1.4)滴定至浅黄色后,加入约2mL淀粉溶液,再继续滴定至蓝色消失。
3.5.2 石膏中二氧化硫的计算
二氧化硫和半水亚硫酸钙的质量分数wSO2和wCaSO3⋅1/2H2O按式(2)或(3)计算:
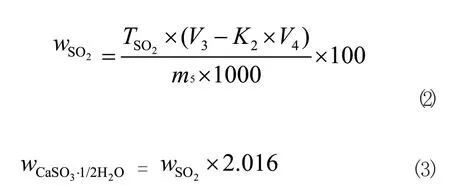
式中:
TSO2——碘标准滴定溶液对二氧化硫的滴定度,单位为毫克每毫升(mg/ mL);
V3——加入碘标准滴定溶液的体积,单位为毫升(mL);
V4——滴定时消耗硫代硫酸钠标准滴定溶液的体积,单位为毫升(mL);
K2——碘标准滴定溶液与硫代硫酸钠标准滴定溶液的体积比;
m5——试料的质量,单位为克(g);
2.016——二氧化硫对半水亚硫酸钙的换算系数。
4 总结
本文将石膏中三氧化硫的测定分为含有亚硫酸钙和不含有亚硫酸钙两中情况,若石膏中不含有亚硫酸钙,可直接采用常规盐酸溶解法测定三氧化硫。若石膏中含有亚硫酸钙,三氧化硫的测定方法采用过氧化氢氧化法测定的全硫减去二氧化硫的含量,而其中二氧化硫的测定可以采用碘量法,并对试样条件进行优化。此方法可以准确的测定工业副产石膏中二氧化硫和三氧化硫的含量,促进了工业副产石膏在各个行业中的应用,为企业节约成本的同时,实现了资源的循环利用。
[1] 王瑞海.水泥化验室实用手册. 中国建材工业出版社.2001。
[2] GB/T 176-2008 水泥化学分析方法。
[3] 《石膏和石膏制品的化学分析方法》ASTM C471M-01.2006。
[4] GB/T5484-2000《石膏化学分析方法》。
[5] 《石膏化学分析方法》JISR 9101.1995。
[6] 《石膏—测定结晶水含量》ISO 3052.1974。

