药品不良反应数据规范化研究
侯永芳
(国家食品药品监督管理局药品评价中心,北京 100045)
自全国药品不良反应监测网络运行(报告系统)以来,我国药品不良反应病例报告数据增长迅速,目前,报告数量已以百万计,但种种原因使得大量报告数据呈现为非规范化状态,在现有数据质量和数据状态下,不仅难以准确、快速地完成各种统计分析,难以快速为药品监管决策提供数据依据,还限制了信息的分析利用和进一步深入挖掘,某种程度上影响了药品再评价工作的效率和质量。笔者分析药品不良反应数据不规范表现形式和产生原因,提出提高数据质量的解决方法,为药品不良反应监测工作提供技术支持。
1 不规范数据表现形式
我国药品不良反应病例报告表以在线报告为主,网络报表共有数据49项(多个药品未重复计数数据项),其中结构化数据29个,非结构化数据项(可自由录入的数据项)20个。数据的不规范主要表现在非结构化数据项当中,笔者仅分析影响不良反应检索、统计、汇总和预警等涉及数据有效利用的主要数据项,包括药品不良反应名称、药品商品名、药品通用名、生产厂家、用药原因、原患疾病。主要不规范形式见表1。
2 不规范数据产生原因
数据不规范主要有两方面的原因,一是药品不良反应病例报告表填表时就是不规范的,这与我国报告形式的多样性、报告人员的素质、报告系统的不完善等因素有关;二是不规范数据产生后,缺乏有效的规范化手段和工具对数据进行规整。

表1 网络报表数据主要不规范形式
2.1 报告形式的多样性
目前,并非全部药品不良反应病例报告均由报告人直接通过全国药品不良反应监测网络在线填写,在没有网络报告条件情况下报告人可以以纸质报告或传真形式进行报告,然后由监测机构通过网络途径代为录入。报告人填写纸质报告表时缺乏辅助规范措施,容易出现习惯性用语和非医学用语等自由文本,加之录入人员和原始报告人缺乏沟通,增加了非规范化数据产生。
2.2 报告人员素质水平参差不齐
我国药品不良反应监测体系大陆地区已覆盖所有省份,纵深方向,各省大型医院(如三甲医院)到基层医疗服务机构(社区医院、村卫生室、个人诊所)、生产企业到零售药店亦均有报告,尤其需注意的是,基层医疗机构报告不在少数。在各类报告单位中,负责药品不良反应报告的具体人员专业背景呈现多样性的特点,有医学背景,有药学背景,甚至有的报告人员没有医药相关知识学习的经历。报告人员专业背景的差异,加之区域性习惯性差异,必然导致数据的多样性,造成数据的不规范。
2.3 报告系统不够完善
药品不良反应不规范数据主要体现在不良反应名称、药品商品名、药品通用名、用药原因、生产厂家、原患疾病等数据项,以上数据项除生产企业外,其他数据项在线录入时均可以检索的方式进行辅助录入(检索到的数据是规范的),但辅助录入的效果取决于后台支撑数据库的完善,而支撑数据库是否完善与支撑数据库的选择和其更新维护的及时性密切相关。目前,我国报告系统支撑数据库更新严重滞后,在报告辅助录入时无检索结果的情况较多,报告人只能以自由文本形式录入,增加了不规范数据产生的机会。
2.4 缺乏有效的规范化工具
对药品不良反应数据的规范化程度要求越高,对药品不良反应病例报告人员和报告工具的要求就越高,这与药品不良反应数据收集要及时、全面的要求是矛盾的。国际上通用的手段是,在不规范化数据产生之后,分析不规范数据的规律,建立不规范化数据与规范数据之间的对应关系(规则库),辅以信息化工具对数据进行规整和整理。目前,尚未建立针对全国药品不良反应数据的规则库和数据规范化工具,无法对数据进行及时有效处理。后期数据处理手段的缺失也是大量非规范化数据存在的原因之一。
3 数据规范化方法探讨
不规范数据的产生涉及报告人、报告形式、收集工具等多个方面,应建立一个科学、完备的数据规范化体系保证数据的规范性。报告人素质可以通过培训等方式提高,但短期内难以改变现状,限定全国单一网络报告途径亦不可行,因尚有无网络条件的区域或机构。笔者认为,完善报告系统和建立规范化工具是有效可行途径。
3.1 完善报告系统
完善药品不良反应报告系统,其核心是完善支撑数据库。我国药品不良反应报告系统支持数据库主要有药品名称数据库、药品不良反应数据库和原患疾病数据库,分别依据化学药品(原料、制剂)分类与代码、世界卫生组织术语集(WHO-ART)2001版和国际疾病分类-9(ICD-9)建立,尚未建立生产企业数据库。
3.1.1 完善药品名称支撑数据库 药品名称有数量多、更新快的特点,依据现有任何分类和标准均无法保证更新的及时性,笔者建议在现有选择分类和标准的基础上建立维护机制,一是与药品注册部门建立沟通机制,及时补充新数据,二是考虑到药品注册部门的药品名称信息同样存在更新滞后问题,可考虑对报告系统中的不规范药品名称数据进行核实验证,对于确实存在但未在药品名称数据库中收录的药品名称进行分类,将其补充到支撑数据库中。
3.1.2 完善药品不良反应术语和疾病名称支撑数据库目前,国际上在上市后药品不良反应监测中用于药品不良反应的常用术语集为世界卫生组织不良反应术语集(WHO-ART)和人用药品注册技术规范国际协调会(ICH)开发的国际医学用语词典(Medical Dictionary for Regulatory Activities,MedDRA)。MedDRA编码术语较多,编码比较复杂,尚未在国内医药行业全面推广和掌握,笔者建议继续使用WHOART,并对现行的WHOART进行更新和维护,对于我国使用频率较高尚未在该术语集中体现的术语,应将其纳入到药品不良反应术语数据库,使WHOART术语集更全面、准确和实用。考虑到MedDRA术语丰富,WHOART到MedDRA可桥梁映射,可以将使用WHOART术语的数据转换到MedDRA编码,可对引入MedDRA进行相关研究。疾病名称支撑数据库目前使用国际疾病分类-9,建议更新至最新版本,MedDRA在我国推广后,可考虑使用MedDRA作为疾病名称数据库。
3.2 建立规范化工具
完善报告系统、更新维护支撑数据库可减少但无法避免不规范化数据的产生。应在不规范数据产生后建立规范化机制对其进行处理。目前,我国报告数量已以百万计,靠人工形式进行数据规整效率低下,建议借助信息化手段辅助进行规范,建立规范化工具。规范化工具应能够以自动和手工两种方式对数据进行规整,自动化方式可依据规则库(不规范化数与规范数据的映射集合)对数据进行自动处理,对于没有“规则”的不规范数据,可通过手工方式进行规范,手工规范的同时能够“记忆”新规则,规整工具在运行过程中规则不断完善,规整效率和能力不断增强(整数据流程见图1)。
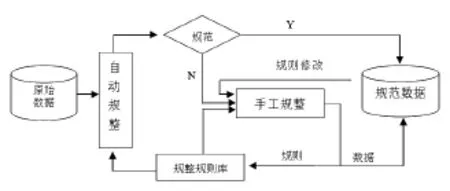
图1 数据规整流程图
药品不良反应数据规范化是一项长期、系统性的工程,其工作内容、数据量、难度都比较大,实施周期也比较长,需要循序渐进、逐步推进。需要注意的是,数据规范仅是报表数据质量提高的基础手段,能为数据的统计、汇总和报表等打下基础,但无法代替评价人员对每一份报表的真实性和准确性作出判断。

