与红外可视膜片钳技术相结合的南方鲇面叶脑片急性分离培养技术*
赵 磊,梁剑弦,龙天澄
(1.广州医学院生理教研室,广东 广州 510282;2. 中山大学生命科学学院,广东 广州 510275)
脑片培养作为一种短时间离体移植培养的制备技术,兼有在体实验和离体培养的优良特点,是处于细胞培养与动物模型之间的实验平台。不仅满足体外培养实验条件易于控制、实验过程易于观察的要求,保持了在体神经细胞之间及神经细胞与非神经细胞之间动态联系,又具备了与体内组织结构和环境更贴近的优势。脑片实验排除了血压、温度、电解质、血脑屏障等因素的干扰,仅通过改变人工脑脊液或气体的成分,实现了对标本环境的控制。随着脑片培养技术的不断改进,目前国内外建立了新生鼠和成年鼠的海马、大脑皮质、中脑黑质、下丘脑[1-4]等的脑片培养技术,但是在鱼类的脑片培养、味觉中枢神经元的电学特性、信号编码的微回路、膜片钳方法的研究等进展较慢[5-7]。通过组织学、神经束路追踪和电生理学记录等方法的研究已知面叶作为初级中枢在鱼类口外味觉中的重要作用[8-10],并初步确立了延脑味觉初级中枢的构筑和大致功能。鱼类味觉的编码方式和调控机制极其复杂,目前的研究结果虽然能部分的回答鱼类味觉与行为方面的问题,但对于全面了解鱼类味觉的生理机制,解读味觉信息的编码与动物行为远远不够。外周皮肤味蕾感受器不同种类及其分布、外周传入神经编码机制可能减少味觉信息的冗余,但是对于关系到动物行为的味觉信息处理,中枢神经元的活动更为重要。但不同文献中脑片急性分离和培养的实验条件(培养温度、不同配方的脑脊液等)均存在各种差异[11-12]。本研究选取广东省普遍养殖的经济鱼类—南方鲇,分别建立各种实验条件,在改变时间、温度、脑脊液配方等实验条件基础上,运用组织化学和脑片膜片钳技术观察脑片活性的变化,旨在探讨影响鱼类脑片体外培养的诸多因素,有助于深入研究鱼类延脑面叶中枢神经元的基本功能,多层次多方位分析鱼类味觉信息编码与味觉调控的机理,为脑片实验技术提供一定的理论依据。建立的膜片钳技术有利于对延脑初级味觉中枢神经元的基本电生理特性进行观察,并对涉及其中的离子通道结构及功能进行深入研究,同时可以分析基本的神经递质对其的影响。
1 材料和方法
1.1 实验动物
半月龄南方鲇SilurusmeridionalisChen,10~20 g/尾,体长5~8 cm,雌雄不拘。购于广东省水产研究所南海养殖基地。实验室24 h循环水中饲养。
1.2 脑脊液(ACSF)配方
标准ACSF(mmol/L):NaCl,124;KCl,2;MgSO4,1.6;NaHCO3,24;葡萄糖,10;CaCl2,2;KH2PO4,1.25。蔗糖+ACSF:标准ACSF中,加入150 mM 蔗糖。TU+ Vc+ACSF:NaCl,124;KCl,2;MgSO4,1.6;NaHCO3,24;葡萄糖,10;CaCl2,2;KH2PO4,1.25;Vc,0.4;硫脲,0.8。HEPES+ ACSF:NaCl,124;KCl,2;MgSO4,1.6;NaHCO3,24;葡萄糖,10;CaCl2,2;KH2PO4,1.25;4-羟乙基哌嗪乙磺酸,50。HEPES+Vc+TU+ kynurenic acid +低钙ACSF:NaCl,124;KCl,2;MgSO4,1.6;NaHCO3,24;葡萄糖,10;CaCl2,0.2;KH2PO4,1.25;Vc,0.4;硫脲,0.8;4-羟乙基哌嗪乙磺酸,50;犬尿氨酸,1。
1.3 面叶脑片的制备
于含有磺酸甲烷(MS 222:150 mg/L)的试验水槽中麻醉南方鲇2~3 min。迅速开颅取全脑,置于含混合气(95%O2+5%CO2, 以体积分数计)冰冻ACSF(pH7.4)中冷却清洗1 min,分离出延脑,4 ℃震动切片机下制成300 μm面叶冠状切片。脑片在3 mL ACSF中持续培养4 h,每组5片,互不重叠,持续通入混合气。每次留存部分脑片于切片后立即TTC染色,若出现着色偏浅或明显损伤,该批次标本即不予采用。
1.4 TTC染色
面叶脑片放置在2% TTC+脑脊液中,避光温浴(34 ℃)相应时间段后,取出脑片用生理盐水漂洗,滤纸吸去表面水分后称湿重,以1 g/20 mL加入抽提液(乙醇∶二甲亚砜= 1∶1) ,在密闭容器内避光放置24 h,摇匀后取100 μL至96孔板,在波长490 nm下,用酶标仪测定各孔光密度(A490值) 。只通混合气( 95% O2+5% CO2,以体积分数计)的脑片测得A490值作为正常对照用来计算各实验组脑片TTC染色下降百分率。
脑片TTC染色下降率(组织损伤率) =(1-A490损伤/A490对照) ×100 %
1.5 不同培养时间对面叶脑片活力的影响
将面叶脑片别放入3 mL不同配方ACSF中培养。分别于 5,10,15,30,60,120,180,240 min培养时间取出样本TTC染色,计算组织损伤率 (%)。同时红外倒置显微镜下观察细胞数量和形态后制成7 μm石蜡切片,Nissl染色。
1.6 不同培养温度对面叶脑片活力的影响
将面叶脑片分别置于3 mL不同温度(18,22,25,30 ℃)不同配方ACSF中孵育3 h,温度浮动范围保持在0.15 ℃ 之内,随后 TTC染色,计算组织损伤率(% )。同时红外倒置显微镜下观察细胞数量和形态后制成7 μm石蜡切片,Nissl染色。
1.7 面叶脑片电生理特性检测
选取25 ℃,30 min,HEPES+Vc++TU+ kynurenic acid +低钙脑脊液中培养的脑片,恒流泵持续向脑片浴槽灌注含95%O2+5%CO2(以体积分数计)的ACSF,流速为 1~2 mL/min,脑片浸没于液面下1~2 mm,室温25 ℃。拉制好的电极尖端直径约1~2 μm,充灌电极内液后阻抗为 2~5 MΩ。内液成分(mM) : KCl,140;CaCl2,1;MgCl2,2;EGTA,11;HEPES,10;ATP,2(pH 7.2)。所有电刺激均在胞体内给予。数据采集、记录和分析采用Axon laboratory 提供的软件包Clampex9.0进行。
2 结 果
2.1 不同配方脑脊液对面叶脑片活力的影响
与同一时间标准ACSF培养的脑片相比,蔗糖+ACSF,TU+ Vc+ACSF,HEPES+ACSF和HEPES+Vc++TU+kynurenic acid +低钙ACSF培养液均不同程度的抑制脑片A490nm值的降低,而各组脑片形态有显著差异 (图1)。结果表明,HEPES+Vc++TU+kynurenic acid +低钙ACSF培养的脑片中神经元细胞明显且紧密排列,膜完整而光滑,形态正常有突起,胞体成圆形、椭圆形和梨形,维持存活时间长。
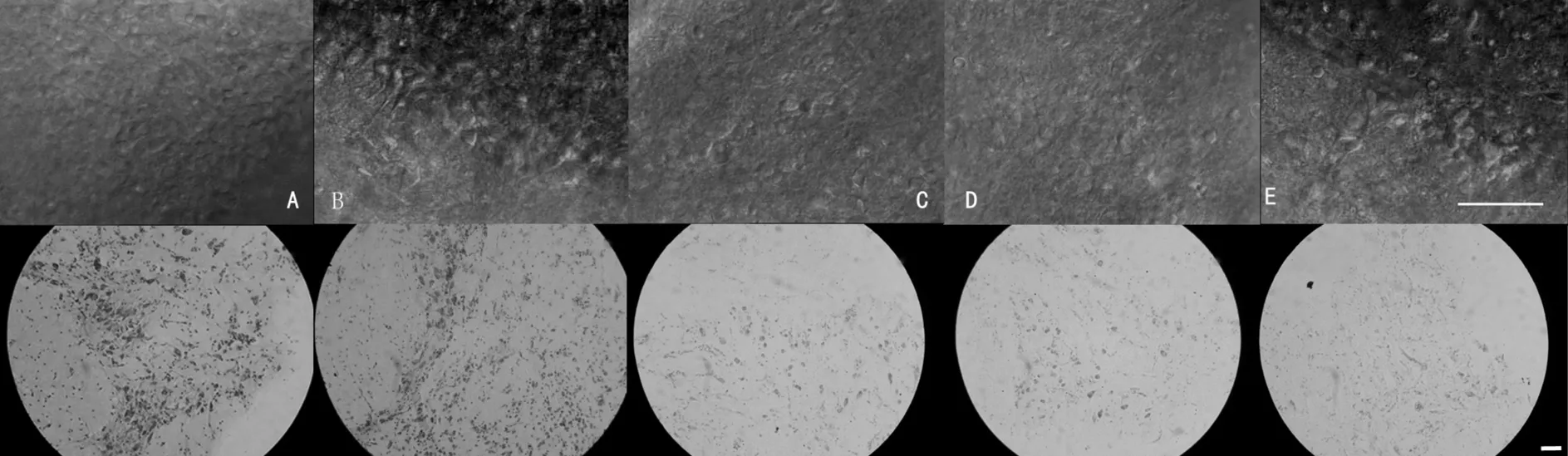
图1 30 min,25 ℃不同培养液中的南方鲇面叶脑片
(上图为红外可视显微镜下的观察;下图为nissl染色图片。标尺为100 μm; A:HEPES+Vc++TU+kynurenic acid +低钙ACSF; B: HEPES+ACSF; C: TU+ Vc+ACSF; D: 蔗糖+ACSF; E: 标准ACSF)
2.2 不同培养时间对面叶脑片活力的影响
随着培养时间的延长,面叶脑片TTC染色A490 nm值逐渐下降。2 h后损伤率均较显著,标准ACSF,蔗糖+ACSF,TU+ Vc+ACSF,HEPES+ACSF,和HEPES+Vc++TU+kynurenic acid +低钙ACSF培养液中培养脑片的损伤率分别为:(61.2±5.07)%,(59.9±6.14)%,(52.9±5.23)%,(51.6±4h97)%和(50.2±4.17)%。本实验随后进行的电生理试验时间均小于2 h,损伤程度较为温和(图2)。
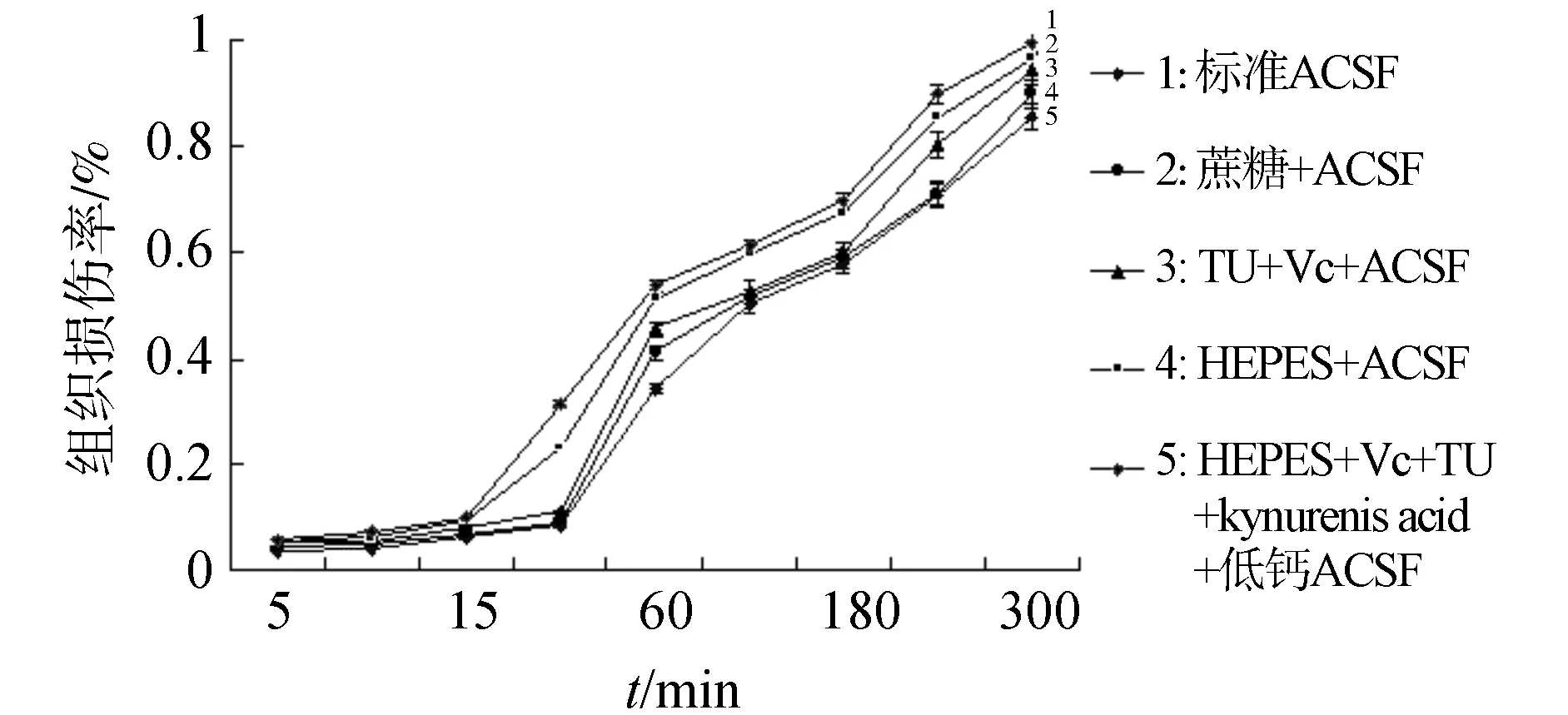
图2 不同培养时间对脑片活力的影响
2.3 不同培养温度对面叶脑片活力的影响
脑片在18,22及30 ℃ACSF中孵育2 h后,与25 ℃培养的脑组织相比,均大幅度降低脑片TTC染色A490nm值,造成不同程度的损伤。18 ℃与20 ℃下培养脑片损伤程度相近,无明显区别(P>0.05) ,但与30 ℃相比,较低温度时脑片损伤程度明显减轻(P< 0.05)。25 ℃脑组织活力明显比其他温度高,且接近鱼类在体脑组织温度,试验结果较为可靠,可以确定为本实验比较理想的造模温度 (图3)。
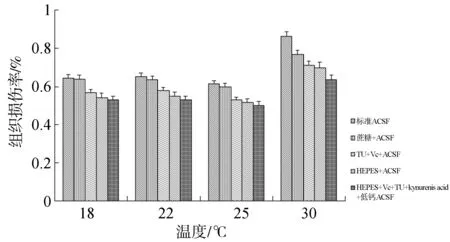
图3 不同培养温度对脑片活力的影响
2.4 面叶脑片的电生理学特性
在全细胞电流钳模式下将膜电流钳制在0 pA,使细胞处于静息状态。根据自发放电频率及动作电位特征分为两大类,分别对应于形态学上的梨形和椭圆形神经元。测定两种类型神经元的静息电位。结果表明两种类型神经元的静息电位无明显区别(P>0.05)。椭圆形神经元为(-68±3)mV(n= 18),梨形神经元为(-70±4) mV(n=25)。而前者的膜电容为(32±6 pF)(n=15)显著大于后者的(15±4pF)(n= 20)(P< 0.05)。在记录的细胞中未观察到自发放电现象,但两种细胞均对去极化电流刺激产生动作电位,椭圆形神经元的诱发放电频率(5±3) Hz(n= 5)小于梨形神经元(10±5) Hz(n= 5)(P< 0.05)(图4)。
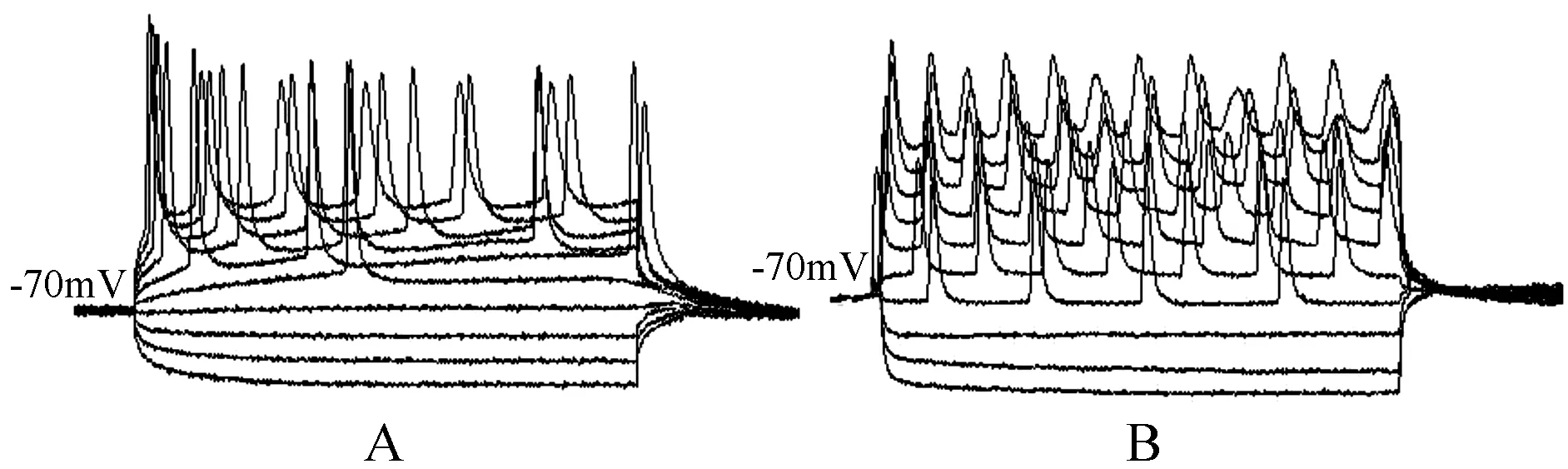
图4 面叶中椭圆形(A)和梨形(B)神经元诱发放电的比较图
3 讨 论
虽然细胞培养和动物模型的制作已发展的非常成熟,可用于在体生理和病理研究,各自都不可避免地存在着一定缺陷。细胞培养虽具备实验条件易于控制,易于进行操作,经济高效等优点,但是脱离了体内环境,使其丧失了组织结构和细胞之间的联系以及一部分与之相关的生化特性;动物模型虽能够得到整体病理生理反应,但对于实验条件的操控非常受限且由于受到体内多种因素的影响很难对单一因素进行分析。脑片培养正是在细胞培养与动物模型之间建立的实验平台,保留与体内相近的神经发育形态及功能特征,允许对可能的调控因子进行操作,并且结合免疫组化及生理学方法有利于更全面了解神经发育机制。而离体培养的脑片包含了与在体脑组织相同的细胞种类及三维空间结构,保存了正常完整的突触回路、受体分布、递质传递和其他生理功能。体外培养48 h内依然保持良好的活性,离子通道性质不会发生变化。
但是离体脑片经过组织分离和切片等过程,环境与在体时有了较大的改变。切制过程中组织损伤、缺氧等引起不同程度的病理变化,比如树突、轴突肿胀,神经元之间形成含水腔隙,这些变化在刚切成的脑薄片较严重。但这些可以通过脑片的孵育培养过程,基本得到恢复。ACSF不含蛋白质、氨基酸、维生素、激素等物质,和天然脑脊液的成分有一定的差异。因此在脑片培养过程中,时间、温度、渗透压、酸碱度等的控制以及抗缺氧、酸化的处理尤为重要。
Nissl染色结果显示,经稳定2 h后的脑片细胞有规则地紧密排列,细胞大而明显,膜完整光滑,胞体呈椭圆型;细胞中央有一个大而圆的细胞核,核异染量少,故着色浅。个别区域有零星散在环死神经细胞。说明孵育初期由于脑片制备过程中的机械损伤导致部分细胞水肿死亡,随着孵育时间增长到2 h,损伤死亡的细胞被清除,细胞结构变得更加清晰。温度对神经细胞的生长有重要影响。南方鲇延脑神经细胞在 18~28 ℃之间均能生长,但在 25 ℃时脑片的色泽最好,颜色呈深灰色,神经纤维和胞体区的分界清楚。哺乳动物神经细胞培养一般是在 37 ℃,与南方鲇延脑神经细胞最适生长温度显然不同。由于南方鲇常年生活在长江中下游水体环境的中下层,其外周环境温度一般在25 ℃左右。这说明了外周环境温度与鱼类神经细胞生长之间有密切关系。而且温度降低,不仅能提高溶氧的分压,同时降低代谢速度,有利于神经元在缺葡萄糖后的恢复[11-12]。这都有利于短时间内保持标本的活性。
早期研究发现适当的提高渗透压能有效的阻止神经元水肿,有助细胞功能恢复。试验中添加蔗糖和HEPES均有提高溶液渗透压的作用,神经元水肿得到抑制。但随着培养时间增加,添加蔗糖ACSF的细胞明显出现皱缩。添加HEPES没有变化。这说明脑片神经元水肿与局部环境pH的变化有关。NaHCO3-CO2缓冲对的缓冲能力不强,细胞呼吸以及死亡时内容物的释放,乳酸盐的产生等都会造成局部pH变动,当pH的变化超过神经元能承受的限度就会影响细胞的生理状态,甚至加速细胞死亡[13-14]。HEPES(4-羟乙基哌嗪乙磺酸)是一种广泛应用的缓冲剂,其缓冲能力强大( pH6.8~8.2) 可以减缓孵育液中细胞代谢产物积累所致的酸化速度同时有效稳定细胞周围环境pH,受外界因素影响小,不形成缓冲剂—金属离子复合物,配合适当的高渗效果,从而阻止神经元水肿。
谷氨酸是哺乳动物中枢神经系统中最重要、脑内含量最高的一种内源性兴奋性氨基酸,具有许多生理功能和病理生理学作用,如在学习、记忆、神经元的损伤、 癫痫、 神经元退行性疾病中具有重要作用。因此探讨脑片培养过程中谷氨酸对神经元的损伤机制有重要意义,因为这与脑片的缺血、 缺氧等许多致死因素较为敏感[15-16]。针对内源性谷氨基酸对神经元的损伤,在HEPES高渗ACSF溶液中添加了谷氨酸受体的广泛性抑制剂——犬尿氨酸KYNA 1mM。KYNA是在人类和啮齿类动物的星形胶质细胞和神经元中由KAT催化KYN不可逆生成的,通过拮抗大脑N-甲基-D-天冬氨酸(N-methyl-D-aspartate NMDA)受体谷氨酸盐结合位点成为内源性神经系统兴奋性氨基酸受体的广泛拮抗剂。它是避免兴奋性氨基酸损伤脑组织及神经系统的有效保护因子,具有抗惊厥、抗痉挛的作用。当浓度相对较低时,KYNA是甘氨酸受体的拮抗剂。浓度相对较高时,KYNA是NMDA及AMPA受体的拮抗剂。石蜡切片观察统计,没有添加KYNA的ACSF,脑片神经元由于损伤细胞释放的内源性谷氨酸,在培养过程中对大部分谷氨酸敏感神经元造成不可逆的损伤。
维生素C (Vitamin C)是一种重要的水溶性维生素及抗氧化剂,相对分子质量较小能直接进入细胞内,直接或间接清除氧自由基,阻断脂质过氧化反应,是天然的氧自由基清除剂。其基本功能是通过在酶系中传递电子,以保持离子平衡,参与氧化还原反应,因而能对抗氧自由基的损伤,保护细胞膜及亚细胞器。已知维生素 C可促进鼠胚神经上皮细胞的分裂及损伤后的修复,还可使神经上皮细胞膜上的糖蛋白维持正常水平,使细胞黏着、识别和迁移准确进行。大剂量维生素C可以清除脑组织中的自由基,减轻脑细胞损伤[17-18]。在ACSF中添加Vc以保护神经元活性起到抗氧化的作用。由于Vc在水溶液中不稳定,溶液中还需要加入适量的TU(硫脲)防止Vc变质。相关的手术器具,溶液配制、盛装器具等使用前也要经过相关处理。
参考文献:
[1] CONNELY C A, CHEN E, COLQUHOUN S D. Metabolic activity of cultured rat brainstem, hippocampal and spinal cord slices [J]. Neuroscience Methods, 2000, 99 (1):1-7.
[2] 刘振伟, 李立君, 刘传缋. 海马脑片盲法膜片钳全细胞记录技术[J]. 生理学报,2001, 53(5):405-408.
[3] 王红,蔡浩然. 细胞外Ca2+对爪蟾脑片神经元微抑制性突触后电流的调制[J]. 生理学报, 2003, 55(5):599-606.
[4] 姚小红, 万子兵, 隋建峰, 等. 大鼠内侧膝状体腹侧部神经元形态和电生理特征研究[J].第三军医大学学报, 2004, 26(8):697-699.
[5] CHARLES F. Taste and tactile responsiveness of neurons in the posterior dicencephalon of the channel catfish [J].Compare Neurology, 1993, 337:419-430.
[6] CHARLES F. Axonal projection patterns of neurons in the secondary gustatory nucleus of channel catfish [J].Compare Neurology, 1996, 365:585-593.
[7] CHARLES F. Convergence of oral and extraoral information in the superior secondary gustatory nucleus of channel catfish.[J]. Brain Research, 2000, 588:201-211.
[8] 赵磊,周文良,龙天澄.南方鲇上下颌须神经分支的电生理研究[J].中山大学学报:自然科学版,2007,46(6):69-74.
[9] 赵磊,梁剑弦,龙天澄.鲇鱼延脑初级味觉中枢的比较研究[J].中山大学学报:自然科学版,2005,44(2):127-129.
[10] 赵磊,周文良,龙天澄.南方鲇面神经分支有关的外周味觉感受器和神经中枢的研究[J].西南大学学报:自然科学版,2007,29(12):35-40.
[11] KURIHARA E, ISHIKAWA A, TAMAKI N, et al. The protective effect of hypothermia on the recovery of neural activity after deprivation of oxygen and glucose: study of slice from the hippocampus and superior colliculus [J]. Neuroscience Letters, 1996, 204:197-200.
[12] KOHLING R, ALUCKE H, SPECKMANN E J. A portable chamber for long-distance transport of surviving human brain slice preparations[J]. Neuroscience Methods,1996, 67:233-236.
[13] DUNCAN G, GREGOR M, CHESLER M, et al. HEPES prevents edema in rat brain slices [J]. Neuroscience Letters, 2001, 303:141-144.
[14] EUGENE L, ROBERTS Jr, CHING Ping Chih. The pH buffering capcity of hippocampal slice from young adult and aged rats [J]. Brain Research, 1998, 779:271-275.
[15] BEN A, BAHR J, JENNIFER B, et al. Survival signaling and selective neuroprotection through glutamatergic transmission[J]. Experimental Neurology, 2002, 174:37-47.
[16] RALPHIEL S, PAYNE Y, AVITAL S, et al. Cell swelling exacerbates hypoxic neuronal damage in rat hipocampal slice [J] . Brain Research, 1996, 723:210-213.
[17] TVEDEN-NYBORG P, JOHANSEN L K, RAIDA Z, et al. Vitamin C deficiency in early postnatal life impairs spatial memory and reduces the number of hippocampal neurons in guinea pigs[J]. American Journal of Clinical Nutrition, 2009, 90(3):540-546.
[18] RICEL M E. Use of ascorbate in the preparation and maintenance of brain slices [J].Methods:A Companion to Methods in Enzymology, 1999, 18:144-149.

