尸体供者小肠、肝和肾脏器联合切取及保存技术
李元新 李幼生 李民
随着实体器官移植技术在我国的广泛应用和移植后疗效的显著提高,越来越多种类的大器官移植(如肾、肝、心、肺、胰腺、小肠)在我国已成为某些器官终末期疾病的一种重要治疗手段。各类大器官移植的需求(特别是肾移植和肝移植)大幅度增加,我国已成为继美国之后的全球器官移植第二大国,供体器官短缺也成为严重制约我国器官移植事业发展的瓶颈[1]。同一尸体供者仅切取1个或2个脏器的时代已经过去,特别是随着我国胰腺移植和小肠移植事业的发展,如同美国一样,同一尸体供者同时切取多个腹腔脏器[2]甚至胸腔脏器,以同时满足多个不同的受者接受不同种类器官移植必将成为今后移植脏器切取的主流。我们在近年连续完成5例小肠移植同时,结合我国的器官移植特点,成功地建立尸体供者的全腹腔脏器切取和保存技术,共完成8次供体切取手术,并随后应用这些供器官成功地进行了小肠移植、肝移植和肾移植等29次。所建立的技术也可应用于胰腺移植、腹腔多器官簇移植和腹腔多个器官联合移植时器官的切取。
1 对象与方法
2007—2009年间共进行8次尸体供者全腹腔脏器切取手术,并将所切取脏器修剪成多个移植脏器以备小肠移植、肝移植和肾移植用,其中3次为与切取心脏和肺的胸腔脏器供体手术组合作共同完成供器官的获取工作。
1.1 脏器切取
若不同供器官切取医生来自不同的移植中心,在术前均须与肝脏和肾脏供体手术组术者就手术的详细步骤和技术细节进行仔细沟通,以取得互相理解和术中支持。
供者全腹腔脏器联合切取主要步骤如下:所有供者在术前均肝素化,供者心跳停止后,取腰部垫高仰卧位,常规消毒、铺无菌巾单,取腹部大“十”字手术切口,纵切口上至剑突下、下至耻骨联合,横切口经脐至两侧腋中线。进腹后于腹腔内倒入大量碎冰,迅速将下腹部小肠襻推向右上方,打开后腹膜,分离出腹主动脉,于左、右髂血管分叉处上方穿牵引带,剪开腹主动脉前壁并向头侧行腹主动脉插管(导管为改装带气囊的24号导尿管,顶端开口封闭,气囊以下导管侧壁作2~3个侧孔),插入深度16~18 cm,气囊位于腹主动脉腹腔干开口以上,注入20 mL生理盐水充盈气囊,以堵塞腹主动脉近心端。经腹主动脉插管快速灌流注0~4℃高渗枸橼酸-腺苷(hypertonic citrate-adenine,HC-A)肾保存液 1500 mL,灌注压力为 9.8 kPa(100 cm H2O)。灌洗开始后在腹主动脉插管水平处打开下腔静脉,插入引流导管作为灌洗液流出通路,导管另一端下垂置于手术台下容器内。8次供者切取手术中打开左侧后腹膜,寻找并行肠系膜下静脉插管进行门静脉系统灌注5次(见图1);另3次游离胰颈部后方,显露出脾静脉汇合处上方的门静脉并横断,从近端插管进行门静脉系统灌流,远侧断端作为肠系膜上静脉的流出道,门静脉系统亦灌注HC-A肾保存液约1000 mL,灌注压力为9.8 kPa。腹腔脏器色泽转为苍白、温度下降后,改用 0~4℃ University of Wisconsin(UW)液经腹主动脉继续灌注约1000 mL,经门静脉系统导管灌注约500 mL。
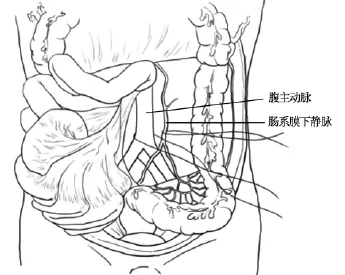
图1 全腹腔脏器原位灌注、整块切取的灌注血管准备。游离肾下腹主动脉,可行经腹主动脉插管,注入冷器官灌洗保存液以灌注全腹腔脏器;游离肠系膜下静脉,以备插管灌注门静脉系统
游离肝周韧带,8次手术中,在术中自胆囊底部穿刺抽净胆囊内残存的胆汁,并以UW液(20 mL)冲洗胆囊6次;另2次在全腹腔脏器切取下来后,于手术现场离体进行胆囊灌洗。于髂总血管水平切断双侧输尿管,并妥善保护。血管灌注的同时应用直线型切割缝合器分别在幽门下方及回肠末端离断幽门及末端回肠并关闭之(见图2)。充分游离全结肠和全胃,分别置于手术野外(见图3)。在充分保护腹腔脏器前提下,将剩余腹腔脏器于腹膜后分别自左右两侧向中间掀起,游离至脊柱旁。膈下切断腹主动脉及下腔静脉,沿脊柱前方由上向下,将腹主动脉、下腔静脉、肝、胰腺、脾和十二指肠、空回肠、双侧肾及输尿管一并切取,立即放入盛有0~4℃ UW液的器皿中。同时切取髂动、静脉,颈动、静脉及锁骨下动、静脉以备受者移植术中架桥用,一并置入有冰块的保存罐中运送。
1.2 脏器分离
在0~4℃ UW液中将整块切取的肝、小肠、双肾、胰腺、脾根据移植方案进行分离修整。将所切取的移植物的腹主动脉背侧正中剪开,显露出腹腔干、肠系膜上动脉及左右肾动脉的开口,此时应注意检查有无变异肝、肾动脉。在肾动脉与肠系膜上动脉开口之间劈开动脉袖片,暴露左、右肾静脉,于左肾静脉上缘横断下腔静脉,将双肾移植物与肝、胰腺、小肠、脾移植物各自分离,前者交予肾脏供体获取组置入0~4℃UW 液中保存、转运,再按常规方法进行修整。仔细检查剩下移植物,在确认没有从肠系膜上动脉根部发出的右侧副肝动脉或肝总动脉变异的前提下,于腹腔干和肠系膜上动脉之间离断腹主动脉壁,于胰腺上缘切断门静脉、胆总管,将肝移植物与小肠胰腺移植物分离(见图4)。肝移植物置入0~4℃ UW液中并交予肝脏供体获取组保存、转运,再按肝移植常规方法进行修整。
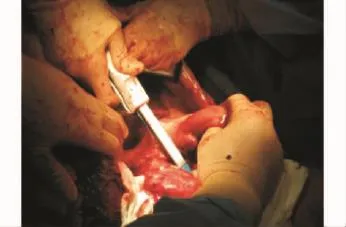
图2 应用直线切割闭合器于幽门处横断胃,于回盲部横断末端回肠
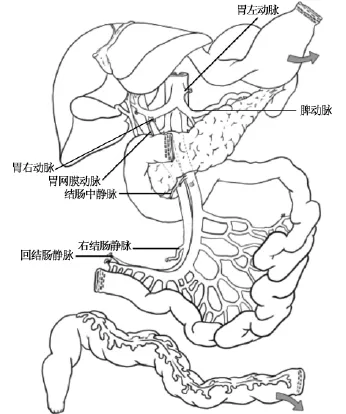
图3 充分游离全结肠和全胃,分别置于手术野外
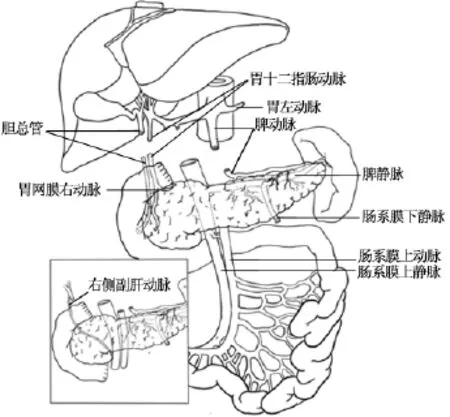
图4 肝移植物与小肠胰腺移植物的分离。打开腹主动脉后壁,于腹腔干和肠系膜上动脉间横断腹主动脉,于胰腺上缘横断胆总管、门静脉、胃十二指肠动脉和脾动脉,将肝移植物从器官簇上分离。如发现发自肠系膜上动脉的右侧副肝动脉,则右侧副肝动脉起始部近端的肠系膜上动脉也要留给肝移植物
小肠移植物修整时,首先自肠系膜上动脉置管,持续灌注4℃的 UW 液约500 mL,灌洗压力9.8 kPa。保留肠系膜上动脉开口周围的部分腹主动脉壁(carrel patch),清除肠系膜上动脉周围的结缔组织,解剖出肠系膜上动脉长度约3 cm。分离开留下的胰腺、十二指肠和脾一并切除之,同样解剖出肠系膜上静脉长度约3 cm(见图5)。妥善结扎肠系膜两侧的血管,防止血管再通时出血。修剪出髂动、静脉(包括髂总、髂内、髂外血管),颈动、静脉(包括颈总、颈内、颈外血管)及锁骨下动、静脉,选择长度和口径适合的动、静脉血管作为小肠移植手术中架桥用的血管移植物[3]。
8次供者切取手术中,在供者手术现场进行肝、小肠和肾移植物分离3次;现场分离双肾和肝小肠移植物,将肝小肠移植物转运至小肠移植受者手术室进一步分离2次;将切取的所有腹腔脏器转运至小肠移植受者手术室进一步分离3次。
1.3 脏器保存
切取和灌洗完成的整块腹腔脏器或已分离下来的供者器官置入无菌密封容器或塑料袋内,完全浸泡在0~4℃ UW液中,放入0~4℃保温箱内保存,以备快速转运或受者手术时植入。
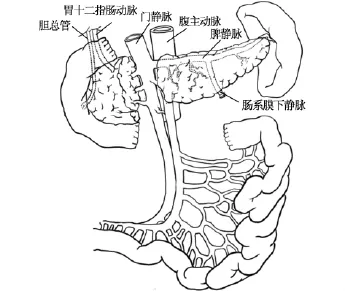
图5 于肠系膜上静脉前方横断胰腺,仔细结扎门静脉和肠系膜上静脉发往胰十二指肠细小血管分支,分离并去除胰腺与十二指肠,解剖出肠系膜上静脉长度2~3 cm
2 结果
共进行8次全腹腔脏器联合切取手术,从供者手术开始至建立0~4℃低温灌注的平均时间为(1.44±0.44)min(1~2 min),全腹腔脏器切取平均时间为(15.63 ±1.63)min(13 ~18 min)。
8次全腹腔脏器切取成功获得8具小肠移植物、8具肝移植物和16具肾移植物,经修整后共进行29次移植手术:5次单独小肠移植、8次肝移植和16次肾移植。有3具小肠移植物未移植的原因为:1次因受者急性胰腺炎发作;1次因复查供受者血型不合而放弃进行小肠移植的受者手术;另有1次为同一例小肠移植受者在获取并修整出的2具小肠移植物中选择条件较好的1具移植物进行小肠移植。因此共作5次小肠移植受者手术。
5例完成受者手术的小肠移植物缺血再灌注损伤轻,术后移植肠功能好,受者分别于移植后2~4周内完全摆脱全肠外营养[4]。术后2~3 d电话随访上述同时参加获取脏器的肝移植和肾移植中心,8例肝移植和16例肾移植受者的移植物缺血再灌注损伤较轻,移植脏器功能均良好。
3 讨论
在20世纪80—90年代初,我国的“器官移植供者”实际上是“肾移植供者”的同义词,但随着肝移植事业的发展,尸体移植脏器的获取已发展为肝肾联合切取的标准方式。作为继美国之后的世界器官移植第二大国,我国胰腺移植、小肠移植和腹腔多器官簇移植将会迎来一个大发展的时期,尸体供者的全腹腔脏器联合切取也将在一定程度上缓解供器官严重短缺的现状。
3.1 供器官切取
尸体供者的全腹腔脏器的联合切取技术必须满足以下4个条件:其一是在移植脏器联合切取过程中,不增加移植肝和移植肾的损伤风险;其二是不显著增加移植物的缺血时间,特别是热缺血时间;其三是对切取的脏器特别是肝的灌注效果没有显著影响;其四是联合切取的器官簇经分离后,各个器官移植物的血管能够或通过血管架桥后能够完成器官移植血管吻合要求,特别是肝、胰腺和小肠这3个器官共同使用腹腔干和肠系膜上动脉这2根血管。
早在20世纪80年代,美国匹兹堡(Pittsburgh)大学的Starzl开创性地建立膈肌以下的全腹腔脏器联合切取技术[5-7],匹兹堡大学的Abu-Elmagd进一步发展了这一技术,建立了可从同一供者体内同时获取肝、胰腺和小肠移植物的技术:这3个器官共用腹腔干和肠系膜上动脉这2根血管(见图6)。在此之前,同一供者同时获取这3个器官被大多数移植医生认为是不可能的[2]。而这一术式现在已成为世界上公认的标准术式[8]。但是,匹兹堡大学的移植脏器切取技术是建立在脑死亡供者的基础上,其脏器切取分为3个步骤:(1)保留所需切取器官完整血供的前提下进行解剖分离;(2)原位插管灌注并整块切取器官;(3)后台修整[2]。其目的是减少需切取脏器的损伤风险,特别是减少这些脏器的热缺血时间。我们结合我国器官移植供者多为心死亡供者的实际,借鉴匹兹堡大学的全腹腔脏器切取方法,建立适合我国实际情况的全腹腔脏器联合切取技术,采用先快速原位灌注、整块切取全腹腔脏器、然后再后台分离并修整,其目的同样是减少心死亡供者脏器切取的热缺血时间,以及减少脏器解剖的损伤风险。
我们所建立的脏器切取技术主要采用快速原位灌注、整块切取全腹腔脏器方法,在脏器整块切取过程中,均在腹膜后、肾脏、腹主动脉和下腔静脉后方及脊柱前方操作,避免误伤需切取的脏器及整块脏器间的内部组织结构,因此,不增加肝移植物和肾移植物的损伤机会,我们所切取的8具肝移植物和16具肾移植物均成功地用于肝移植和肾移植。心死亡供者心跳停止后经腹主动脉快速插管并进行低温保存液灌注是减少包括肝、肾在内的腹腔器官缺血再灌注损伤,特别是减少热缺血时间最为关键的步骤。我们在腹主动脉快速插管并进行低温保存液灌注之前的手术步骤与国内目前报道的方法相同[9-14],因此,未增加移植物的热缺血时间。根据匹兹堡大学的经验,对于小肠和胰腺移植物,切取术中应特别避免器官保存液的灌注压力过高和过度灌注,因此并不推荐通过门静脉或其分支插管进行原位门静脉系统灌注。在后台修整过程中,可通过已分离好的肝移植物的门静脉断端插管再灌注500~1000 mL的0~4℃ UW液,但是如果肝移植医生坚持门静脉系统原位灌注,可经肠系膜下静脉插管灌注[2]。我们有5次经肠系膜下静脉插管灌流门静脉系统,肝移植术后移植脏器功能良好,表明我们的切取方法不影响肝脏移植物的灌注。
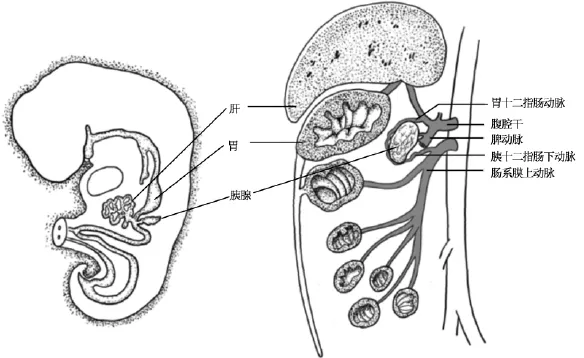
图6 胚胎起源上,肝、胰腺和消化道共用腹腔干和肠系膜上动脉两根血管
3.2 器官分离修整
整块切取下来的腹腔器官在后台修整过程中分离出肝、胰腺、小肠和2个肾也是非常重要的技术,特别是肝、胰和小肠这3个器官共同使用腹腔干和肠系膜上动脉两根血管。Abu-Elmagd所建立的国际标准全腹腔脏器获取术式中,肝、胰腺和小肠这3个脏器的后台分离(见图7)应遵循3个原则[2]:其一,保留发自肠系膜上动脉的胰十二指肠下动脉和发自腹腔干的脾动脉以充分保证胰腺移植物(实际上是胰十二指肠移植物)血供(见图8~10),其中胰十二指肠下动脉供应胰头和十二指肠,脾动脉供应胰体尾部,在后台修整过程中,可应用供者分叉的Y型髂血管两个断端分别与胰十二指肠移植物的带胰十二指肠下动脉的肠系膜上动脉和脾动脉的断端吻合从而将2根动脉汇合成1根血管以利于受者手术时吻合(见图9,10);其二,如果发现肝移植物存在发自肠系膜上动脉的右侧副肝动脉,则应在右侧副肝动脉和胰十二指肠下动脉之间横断肠系膜上动脉,右侧副肝动脉及肠系膜上动脉起始端保留给肝移植物,而肠系上动脉远侧则保留给胰十二指肠移植物;其三,由于胰十二指肠下动脉对胰十二指肠移植物十分重要,因此,在分离胰腺和小肠移植物时,为避免损伤胰十二指肠下动脉,可牺牲肠系膜上动脉发出的第一支空肠血管,以保证胰十二指肠下动脉的安全。Abu-Elmagd等[2]报道匹兹堡大学应用这一技术获取了13例供者全腹腔脏器,移植物经修整后成功地完成了11例单独小肠移植、1例小肠胰腺整块移植、1例改良腹腔多器官簇移植(胃、十二指肠、胰腺和小肠整块移植)、6例胰肾同期移植、11例全肝移植和4例劈裂式肝移植,共有34例受者接受不同的器官移植手术,未使用的5个胰腺移植物中仅有1个是因后台修整失败所致。Gondolesi等应用这一技术也获取了13例供者全腹腔脏器,移植物经修整后成功地完成了11例单独小肠移植、1例包括小肠的联合移植、1例全腹腔多器官簇移植、6例胰腺移植、12例全肝移植,共有31例受者接受不同的器官移植手术(Gondolesi G,Rumbo C,Martinez M,et al.Outcomes after intestinal transplantation:first series from a single South American center.XthInternational Small Bowel Transplant Symposium,2007,Santa Monica)。这一技术所获取的全腹腔脏器还可修整成腹腔多器官簇移植的移植物[15]。Yersiz等[16]报道了应用这一技术切取用于腹腔多器官簇移植和单独小肠移植的移植物技术细节。

图7 在后台修整过程中,肝、胰腺、小肠3个脏器的分离。分离胰腺移植物和小肠移植物,在离断肠系膜上动、静脉时,注意应在结肠中动脉结扎处下方离断肠系膜上动、静脉,以保留完整的胰十二指肠下动、静脉给胰腺移植物。小图显示,小肠移植受者手术时,血管移植物先吻合于受者的腹主动脉和门静脉(或下腔静脉),再与移植肠的肠系膜上动、静脉吻合
值得一提的是,需要与不需要胰腺移植物,移植器官簇后台修整的步骤不完全一样:如不需要胰腺移植物,则首先将肝从供者器官簇上分离下来;如需要胰腺移植物,则首先将小肠移植物从供者器官簇上分离下来。分离肝十二指肠胰腺移植物和小肠移植物时,在离断肠系膜上动、静脉时注意应在结肠中动脉结扎处下方离断肠系膜上动、静脉,以保留完整的胰十二指肠下动、静脉给胰腺移植物(图7,8)。

图8 已分离小肠移植物后的肝、胰、十二指肠移植物。注意应在结肠中动脉结扎处下方离断肠系膜上动、静脉,以保留完整的胰十指肠下动、静脉给胰腺移植物
3.3 器官保存及其他
器官保存液是腹腔器官切取和保存的一个关键。Abu-Elmagd等[15]总结匹兹堡大学的500例次小肠移植时,比较了262例应用UW液和60例应用组氨酸—色氨酸—酮戊二酸盐(histidine-tryptophanketoglutarate,HTK)保存液的疗效,结果两组间移植物的存活时间无显著差异;但是,由于观察到成人受者接受含有胰腺移植物后胰腺炎发生率显著增高,HTK保存液的研究被提前终止。不同于美国器官切取时完全应用 UW 液[2,16],我们与目前国内许多单位的方法相同[9-11,13-14],先应用 HC-A 肾保存液快速灌注,再用UW液灌注,其优点在于HC-A肾保存液粘稠性远低于UW液,灌注速度快,可达到全腹腔器官快速降温的目的,同时也可节省费用。脏器切取手术中,在离断幽门和末端回肠等空腔消化道时应用直线型切割缝合器快速而确实,可避免消化道内的消化液外溢,污染手术野内的脏器。同时切取髂血管应包括髂总、髂内、髂外动脉和静脉,颈部血管应包括颈总、颈内、颈外动脉和静脉,以及锁骨下动、静脉,以备肝、胰腺、小肠移植和改良腹腔多器官簇移植时作架桥用,这是重要的血管移植物来源。
3.4 团队合作
供者全腹腔器官切取手术团队医生间的合作与配合也非常重要。由于国内以往报道的肝切取[9]、肝肾联合切取[10-11]、上腹部器官簇切取[14]以及腹腔多个脏器联合切取[13]中,均未包含小肠移植物,因此,多经肠系膜上静脉插管进行肝的门静脉系统灌注,有时为操作方便,切取时对小肠及其系膜解剖本身也有破坏。全腹腔脏器切取的方法完全不同于这些方法,供器官获取主刀医生应熟悉胃肠解剖,特别是要关注小肠移植物的安全。由于全腹腔器官切取手术是一项快速、精细的操作,要求手术医生间熟练而准确地配合,因此,在术前必须就手术的详细步骤和技术细节进行仔细沟通,以获得相互的理解和术中支持。在遵守共同原则的前提下,应尊重肝移植或肾移植术者的个人经验和习惯,以便获得更好的配合。本组8次全腹腔脏器获取过程中,出于尊重肝移植医生意见的角度,均进行门静脉系统灌注,其中5次为肠系膜下静脉插管,另3次考虑无需胰腺移植物,接受肝移植医生的意见,于胰颈部后方横断门静脉;胆囊灌洗有6次在脏器切取前原位灌洗、2次在全腹腔脏器切取下来后现场灌洗,这也是根据肝移植术者的习惯和要求而定。
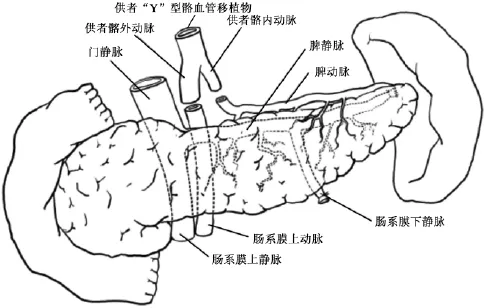
图9 在后台修整过程中,可应用供者分叉的Y型髂血管两个断端分别与胰十二指肠移植物的肠系膜上动脉和脾动脉的断端吻合从而将2根动脉汇合成1根血管以利于受者手术时吻合
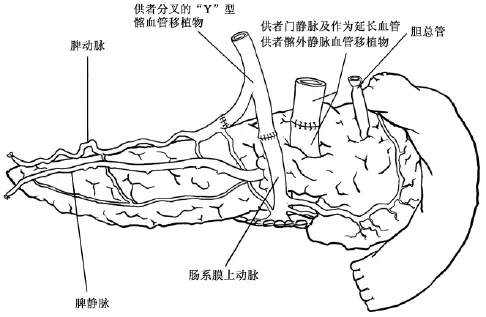
图10 胰十二指肠移植物修整完毕后的背面观。供者分叉的Y型髂血管移植物用于受者手术时吻合;应用供者髂外静脉移植物延长胰十二指肠移植物的门静脉
由于供者器官切取手术现场条件极为有限,时间紧迫,现场分离极易造成移植物的损伤,特别是存在有起源于肠系膜上动脉的变异肝脏血管时,因此,移植脏器的分离和修整应尽量安排在受者手术室内完成。当然我们也尊重肝移植和肾移植手术医生意见,多次在现场进行移植脏器的分离。
总之,我们建立的尸体供者的全腹腔脏器切取和保存技术简便、安全、可行,可同时为不同的小肠移植、肝移植和肾移植受者提供供器官,还可同时为胰腺移植受者提供供器官。切取器官经后台专门修整,我们的切取和保存技术也可应用于腹腔多器官簇移植和腹腔多个器官联合移植的供器官获取。
1 Huang JF,Mao YL,Millis JM.Government policy and organ transplantation in China[J].Lancet,2008,372(9654):1937-1938.
2 Abu-Elmagd K,Fung J,Bueno J,et al.Logistics and technique for procurement of intestinal,pancreatic,and hepatic grafts from the same donor[J].Ann Surg,2000,232(5):680-687.
3 李元新,李宁,李幼生,等.小肠移植外科技术的改进[J].中华消化外科杂志,2008,7(1):69-70.
4 Li YX,Li N,Li YS,et al.Preliminary experience with alemtuzumab induction therapy combined with maintenance low-dose tacrolimus monotherapy in small-bowel transplantation in China[J].Transplant Proc,2010,42(1):29-34.
5 Starzl TE,Hakala T,Shaw BW Jr,et al.A flexible procedure for multiple cadaveric organ procurement[J].Surg Gynecol Obstet,1984,158(3):223-230.
6 Starzl TE,Miller C,Bronznick B,et al.An improved technique for multiple organ harvesting[J].Surg Gynecol Obstet,1987,165(4):343-348.
7 Starzl TE,Todo S,Tzakis A,et al.The many faces of multivisceral transplantation[J].Surg Gynecol Obstet,1991,172(5):335-344.
8 Gondolesi G,Fauda M.Technical refinements in small bowel transplantation[J].Curr Opin Organ Transplant,2008,13(3):259-265.
9 淮明生,朱志军,高伟,等.200例尸体供肝快速切取技术要点分析[J].中华肝胆外科杂志,2007,13(2):132-133.
10 柳勤龙,宋军,高振明,等.原位灌洗联合快速切取腹腔器官的临床应用(附56例报告)[J].大连医科大学学报,2006,28(5):395-397.
11 蔡金贞,傅志仁,朱志军,等.肝肾等多脏器联合切取的手术方法改进[J].肝胆胰外科杂志,2005,17(3):180-182.
12 刘永锋,李先亮.腹部实质器官的切取与保存[J].中国实用外科杂志,1999,19(5):662-664.
13 褚志强,宋文利,沈中阳.肝肾胰十二指肠联合切取及修整的技术改进[J].中国临床解剖学杂志,2007,25(2):221-223.
14 马毅,朱晓峰,何晓顺,等.上腹部器官簇移植供体器官的切取和修整[J].中华普通外科杂志,2006,21(6):390-295.
15 Abu-Elmagd K,Costa G,Bond GJ,et al.Five hundred intestinal transplantations at a single center:Major advances with new challenges[J].Ann Surg,2009,250(4):567-581.
16 Yersiz H,Renz JF,Hisatake GM,et al.Multivisceral and isolated intestinal procurement techniques[J].Liver Transpl,2003,9(8):881-886.

