舱内腹部闭合性爆炸伤大鼠血浆内毒素的变化及意义
聂 海,赖西南,黄显凯,王丽丽
(第三军医大学大坪医院:1.野战外科研究所创伤、烧伤和复合伤国家重点实验室第六研究室;2.医院全军战创伤中心,重庆400042)
现代战争爆炸性武器的大量使用和平时意外突发性爆炸事件的频繁发生[1],导致爆炸性损伤有增多趋势[2],而爆炸事件大部分发生在相对密闭空间如战斗舱室、汽车、地铁、煤窑等,其物理性质与开阔地爆炸不尽相同。在爆炸性损伤中,腹部爆炸伤发生率较高[2]。研究表明,相对密闭空间腹部爆炸伤较开阔地爆炸伤情更严重[3],肠道氧化应激反应更剧烈[4]。爆炸伤可引起肠道缺血缺氧、氧化应激反应增强,但是否可导致内毒素移位尚不清楚。本研究试图通过舱室模拟器内爆炸建立致伤模型,观察舱内大鼠腹部爆炸伤后血浆内毒素的动态变化,为早期诊断肠源性感染和相对密闭空间爆炸伤员的合理救治提供理论依据。
1 材料与方法
1.1 复制动物模型及采集标本 100只230g左右健康雄性SD大鼠随机分为舱内组、舱外组,每组50只。速眠新Ⅱ(长春军需大学兽医研究所提供)0.4mL/kg体重进行股部肌肉注射麻醉。将大鼠固定于舱室,用600mg DDNP纸质点爆源悬挂于陆军模拟战斗舱室(第三军医大学野战外科研究所研制)中央,爆心距离大鼠腹部中央10cm引爆,爆炸后立即将大鼠取出舱室。爆炸后观察大鼠胸、腹壁有无穿透伤、贯通伤、盲管伤,如有开放性损伤则剔除,致伤后3、8、24、48h和 72h处死大鼠按要求采集门静脉血和腹主动脉血标本,另采集10只未致伤的正常大鼠血标本。
表1 外周血内毒素水平变化情况(Eu/mL

表1 外周血内毒素水平变化情况(Eu/mL
与致伤前比较,*:P<0.05,#:P<0.01;与舱外组比较,△:P<0.05,▲:P<0.01。
伤后时间(h)组别 伤前3 8 24 48 72舱内组 0.077±0.019 0.267±0.052# 0.424±0.084#△ 0.553±0.065#▲ 0.602±0.182#▲ 0.598±0.198#▲舱外组 0.077±0.019 0.208±0.067* 0.332±0.080# 0.381±0.129# 0.344±0.093# 0.270±0.119#
表2 门静脉血内毒素水平变化情况(Eu/mL

表2 门静脉血内毒素水平变化情况(Eu/mL
与致伤前比较,*:P<0.05,#:P<0.01;与舱外组比较,△:P<0.05,▲:P<0.01。
伤后时间(h)组别 伤前3 8 24 48 72舱内组 0.077±0.011 0.527±0.151#△ 0.648±0.152#▲ 0.782±0.152#▲ 0.865±0.130#▲ 0.706±0.159#▲舱外组 0.077±0.011 0.380±0.095# 0.474±0.098# 0.580±0.160# 0.570±0.100# 0.483±0.087#
1.2 检测内毒素 采用改良基质显色鲎试剂[5]法检测血浆内毒素水平(上海伊华临床医学科技公司),根据内毒素标准曲线(图1)求得内毒素含量。
1.3 检测血IL-6和TNF-α水平 采用双抗体夹心ELISA法检测OD值,根据不同浓度标准品制定的标准曲线,求得血浆IL-6[6]和 TNF-α浓度[7],实验步骤按照试剂盒(晶美生物工程有限公司)说明书进行。
2 结 果
2.1 外周血内毒素水平变化 大鼠腹部爆炸伤后血浆内毒素水平在3h开始升高,与伤前比较差异有统计学意义(P<0.05);舱内组 48h达高峰,舱外组 24h达峰值;舱内组血浆内毒素水平较舱外组升高快,且持续时间长,伤后8h舱内组明显高于舱外组,组间比较差异有统计学意义(P<0.05),致伤后72h仍明显高于舱外组,见表1。总体来说,舱内组与舱外组比较内毒素水平明显上升(t=4.153,P<0.001)。
2.2 门静脉血内毒素水平变化 大鼠腹部爆炸伤后血浆内毒素水平在3h开始升高,与伤前比较差异有统计学意义(P<0.05);舱内组 48h达高峰,舱外组 24h达峰值;舱内组血浆内毒素水平较舱外组升高快,且持续时间长,伤后8h舱内组明显高于舱外组,组间比较差异有统计学意义(P<0.05),到伤后72h仍明显高于舱外组,见表2。舱内组门静脉血内毒素水平较舱外组明显升高(t=4.818,P<0.001)。
2.3 外周血和门静脉血内毒素水平比较 相同时间点门静脉血和外周血内毒素水平比较发现,门静脉血内毒素水平较外周血升高快且明显,但24h后组间比较差异无统计学意义,见表3。

表3 同一时间点外周血和门静脉血内毒素水平比较
2.4 外周血TNF-α水平变化 舱内组大鼠腹部爆炸伤后血浆TNF-α水平在伤后3h内即开始快速升高,且明显高于舱外组,与伤前、舱外组比较差异具有统计学意义(P<0.05);舱内组48h、舱外组24h达峰值;舱内组血浆内毒素水平较舱外组升高快,且持续时间长,伤后72h仍明显高于舱外组,见表4。总体来说,舱内组与舱外组比较差异有统计学意义(t=4.492,P<0.001)。
2.5 外周血IL-6水平变化 舱内组大鼠腹部爆炸伤后血浆IL-6水平在伤后8h内开始升高,明显高于舱外组,组间比较差异有统计学意义(P<0.05);舱内组48h、舱外组24h达高峰;舱内组血浆IL-6水平较舱外组升高快,且持续时间长,伤后72h仍明显高于舱外组,见表5。总体来说,舱内组与舱外组比较差异有统计学意义(t=2.513,P=0.013)。
表4 外周血血浆 TNF-α水平变化(ng/mL
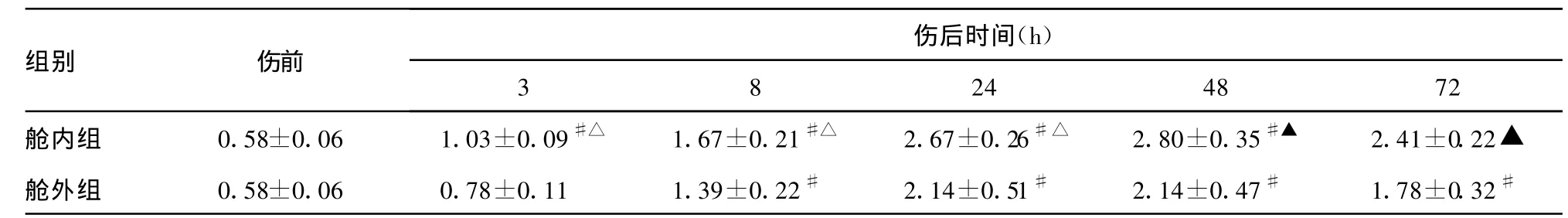
表4 外周血血浆 TNF-α水平变化(ng/mL
与致伤前比较,*:P<0.05,#:P<0.01;与舱外组比较,△:P<0.05,▲:P<0.01。
伤后时间(h)组别 伤前3 8 24 48 72舱内组 0.58±0.06 1.03±0.09#△ 1.67±0.21#△ 2.67±0.26#△ 2.80±0.35#▲ 2.41±0.22▲舱外组 0.58±0.06 0.78±0.11 1.39±0.22# 2.14±0.51# 2.14±0.47# 1.78±0.32#
表5 外周血血浆IL-6水平变化(pg/mL

表5 外周血血浆IL-6水平变化(pg/mL
与致伤前比较,*:P<0.05,#:P<0.01;与舱外组比较,△:P<0.05,▲:P<0.01。
伤后时间(h)组别 伤前3 8 24 48 72舱内组 96.4±16.8 126.9±20.6 275.4±40.3#△ 323.3±32.6#▲ 265.5±33.8#▲ 216.6±27.8#▲舱外组 96.4±16.8 118.2±18.8 228.8±20.8# 238.0±30.2# 162.0±17.7# 137.7±20.5#
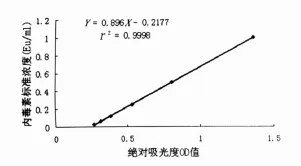
图1 内毒素标准曲线图
2.6 门静脉血内毒素水平与外周血内毒素、IL-6、TNF-α水平的相关性 相关分析表明,门静脉血内毒素水平与外周血浆内毒素、IL-6、TNF-α呈正相关,见表 6。
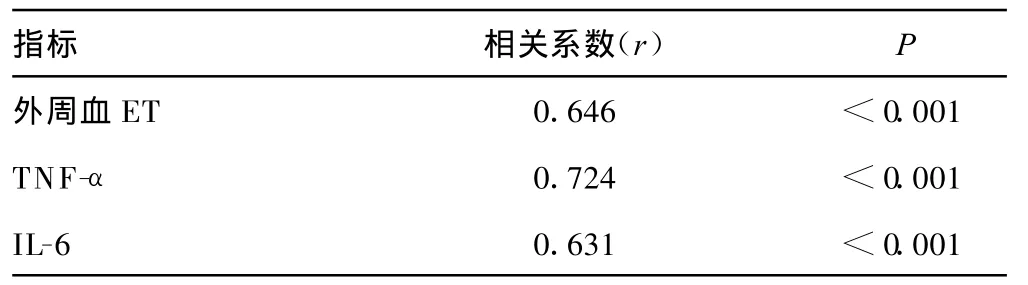
表6 门静脉血内毒素水平与外周血浆指标的关系
3 讨 论
正常大鼠由于肠道屏障功能的作用,血液循环中仅含有极微量的内毒素,但不会对机体造成危害,因为生理情况下,即使有少量内毒素入血,由于肝脏的强大解毒屏障功能,内毒素也很容易被体内防御系统清除。本研究结果显示,不管是门静脉血还是外周血内毒素水平舱内组均明显高于舱外组,而且水平更高、持续时间更长,表明舱内组的肠源性内毒素血症发生早且持续更久,相对密闭空间爆炸伤员机体发生肠源性内毒素血症的可能性大;此外,门静脉血内毒素水平与外周血变化趋势基本一致,提示在大鼠腹部爆炸伤后检测外周血内毒素水平可以近似反映肠道内毒素移位。外周血血浆 TNF-α和IL-6水平变化趋势与内毒素水平变化基本一致,提示通过检测外周血TNF-α和IL-6水平间接判断是否存在肠道内毒素移位,舱内组腹部爆炸伤后全身炎症反应较舱外组重,且持续时间长,可能更易发生全身炎症反应综合征,进而导致多器官功能衰竭(MODS)。但 TNF-α水平较 IL-6升高早、上升速度快,而且维持在较高水平,这种差异可能反映了这些细胞因子在全身炎症反应中所起不同的作用:TNF-α是早期表达的致炎介质,它诱导IL-6产生与IL-6在体内产生免疫协同作用;而IL-6后续产生对炎症进一步发展起促进作用。
本研究还发现,在相同时间点外周血内毒素水平较门静脉血低,表明肠道内毒素通过肠黏膜屏障进入门静脉血,通过肝脏的解毒、过滤功能,降低门静脉血内毒素水平,进入外周血的内毒素减少,导致外周血内毒素水平较门静脉血低;而伤后48h后门静脉血内毒素水平和外周血比较差异无统计学意义,可能是由于肝脏已经发挥最大的清除内毒素潜能,导致二者水平相近,也可能是由于大鼠肠道功能开始恢复,肠黏膜上皮功能改善,肠道通透性降低,内毒素吸收减少,而外周血中仍有残余内毒素,导致二者无明显差异。
因此作者认为,大鼠在腹部爆炸时一方面由于冲击波的直接作用导致肠道受损,肠黏膜上皮细胞发生缺血、缺氧,肠道发生氧化应激反应[4],导致肠黏膜通透性增加,内毒素容易逸出肠壁进入血液循环;此外,爆炸伤时也可发生细菌移位(另文报道),细菌在血循环中发生死亡、降解也可以释放大量内毒素,使血中内毒素水平进一步升高,形成内毒素血症。当血中细菌内毒素持续升高时,一方面通过直接激活单核-巨噬细胞系统及中性粒细胞,诱导其分泌多种介质如TNF-α、IL-1和 IL-6等[8],通过这些介质在局部或循环中播散至机体其他部分而发挥效应作用。另一方面内毒素与内毒素结合蛋白(LBP)结合后,可明显增加巨噬细胞对细菌吞噬以及促进TNF-α分泌[9]。TNF-α是炎症介质网络的关键因子,主要参与宿主对脓毒血症、创伤和MODS的反应。促进TNF-α产生的病原有许多,其中内毒素最引人注意,它能同时激活TNF的转录和翻译,并促进巨噬细胞分泌TNF-α。当细菌或病毒进入机体后TNF-α在循环中出现较早并迅速达到高峰,它可诱导内皮细胞和巨噬细胞释放IL-6,而IL-6随后又刺激其他细胞因子的生物合成,并反过来增强组织细胞对TNF-α的敏感性,参与或调节机体的炎症反应和免疫反应,可作为反映机体炎症与疾病严重程度的重要指标。
综上所述,腹部爆炸伤后冲击波作用导致肠黏膜缺血缺氧、发生氧化应激反应,增加肠黏膜通透性,促进大量内毒素移位,发生内毒素血症,然后激活炎症细胞产生炎症介质,炎症介质又放大内毒素的作用,导致体内免疫异常,直接或间接地引起或加重器官功能损害,甚至引起死亡,因此内毒素和炎症介质在腹部爆炸伤后判断病情严重程度和继发器官功能受损中起着重要的作用,因此了解内毒素和炎症介质的致病机制及其作用特点,对临床上选择有效防治MODS的方法具有重要的意义[10-11];在临床上测定腹部爆炸伤伤员血浆内毒素水平和炎症介质,既可以准确判断伤情,尽早判断预后,又可以判断药物干预的效果,适时调整治疗方案,对促进合理用药和提高患者预后及生活质量有重要意义。
[1]Almogy G,Mintz Y,Zamir G,et al.Suicide bombing attacks:Can external signs predict internal injuries?[J].Ann Surg,2006,243(4):541.
[2]Carey M E.Analysis of wounds incurred by U.S.Army Seventh Corps personnel treated in Corp hospitals during Operation Desert Storm,February 20 to March 10,1991[J].J Trauma,1996,40(3 Suppl):S165.
[3]聂海,黄显凯,赖西南,等.舱室爆炸致大鼠腹部损伤伤情分析[J].创伤外科杂志,2008,10(2):145.
[4]聂海,黄显凯,赖西南,等.舱内腹部爆炸伤大鼠血清及肠道组织M DA含量和SOD、GSH-Px活力变化及意义[J].第三军医大学学报,2008,30(10):910.
[5]Nawata M,Minobe S,Hase M,et al.Specific assay for endotoxin using immobilized histidine,Limulus amoebocyte lysate and a chromogenic substrate[J].J Chromatogr,1992,597(1-2):415.
[6]Helle M,Boeije L,de Groot E,et al.Sensitive ELISA for interleukin-6.Detection of IL-6 in biological fluids:synovial fluids and sera[J].J Immunol Methods,1991,138(1):47.
[7]M cLaughlin PJ,Elwood NJ,Ramadi LT,et al.Improvement in sensitivity of enzyme-linked immunosorbent assay for tumour necrosis factor[J].Immunol Cell Biol,1990,68(Pt 1):51.
[8]Volman T J,Hendriks T,Verhofstad AA,et al.Improved survival of TNF-deficient mice during the zymosan-induced multiple organ dysfunction syndrome[J].Shock,2002,17(6):468.
[9]Nanbo A,Nishimura H,Muta T,et al.Lipopolysaccharide stimulates HepG2 human hepatoma cells in the presence of lipopolysaccharide-binding protein via CD14[J].Eur J Biochem,1999,260(1):183.
[10]Tsuchida K,Yoshimura R,Nakatani T,et al.Blood purification for critical illness:cytokines adsorption therapy[J].Ther Apher Dial,2006,10(1):25.
[11]Sandeman SR,Howell CA,Mikhalovsky SV,et al.Inflammatory cytokine removalby an activated carbon device in a flowing system[J].Biomaterials,2008,29(11):1638.

