木质素的生物合成及降解研究现状
李志兰,杜孟浩
(1.浙江省自然科学基金委员会,浙江杭州 310012;2.中国林业科学研究院 亚热带林业研究所,浙江 富阳 311400)
木质素是植物体的主要化学组分,它与纤维素紧密结合,是植物细胞的胞间层和细胞壁纤维构造中的主要填充物,增强植物体的韧性和机械强度,协助疏导组织水分运输,并能在一定程度上抵抗外界环境因子对植株的侵害,在植物的正常生长中起着重要的作用,同时木质素元也是自然界仅次于纤维素的第2大宗可再生的生物资源,远自制浆造纸业兴起的年代就受到关注[1]。近10年来,关于木质素的研究集中在木质素生物合成,木质素的化学降解和木质素的生物降解这3个方面。
1 木质素的生物合成
木质素的生物合成,主要是结合植物的生长发育、细胞壁结构、纤维素和纤维束结构的研究进行的。木质素生物合成的生化机理和途径大体上是清楚的[1-3],但具体酶促反应的调节和控制机制还不是十分了解,木质素合成途径 (图1)是根据中野维三等[2],Campbell等[3],Wheteen 等[4]的工作综合绘制的。近10年来,对木质素与人类生活的密切关系认识日益深化,高含量木质素的木材和秸秆对获得能源有利,而在木材、秸秆制浆造纸或生产纤维素乙醇过程中,木质素存在不利于生产纸浆,也不利于从木质纤维素中分离纤维素以及纤维素降解成还原性糖,木质素对生物降解的抗性也会影响地球碳循环的速率[5]。基于此,近年来又广泛开展了木质素含量遗传变异、木质素合成酶基因、木质素合成的基因调控以及多酶基因反义转化的研究,并已取得了显著的进展。
1.1 木质素生物合成的可能途径
木质素的合成途径依据分析和推测可以简要概括为二大步骤,即木质素前体即单木质酚生成和单木质酚脱氢聚合成木质素,一般认为,禾本科植物主要是对羟基苯基木质素,裸子植物主要是愈创木基木质素,被子植物有的种类是愈创木基木质素,有的是紫丁香基木质素,或两者兼有 (图1),裸子植物主要是愈创木基木质素,被子植物有的种类是愈创木基木质素,有的是紫丁香基木质素,或两者兼有,但近年来的研究发现,裸子植物卷柏(Selaginella tamariscina)能通过不同于被子植物合成紫丁香基木质素的途径合成紫丁香基木质素,这可能是趋同进化结果[6]。现今已有许多实验证明一些酶系控制着木质素含量变化,利用悬浮细胞培养方法来研究PAL、4CL、OMT等酶对木质素前体诱导合成试验[4,7],证明这些酶系的活性与木质素前体浓度的相关性。一些植物如苜蓿 (M.sativa L)等编码其木质素合成过程的一些酶 (PAL、4CL、CAD)基因存在多基因族[3],班克松树 (P.bmnksiana Lamb)PAL基因族成员有1~5个(PAL1 -5)[8-9],基因家族的存在意味着可能存在一些有别于图1的其他合成途径。木质素合成过程中还存在许多非常规的亚单位和代谢的可塑性[4],当一种牵涉单木质酚合成有关的酶受抑制时,植株个体的木质素含量仍保持在相对稳定水平上,并会出现非常规的木质素亚单位,这意味着存在一种补偿机制以防止木质素含量减少,且存在一些未知酶的合成[9],因此木质素的合成途径有可能不同于图1所描述的过程,或是存在可切换的途径。
木质素合成酶的分子生物学特性及其作用机理研究日益受到重视,由图1可看到的十几种较为清楚的酶参与木质素合成,其中有些酶基因的DNA顺序已被测定出来,所涉及的植物种类有玉米[10]、烟草[11]、拟 南 芥[12]苜 蓿[13]、杨 树[14]、白 杨[15]、班克松[9]、火 炬松[16]、冈尾桉[17]卷柏[4]等 10 多种,从实际编码的DNA大小看,编码同一个酶DNA碱基数在不同的种间还是较为接近的,酶CAD、CoMT、OMT、CCR及过氧化物酶基因大小基本上在1 000 bp以上,LAC和4CL酶的基因稍大些,在1 500 bp以上,而 CcoAOMT基因大小为700~750 bp。这些酶系的实际编码数量并不很大,这为基因转化研究提供了可能。
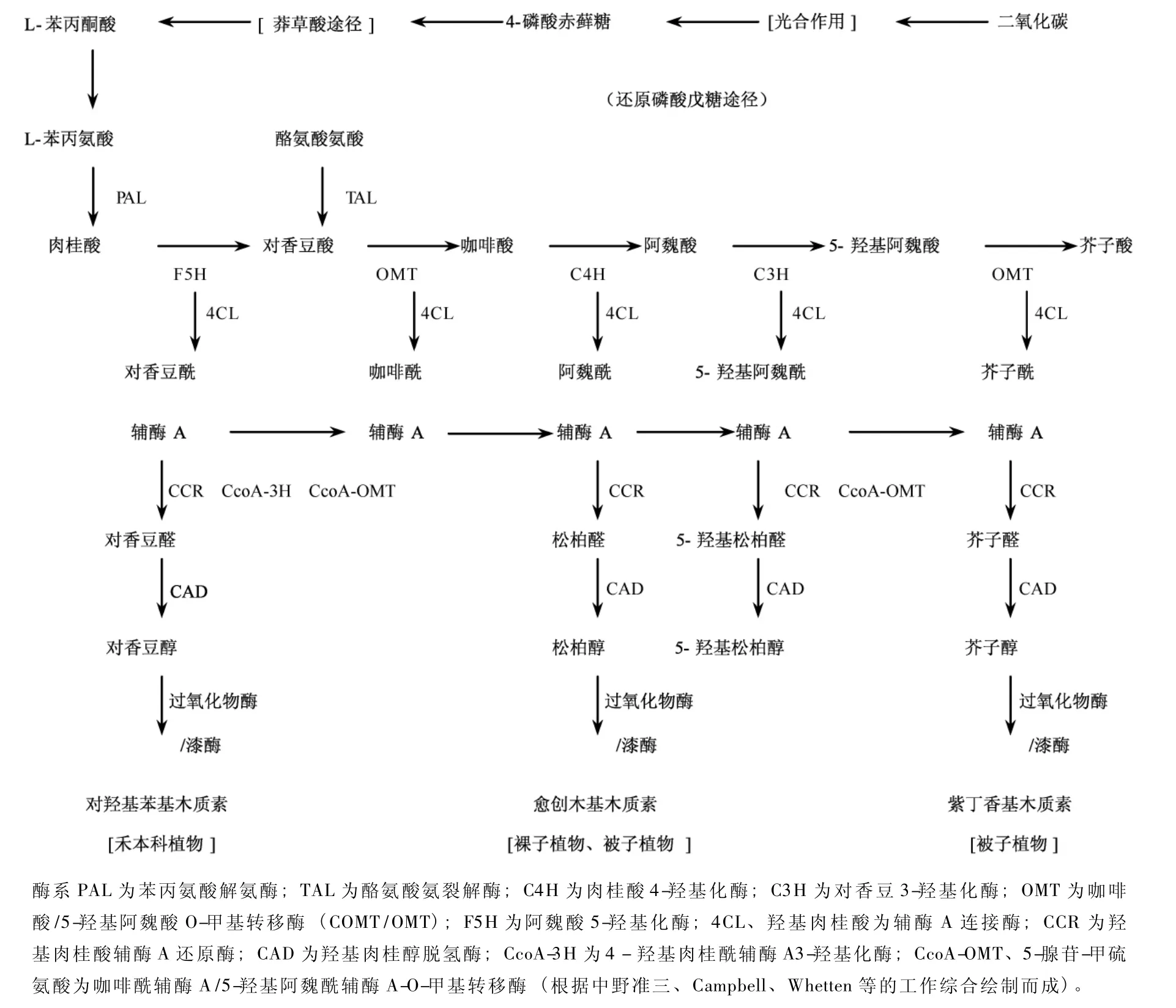
图1 木质素合成的可能途径
1.2 木质素生物合成基因的遗传操作
目前直接应用的方法来改变木质素含量的研究方兴未艾。Piguemal等[17]将 CCR(EC 1.2.1.44)酶的cDNA的反义构件通过农杆菌载体转化到烟草上,结果显示CCmRNA含量和CCR活性下降,叶形异常,导管皱缩。CAD是催化木质素前体合成的最后一步的酶 (图 1),Baucher等[18]将分离出来的CAD酶的cDNA通过农杆菌介导进行正义和反义转化到杨树中,结果表明3个反义转化品系木质素组织CAD活性下降70%,但木质素含量与对照相似,并未下降。Hignchi等[19]也进行了类似的试验,CAD反义转化的植株木质素含量并不下降,但木质素的组成和化学特性发生了变化。OMT是重要的控制木质素合成的酶,Dwivedi等[10]将编码bi-OMT酶 (EC2.1.1.68)的反义序列与CaMV35S基因的增强子、启动子和终止子组装后转化到烟草基因组内后,转基因植株表面出正常的表现型,植株茎部中bi-OMT酶活性平均下降29%,木质素含量下降水平与bi-OMT酶活性程度相关。Doorselaere等[11]应用反义 COMT转化杨树后,转化植株COMT活性下降为正常的5%,但木质素含量并不下降。依据应用转化单酶基因方法改造木质素含量的研究报道,降低单个酶 OMT、CAD、POD、COMT和F5H等酶系的活性,并不影响木质素含量变化,而降低酶系PAL、C4H4CL和CCR等的活性,则可减少木质素含量。虽然还有许多单一酶系影响木质素含量的报道,但单一酶系的作用到底有多大仍然不清楚,且因不同植物种而表现不同,离体试验结果和体内表现也不一致,这显示了木质素合成途径的复杂性,也可能存在多途径的替代和切换,至今所有有关木质素基因工程植株研究都没有进行田间的稳定性评估。
2 木质素的改性和降解
2.1 木质素化学改性和降解
木质素的化学降解是近十几年来研究热点之一,主要是围绕1个目标,一是木质素的改性,常用的改性方法有氨化[20]、磺化[21]、氢化[22]、烷基化[23]、氧化[24]、接枝共聚[25]等,如任承霞等的试验结果,在一定浓度NaOH和 H2O2降解后,分子量>10 000的高分子组分含量明显下降,氧化木质素酚羟基含量上升,羟基、甲氧基含量下降。二是环保处理造纸黑液,主要是氧化降解,目前氧化降解方法有氧化氨解[26]、热化学降解[27]、高温碱液空气氧化降解[19]、电化学降解[28-29]等。近年研发的电化学降解法可在较温和的条件下降解木质素,成为低分子量的有用物质,但是用电化学法降解木质素效率很低,主要原因是电极效率低。近来,各国学者在电极的种类和反应条件上进行了一些改进,选择好的电极材料,成本低,耐腐蚀,有较高的析氧电位。Utley等[21]以镍为阳极,铅为阴极,由于电位高,降解产物的产量可达20% ~36%,高出一般方法15% ~20%。涂宾等[30]进行了木质素磺酸钠电化学降解研究,以PbO2膜电极电化学降解过程中降解和缩合是相伴进行的,低分子质量级分的含量随时间增加而增加,羟基含量随时间增加而减少,其他官能团如羧基和醛基则是先增加后减少,经反应后木质素磺酸盐的表面活性提高了。Pardin等[31]用特制镍网阳极电化学反应池,在1.5 mol·L-1NaOH溶液中150~160℃条件下,研究木质素模型物的电化学氧化降解,结果产生了数种降解产物。杨卫东等用PbO[32]2作为阳极,不锈钢网作阴极,将1.5%木质素磺酸钙溶于1 mol·L-1NaOH溶液进行电解,分离出6种单酚基降解产物。另外有些学者也改进了木质素化学降解的技术,如陈云平等,以固体超强酸为催化剂,过氧化氢为氧化剂降解了高沸醇竹子木质素得到了对羟基苯甲醛、香草醛、紫丁香醛、苯甲酸等有用化学单体[33],邓海波等利用溶胶-凝胶法制备了钙钛矿型复合氧化物LaFeO3催化剂,进行了木质素湿法氧化合成芳香醛的研究,结果表明该方法能明显提高木质素的转化率以及各芳香醛的产率[34]。
2.2 木质素生物降解
参于木质纤维素降解的微生物有真菌、放线菌和细菌,很多微生物都没有独立降解木质纤维的能力,只有白腐菌一类能够独立降解木质素。参与木质素降解的酶类主要有木质素过氧化物酶 (LiPs.EC 1.11.1.7)、锰过氧化物酶 (MnPsEC 1.11.1.7)和漆酶 (EC 1.10.3.2),其中LiPs是最主要的降解酶。根据近来的研究[35-39],这3种酶氧化降解木质素的连锁步骤大致是:LiPs以低浓度的H2O2为氧化剂,通过1个双电子氧化步骤和2个单电子还原步骤,使非酚型木质素分子氧化成阳离子游离基,游离基再进行一系列非酶反应导致脂肪族侧链和芳香环断裂。MnPs在 H2O2存在时氧化酚型木质素分子,并保护MnP反应活性不受自由基的破环,MnP在一种螯合剂存在情况下催化芳香基夺取质子的反应。漆酶催化酚型木质素及其同型物发生单电子氧化反应,产生苯氧自由基,最后传递给氧,苯氧自由基间发生非酶反应如脱甲氧基、脱羧基和C-C链断裂,最后木质素大分子解裂为单体。由于漆酶催化反应不需要过氧化氢参与,一般认为漆酶催化反应是木质素降解的启动步骤。在上述3种氧化酶降解木质素过程中,藜芦醇 (VA)是重要的调控因子,加入外源VA时木质素生物降解提早起动,降解速率增加,VA控制H2O2浓度,保护酶不至失活,同时还起到电子转移介体的作用。
2.3 木质素降解新方法
近来研究和发展起来的新方法电-酶降解方法(EEM,electroenzymatic method)为降解木质素获取中间化合物,生产化学品,开辟了新途径。EEM在水质净化、废水处理、消除有机物等环保方面已显示出相当大的应用潜力[40-44]。电化学降解和酶降解是对环境友好的两个方法,把这2个方法结合起来,是绿色化学工业的重要组成部分。
EEM是增强酶降解的重要方法,在H2O2存在情况下,LiPs有许多底物,它能催化氧化许多结构复杂的分子,EEM用于在阴极产生的过氧化氢,接着发生酶促反应,反应器中装置离子交换膜,使阳极和阴极有各自的氧化还原环境,这就避免了阳极过氧化氢使酶失活,辣根过氧化物酶利用电化学在原位产生过氧化氢氧化分解 TNT(三硝基甲苯),清除 TNT效果远优于化学法或生物法,在EEM中过氧化氢得以充分利用。同样原理,利用EEM用LiPs利用电极原位产生过氧化氢为底物,氧化降解木质素也会有一定的效果,利用EEM降解木质素是一条值得深入探讨的新方法,通过下述反应模式降解木质素,调节和控制各种反应条件和参数,有望获得各种各样的产物。美国专利 (4,786,382)[45]在100℃的碱溶液中的电化氧化获得低分子量产物达到18%,Lee[46]等利用电酶氧化法在电酶反应器完成了藜芦醇向藜芦醛的转化。
3 展望
木质素是植物体生长发育过程中经由苯丙烷代谢途径合成的,苯丙氨酸/酪氨酸经由肉桂酸-咖啡酸-芥子酸生成松柏醇、芥子醇等和其衍生物形成木质素前体物,再经脱H聚合生成不同类型的木质素,这些中间产物及其衍生物都是十分珍贵的化合物,而且大都有生理活性,可广泛的应用于食品、医药和化工。通过研究降解木质素聚合物,获取各种降解产物及其衍生物,生产化学品,在最大程度上开发利用木质素,可以开拓绿色化工的新领域。目前制浆工业排放的废液中木质素是主要废弃物,也是主要污染物,回收利用率就其总量而言是微不足道的,任其废弃不仅污染环境,也影响自然界碳素循环速率,因此开发利用木质素具有极大的战略意义。
[1]冉秀芝.木质素生物合成代谢中的酶学研究进展 [J].中国农学通报,2009,25(3):23-27.
[2]中野雄三,住本昌之.木材化学[M].北京:中国林业出版社,1989.
[3]Campbell M M,Sederoff R R.Variation in lignin composition.Mechanism of control and implications for the genetic improvement of plant[J].Plant Physiology,1996,110(1):3-13.
[4]Whetten R M,MacKay J J,Sederoff R R.Recent advances in understanding lignin biosynthesis[J].Annual Review of Plant Physiology and Plant Molecular Biology,1998,49:585-609.
[5]Weng J K,Li X,Nicholas D,et al.Emerging strategies of lignin engineering and degradation for cellulosic biofuel production [J].Current Opinion in Biotechnology,2008,19(2):166-172.
[6]Weng J K,Takuya A,Nicholas D,et al.Convergent evolution of syringyl lignin biosynthesis via distinct pathways in the lycophyte selaginella and flowering plants [J].Plant Cell,2010,22:1033-1045.
[7]Fukuda H,Komamine A.Lignin synthesis and its related enzymes as markers of tracheary-element differentiation in single cells isolated from the mesophyll of Zinnia elegans[J].Planta,1982,155(2):423-430.
[8]Campbell M M,Ellis B E.Fungal elicitor-mediated response in pine cell cultures[J].Planta,1992,186(3):409 -417.
[9]Butland S L,Chow M L,Ellis B E.A diverse family of PAL genes expressed in pine trees and cell cultures[J].Plant Molecular Biology,1998,37(1):15-24.
[10]Guillaumie S,San-Clemente H,Deswarte C,et al.Maize wall database and developmental gene expression profiling of cell wall biosynthesis and assembly in maize [J].Plant Physiology,2007,143(1):339-363.
[11]Sewalt V J H,Ni W,Blount J W,et al.Reduced lignin content and altered lignin composition in transgenic tobacco down-regulated in expression of l-phenylalanine ammonia-lyase or cinnamate 4-hydroxylase [J].Plant Physiol,1997,115:41-50.
[12]Bell-Lelong D A,Cusumano J C,Meyer K,et al.Cinnamate-4-hydroxylase expression in Arabidopsis Regulation in response to development and the environment[J].Plant Physiology,1997,113(3):729-738.
[13]Reddy M S S,Chen F,Shadle G,et al.Targeted down regulation ofcytochrome P450 enzymesforforage quality improvement in alfalfa(Medicago sativa L.) [J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(46):16573- 16578.
[14]Barakat A,Bagniewska A,Choi A,et al.The cinnamyl alcohol dehydrogenase gene family in Populus:phylogeny,organization,and expression[J].BMC Plant Biology,2009,9(26):1-15.
[15]Stewart J J,Akiyama T,Chapple C C S,et al.The effects on lignin structure of overexpression of ferulate 5-hydroxylase in hybrid poplar[J].Plant Physiology,2009,150:621 -635.
[16]MacKay J J,Liu W,Whetten R,et al.Genetic analysis of cinnamyl alcohol dehydrogenase in loblolly pine:single gene inheritance,molecular characterization and evolution [J].Molecular and General Genetics MGG,1995,247(5):537-545.
[17]Piguemal J, Chamayou S, Nadaud I. Down-regulation of cinnamoyl-CoA reductase induces significant changes of lignin profiles in transgenic tobacco plant[J].Plant Journal,1998,13(1):71-83.
[18]Baucher M,Monties B,Montagu M V,et al.Biosynthesis and Genetic Engineering of Lignin [J].Critical Reviews in Plant Sciences,1998 17(2):125 -197.
[19]Higuchi T,Ito T,Umezawa T,et al.Red-brown color of lignified tissues of transgenic plants with antisense CAD genes:wined-red lignin from coniferyl aldehyde [J]. Journal of Biotechnolgy,1994,37(2):151-158.
[20]江启沛,张小勇,李佐虎.草浆碱木素过氧化氢氧化氨解制备氨化木质素缓释肥料的研究 [J].环境工程学报,2009,3(2):279-284.
[21]周洪峰,周天韡,董金桥,等.磺化木质素水溶液的流变行为 [J].纤维素科学与技术,2010(1):33-39.
[22]叶结旺,方桂珍,金春德.Pd/C催化微波法合成氢化碱木质素 [J].北京林业大学学报,2010,32(2):2171-2176.
[23]Morrow L R. Enhanced oil recovery using alkylated,sulfonated,oxidized lignin sulfactants[ P ].US Patent.5049295,1991.
[24]任承霞,李忠正.麦草碱木质素的氧化降解及其产物特性的研究[J].林产化学与工业,2001,21(4):49-53.
[25]李爱阳,唐有根.接枝共聚木质素絮凝处理电镀废水中的重金属离子 [J].环境工程学报,2008,2(5):611-614.
[26]Meiet D,Virgilio Z P,Felipe R C et al.Conversion of technical lignins into slow-release nitrogenous fertilizers by ammoxidation in liguid phase[J].Gioresource Technology,1994,49:121 -128.
[27]Dunne W.The production of fuels from biological substrates[J].Int.J Energy Res,1994,18(2):71-78.
[28]Dominguez-Ramos A,Aldaco R,Irabien A.Electrochemical oxidation oflignosulfonate: totalorganic carbon oxidation kinetics[J].Ind Eng Chem Res,2008,47(24):9848-9853.
[29]Utley J H.Electrochemical treatment of lignin:US patent,4 786 382 [P].1988.
[30]涂宾,卢卓敏,谌凡更.木质素磺酸钠电化学降解的研究[J].林产化学与工业,2002,22(2):21-25.
[31]Pardini V L,Smith C Z,Utley J H P,et al.Mechanism of electro oxidative cleavage of lignin model dimmers[ J].Journal Organic Chemistry,1991,26:7305-7313.
[32]杨卫东,丁明,张金萍,等.木质素磺酸盐电化学氧化的低相对分子质量产物的初步研究 [J].林产化学与工业,2006,26(1):121-123.
[33]陈云平,方润,杨平,等.固体酸催化氧化降解木质素的因素分析 [J].纤维素科学与技术,2010,18(1):1-5.
[34]邓海波,林鹿,孙勇,等.LaFeO3催化剂在木质素湿法氧化合成芳香醛反应中的活性与稳定性[J].催化学报,2008,29(8):753-757.
[35]Ren Y Z,Zhang B P,Hai B Z,et al.Treatment of black liquor of paper-making by combined process of acid-producing white rot fungus-anaerobic hydrolysis-contact oxidation-internal electrolysis[J]. International Journal of Environment and Pollution,2009,38(1):56-68.
[36]李莉,余天栋,王德韬,等.木质素降解菌shu-0801降解玉米废弃物的研究 [J].生物技术,2010,20(2):80-82.
[37]Evans C S Imelda M G,Peter T A et al.Localization of degradation enzyme in white rot decay of lignocellulose[J].Biodegradation,1994,(2):93-106.
[38]Susana R C,José L,Toca H.Industrial and biotechnological applications of laccases: A review [J]. Biotechnology Advances,2006,24:500-513.
[39]Tsukihara T, Yoichi H, Ryota S, etal. Mechanism for oxidation ofhigh-molecular-weightsubstrates by a fungal versatile peroxidase,mnp2 [J].Applied and Environmental Microbiology,2008,74(9):2873-2881.
[40]Daniel J Y,John R,Lu F,et al.Evidence for cleavage of lignin byabrown rotbasidiomycete [J]. Environmental Microbiology,2008,10(7):1844-1849.
[41]Shim J Y,Cho K,Hee S.Degradation of azo dye by an electroenzymatic method using horseradish peroxidase immobilized on porous support[J].The Korean Journal of Chemical Engineering,2007,24(1):72-78.
[42]Lütz S,Vuorilehto K,Liese A.Process development for the electroenzymatic synthesis of(R)-methylphenylsulfoxide by use of a 3-dimensional electrode [J].Biotechnol Bioeng,2007,98:525-534.
[43]Parpot P,Nunes N,Bettencourt A P.Electrocatalytic oxidation of monosaccharides on gold electrode in alkaline medium:structure-reactivity relationship [J]. JElectroanalChem,2006,596:65-73.
[44]Reiner R S,Springer E L,Atalla R H.Electrochemical delignification of wood pulp using polyoxometalate mediators[D].Madison,Wisconsin USA:12th ISWPC International Symposium on Wood and Pulping Chemistry,2003:181-184.
[45]James H P.Electrochemical treament of ligins:US patent,6 306 280 [P].1988.
[46]Lee K B,Pi K B,Lee K M.Synthesis of veratraldehyde from veratryl alcohol by lignin peroxidase with in situ electrogeneration of hydrogen peroxide in an electrochemical reactor [J].World Journal of Microbiology and Biotechnology,2009,25(9):1691-1694.

