山豆根多糖对鸡脾脏淋巴细胞信号转导相关分子水平的影响*
帅学宏,苏子杰,胡庭俊*,曾 芸,韦英益,李跃华
(1.广西大学动物科学技术学院,广西南宁 530005;2.甘肃农业大学动物医学院,甘肃兰州 730070)
山豆根又名广豆根,小黄连,为豆科植物柔枝槐(Sophora subprostrata)的根,主产广西,性寒,味苦,具有清火解毒,消肿止痛等功效[1]。山豆根多糖(Sophora subprostrata polysaccharide,SSP)是从其根部提取出来的一种天然多糖。它不仅可刺激淋巴细胞增殖,促进PWM诱导的抗体产生,刺激小鼠淋巴细胞分泌IgG[2],且具有抗氧化作用[3]。山豆根多糖还可以增加小鼠脾脏 T淋巴细胞分泌NO和IL-2,升高Ca2+浓度和增强 PKC活性[4]。研究表明,淋巴细胞表面存在多糖受体,多糖通过与受体结合,可启动淋巴细胞信息传递,进而影响淋巴细胞基因表达和活化增殖[5]。本试验观察了山豆根多糖对鸡脾脏淋巴细胞产生环磷酸腺苷(cAMP)、环磷酸鸟苷(cGMP)、6-酮-前列腺素 F1α(6-keto-PGF1α)、血栓素B2(TXB2)和一氧化氮(NO)信号分子的影响,为进一步揭示山豆根多糖的作用机制提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 良风花鸡,雄性,健康,60日龄。
1.1.2 药物与试剂 山豆根多糖,为灰白色粉末、易溶于水,不溶于乙醇、丙酮、乙醚等有机溶剂,由广西大学动物科学技术学院免疫药理实验室分离提取。临用时灭菌后用完全1640配成溶液;6-keto-PGF1α和 TXB2试剂盒购自北京北方生物技术研究所;cAMP和cGMP试剂盒购自上海中医药大学核医学实验室;无水对氨基苯磺酸为天津市福晨化学试剂厂产品;二盐酸-1-萘乙二胺为国药集团化学试剂有限公司产品。
1.1.3 主要仪器 UV-1800紫外可见光分光光度计(北京瑞利分析仪器公司);梅特勒-托利多AB104-L电子天平(瑞士);GC-2016型γ放射免疫计数器(科大创新股份有限公司中佳分公司);冷冻离心机(德国Sigma公司)。
1.2 方法
1.2.1 样品处理及分组 将供试鸡经颈静脉放血处死,无菌条件下采其脾脏,用D-Hank's洗去表面血液。在培养皿中加入适量的D-Hank's液,将脾脏在其中剪成小块,轻轻磨碎后用200目滤网过滤,收集滤液,缓慢加在等体积的鸡淋巴细胞分离液中,2 000 r/min离心10 min,收集中间层的淋巴细胞,用D-Hank's液洗涤两次后加入无酚红的RPMI-1640完全培养液,调整浓度为4×106cells/mL。取4个24孔培养板,分为4个时间段即 4、8、12、24 h,每个时间段分为5组,即空白对照组、4种浓度的山豆根多糖组。每组4个孔,每孔加1 mL淋巴细胞悬液,然后加入多糖使终浓度达到 50、100、200、400 μ g/mL。将培养板置入41℃、体积分数为 5%CO2培养箱中培养4、8、12、24 h,分时段离心收集细胞和培养上清,上清用于测定NO、6-keto-PGF1α和TXB2浓度。细胞经裂解后用于测定 cAMP和cGMP浓度。
1.2.2 测定方法 严格按照试剂盒说明书用放射免疫法测定 cAMP、cGMP、6-keto-PGF1α和 TXB2。参照庞战军Griess试剂法[6]略有改进,测培养液中NO 含量 ,以 NaNO2为标准 ,取 0、5、10、25、50、100、160、200、250 μ mol/L 几个浓度按表 1作标准曲线,单位mL(表1)。

表1 NO2-标准曲线的制作Table 1 The preparation of NO2-standard curve
吸取样品液1 mL,加入等体积Griess试剂,室温反应10 min,550 nm比色测OD值。
1.2.3 统计学处理 对试验数据用SPSS13.0软件统计分析。
2 结果
2.1 cAMP测定结果
由试验结果可以看出,山豆根多糖在24 h内对体外培养的鸡脾脏淋巴细胞产生cAMP有显著的影响,100 μ g/mL SSP在4 h时能显著升高 cAMP的浓度(P<0.05),8 h时cAMP含量达到最高值,与对照组比差异极显著(P<0.01),之后随着时间的延长,cAMP的含量逐渐减少。其他浓度的SSP对cAMP的含量也有不同程度的影响,总体呈先上升后下降的趋势(表2)。

表2 山豆根多糖对鸡脾脏淋巴细胞中cAMP的影响Table 2 Effect of SSP on cAMP in chicken splenic lymphocyte pmol/10 mL
2.2 cGMP测定结果
从表3结果可以看出,不同浓度的山豆根多糖作用于体外培养的鸡脾脏淋巴细胞,除了4 h时间段400 μ g/mL的 SSP对 cGMP有所降低外 (P <0.05),其他组SSP对鸡脾脏淋巴细胞产生 cGMP无显著的影响。
2.3 山豆根多糖对cAMP/cGMP的影响
山豆根多糖对cAMP/cGMP影响比较明显,SSP 以 100 μ g/mL 或 400 μ g/mL 浓度与淋巴细胞培养4 h和8 h时,细胞内cAMP/cGMP比值极显著升高(P <0.01),以后呈下降趋势,24 h时虽然50 μ g/mL多糖组的比值低于对照组,但其他组基本到达正常值,各浓度多糖组对cAMP/cGMP比值随时间延长总体呈先升高后降低的趋势(表4)。
2.4 6-keto-PGF1α测定结果
培养4 h时100 μ g/mL的SSP可明显升高6-keto-PGF1α浓度 (P <0.05),至 8 h 时 100、200、400 μ g/mL山豆根多糖均能显著升高 6-keto-PGF1α的浓度(P <0.05),到12 h时除400 μ g/mL的SSP组6-keto-PGF1α浓度有所升高外,其他浓度组都开始下降,24 h时各组均接近正常值(表5)。

表3 山豆根多糖对鸡脾脏淋巴细胞中cGMP的影响Table 3 Effect of SSP on cGMP in chicken splenic lymphocyte pmol/10 mL
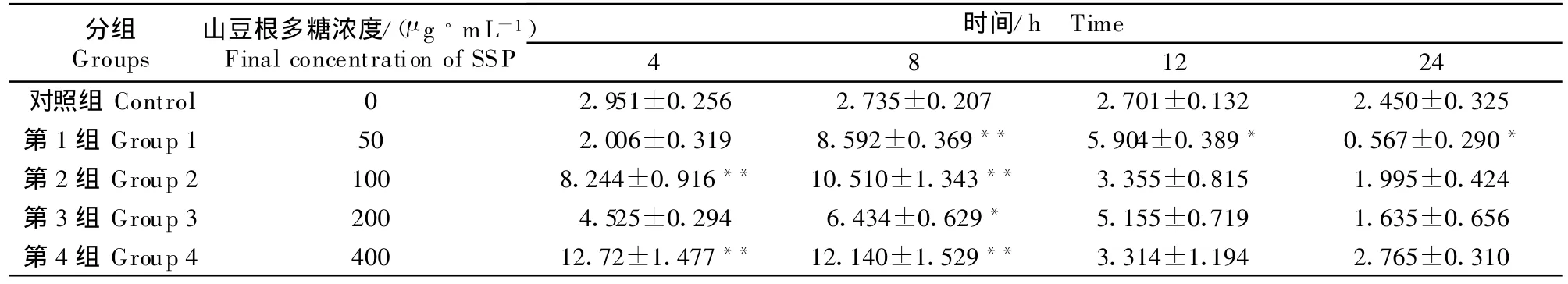
表4 山豆根多糖对鸡脾脏淋巴细胞中cAMP/cGMP比值的影响Table 4 Effect of SSP on cAMP/cGM P in chicken splenic lymphocy te

表5 山豆根多糖对鸡脾脏淋巴细胞分泌6-keto-PGF1α的影响T able 5 Effect of SSP on 6-keto-PGF1αsecretion of chicken splenic lymphocytes pg/mL
2.5 TXB2测定结果
山豆根多糖对培养液中TXB2浓度有升高作用,SSP浓度为100 μ g/mL,在 4 h时能显著升高 TXB2浓度(P<0.05),8 h时极显著升高 TXB2浓度(P<0.01),从12 h开始下降,到24 h与对照组无显著差异(表6)。

表6 山豆根多糖对鸡脾脏淋巴细胞分泌TXB2的影响T able 6 Effect of SSP on T XB2secretion of chicken splenic ly mphocytes pg/mL
2.6 山豆根多糖对6-keto-PGF1α/TXB2的影响
4种浓度的山豆根多糖均可升高6-keto-PGF1α/TXB2的比值(P <0.05)。与对照组比较,培养8 h,山豆根多糖浓度为 50 μ g/mL 、400 μ g/mL 能分别显著、极显著升高 6-keto-PGF1α/TXB2的比值 (P <0.05、P<0.01)。与对照组比较,培养12 h时,4种浓度的山豆根多糖均可显著升高 6-keto-PGF1α/TXB2的比值(P <0.05)(表7)。

表7 山豆根多糖对鸡脾脏淋巴细胞6-keto-PGF1α/TXB2影响Table 7 Effect of SSP on PGF1α/TXB2in chicken splenic lymphocytes
2.7 NO测定结果
一氧化氮浓度=(测定管 OD550-0.073)/0.004 6。相关系数r=0.995,NO2-标准曲线见图1。结果显示,4种浓度的山豆根多糖对NO的浓度均有升高作用。与对照组比较,培养4 h,山豆根多糖浓度为 200 μ g/mL,能显著升高 NO的浓度(P <0.05);培养 8 h,山豆根多糖浓度为 50 μ g/mL、100 μ g/mL,分别能显著升高 NO的浓度 (P <0.05);培养 12 h,山豆根多糖浓度为 50 μ g/mL、400 μ g/mL,分别能极显著升高NO的浓度(P <0.05);培养 24 h,山豆根多糖浓度为 100 μ g/mL、200 μ g/mL,分别能显著升高 NO的浓度(P <0.05)(表8)。

图1 NO2-标准曲线图Fig.1 NO2-standard curve
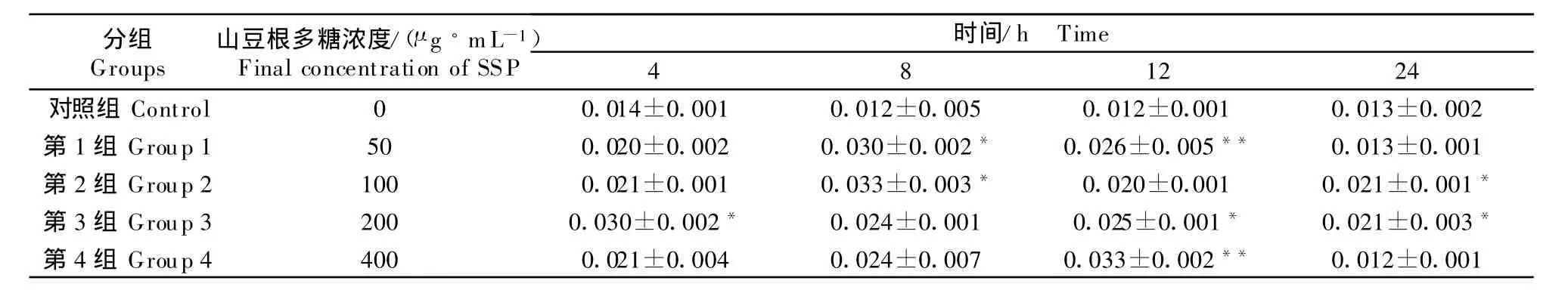
表8 山豆根多糖对鸡脾脏淋巴细胞培养液中NO的影响Table 8 Effect of SSP on NO production in chicken splenic lymphocytes
3 讨论
细胞内主要有以 cAMP、cGMP、DG、IP3和Ca2+为第二信使的多种信号转导通路,各个信号转导系统彼此联系构成信号网络[7]。在真核细胞中,cAMP和cGMP是重要的第2信使物质,分别由腺苷酸环化酶和鸟苷酸环化酶合成[8]。当腺苷酸环化酶活化时,细胞质中产生cAMP信号,通过蛋白激酶使蛋白质磷酸化来调节细胞的生理反应。cGMP与cAMP一样广泛存在于动物和微生物中,具有细胞内第2信使的功能。cGMP产生信号传递机制与cAMP相似[9]。现代免疫学认为,cAMP与 cGMP相互颉颃,密切配合,共同完成生理调节功能。一般认为 cAMP能抑制细胞增殖、促进细胞分化,而cGMP可促进细胞增殖和分裂,cAMP与cGMP比值在一定程度上反映机体免疫功能、细胞增殖和能量代谢等方面的状态,当该比值增大时,表明机体免疫功能增强,反之则表示机体免疫功能下降[10]。有研究表明[11],鸡接种IBD弱毒疫苗提高机体免疫力时,可以提高细胞内和血浆中信息分子环核苷酸水平,抗IBDV引起cAMP水平和cAMP/cGMP比值低下。石放雄等[12]研究一种从植物中提取制成的纯天然多糖复合体产品时发现其能显著升高鸡血浆和肝脏中cAMP、cGMP以及其比值。本试验表明山豆根多糖能明显升高鸡脾脏细胞中cAMP的水平以及cAMP/cGMP的值,提示山豆根多糖能够通过cAMP/cGMP途径增强机体的信号转导功能,发挥免疫调节作用。
做为一种新发现的第2信使,花生四烯酸及其代谢产物越来越受到人们的关注。花生四烯酸其代谢产物前列腺素、血栓素等的活性不仅可在细胞外作为第一信使产生细胞效应,还在细胞内的信息传递中有重要意义。花生四烯酸及其代谢产物具有促进或放大一些胞内信使系统的作用[13]。花生四烯酸代谢产物TXA2和PGI2是血栓素类和前列腺类物质较为重要的成分,发挥着主要的生理功能,但TXA2和PGI2在动物体内性质不稳定,易生成性质稳定的6-keto-PGF1α和 TXB2。因而,多通过测定 6-keto-PGF1α和 TXB2的变化来反映 TXA2和 PGI2的变化情况。6-keto-PGF1α-TXB2是一对平衡体系,6-keto-PGF1α/TXB2比值是衡量该体系是否处于稳态的标志之一。本试验发现,山豆根多糖能升高鸡脾脏淋巴细胞6-keto-PGF1α和 TXB2水平,当培养 12 h时6-keto-PGF1α/TXB2比值升高显著,说明该多糖能促进和调节免疫细胞内磷脂、甘油三酯及胆固醇的水解作用并对所释放的花生四烯酸代谢具有重要调节作用,从而调控免疫细胞内花生四烯酸信号分子的水平及相关基因的表达。这与胡庭俊等[14]研究蕨麻多糖的结果基本一致。
NO由细胞内NO合成酶催化精氨酸经氧化脱氨生成,具有广泛生物活性。NO在免疫调节中起重要作用[15]。据报道芦荟多糖能够促进小鼠腹腔巨噬细胞NO生成[16],黄芪多糖也能促进大鼠血管内皮细胞分泌NO[17]。有研究认为NO可活化鸟苷酸环化酶产生cGMP起到第2信使的作用[18]。胡庭俊等报道黄芪多糖是通过NO介导信号传递通路,调节细胞内游离钙离子的浓度,升高脾淋巴细胞蛋白激酶活性而影响机体免疫细胞的信号转导系统,发挥免疫调节作用的[19]。本试验研究结果发现山豆根多糖能促进鸡脾淋巴细胞NO的生成。由于NO与免疫应答及炎症有关,在免疫系统中作为信号转导的一种重要介质而起作用,故NO可能与cGMP构成一条信号传导通路,本结果提示山豆根多糖可能通过影响NO-cGMP信号通路而发挥免疫调节作用。
[1]徐国钧.中药彩色图谱[M].2版.福建福州:福建科学技术出版社,1997:20-21.
[2]赵武述,张玉琴,任丽娟,等.山豆根多糖刺激抗体产生的作用[J].中日友好医院学报,1992(S1):200-202.
[3]胡庭俊,程富胜,陈炅然,等.山豆根多糖体外清除自由基作用的研究[J].中兽医医药杂志,2004(5):6-8.
[4]Hu Tingjun,Zheng Rongliang.Promotion ofSophora subprosrate polysaccharide on nitric oxide and interleukin-2 production in murine T lymphocytes:implicated Ca2+and protein kinase C[J].Int Immunopharmacol,2004,(4):109-118.
[5]孙才华,谷新利,卢 慧.免疫活性多糖作用机制的研究进展[J].中兽医医药杂志,2006(4):19-21.
[6]庞战军,周 玫,陈 瑗.自由基医学研究方法[M].北京:人民卫生出版社,2000:260-261.
[7]M eghji P,Nazir S A,Dick D J,et al.Regional workload induced changes in electrophy siology and immediate early gene ex pression in intact in situ porcine heart[J].J Mol Cell Cardiol,1997,29(11):3147-3155.
[8]Koy amaa F C,Chakrabartib D,Garcia C R S.Molecular machinery of sig nal transduction and cell cycle regulation in Plasmodium[J].Mol Biochem Parasitol,2009:165:1-7.
[9]周 慧.简明生物化学与分子生物学[M].北京:高等教育出版社,2006:44-46.
[10]林曙光,郑广华,段小贝.细胞信号传导系统基础医学与临床[M].天津:天津科学技术出版社,1996:1-9.
[11]陈 龙,庞训胜,毛鑫智,等.雏鸡在感染IBDV后血浆cAMP、cGM P和IL-2水平变化[J].畜牧兽医学报,1999,30(2):157-163.
[12]石放雄,詹勇,阮 军,等.801对肉鸡血浆和肝脏环核苷酸含量影响的研究[J].中兽医医药杂志,1998(2):5-7.
[13]彭碧文,林建银,蒋明森.花生四烯酸及其代谢产物在寄生虫感染中的信使作用[J].国外医学:寄生虫病分册,2002,29(5):207-212.
[14]胡庭俊,陈炅然,张 霞,等.蕨麻多糖对小鼠免疫细胞信号转导相关分子的影响[J].中国兽医科学,2007,37(10):909-991.
[15]王昭金,万选年.一氧化氮在免疫调节中的作用与组织移植[J].解剖科学进展,1998,4(1):9-12.
[16]侯 敢,黄迪南,杨 明,等.芦荟多糖对小鼠腹腔巨噬细胞NO生成和iNOS酶活性的影响[J].湖南中医学院学报,2006,26(3):20-22.
[17]解慧梅,胡 格,索占伟,等.人参皂甙Rb1和黄芪多糖对微血管内皮细胞分泌NO、IL-6和 TNF-α的影响[J].畜牧兽医学报,2006,37(9):903-907.
[18]Kan H,Kataoka-Shirasugi N,Amakawa T.Transduction pathways mediated by second messengers including cAMP in the sugar receptor cell of the blow fly:Study by the whole cell clamp method[J].J Insect Physiol,2008,54:1028-1034.
[19]胡庭俊,程富胜,陈炅然,等.黄芪多糖对小鼠免疫细胞信号转导相关分子的影响[J].畜牧兽医学报,2005,36(6):616-619.

