幕上毛细胞型星形细胞瘤影像学表现
张宁男楠,张云亭,张 敬,李 威
(天津医科大学总医院放射科,天津 300052)
毛细胞型星形细胞瘤(pilocytic astrocytoma,PA)为儿童及青少年颅内常见肿瘤,占原发性中枢神经系统肿瘤的1.5%[1],2007年WHO中枢神经系统肿瘤分类[2]将其列为I级星形细胞起源肿瘤。由于其边界清晰、生长缓慢,具有良性生物学特征,术后5年生存率超过90%[3]。PA好发后颅窝,典型的影像学表现为大囊腔及其旁壁结节,幕上PA少见此种表现,使诊断困难,甚至诊为其他类型的神经上皮肿瘤而导致过度治疗。本文搜集11例经手术病理证实的幕上PA,分析其影像学特点,以提高本病的术前诊断正确率,为临床制定正确的治疗方案提供依据。
1 资料与方法
1.1 一般资料 搜集我院1997年1月~2008年1月11例经手术病理证实的幕上PA病例。男5例,女6例;年龄4~71岁,平均27岁。6例头晕、头痛伴恶心、呕吐,2例出现肢体活动障碍、共济失调,1例视力障碍,2例有癫痫病史。临床病程10 d~1年。
1.2 检查方法 11例均行MRI平扫及增强检查。MRI平扫包括矢状位T1WI、冠状位T2WI及轴位T1WI、T2WI。扫描参数:T1WIFLAIR 序 列,TR 2020 ms,TE 26ms,TI750ms,矩阵 320 ×224,FOV 24 cm×24 cm,NEX 2;FRFSE 序 列 T2WI,TR 4000 ms,TE 85ms,矩阵 512×512;层厚 6mm,间隔 1.5mm,FOV 24 cm×24 cm,NEX 2;MRI增强包括矢状位、冠状位、轴位 T1WI。扫描参数:SE 序列 T1WI:TR 500ms,TE 8.4ms,翻转角 75°,层厚 6.0mm,间隔 1.5mm,FOV 24 cm×24 cm,矩阵 256×150,NEX 1。增强检查对比剂为国产钆喷酸葡胺注射液(Gd-DTPA),剂量为0.1mmol/kg体重。
MR灌注成像在GE Signa Twin-speed infinity with exciteⅠ1.5T磁共振仪上进行,采用对比剂首过动态增强单次激发梯度回波-回波平面成像序列(single shotgradient recalled echo echoplanar imaging,SS-GRE-EPI)T2*WI。参数:TR 2000ms,TE 80ms,翻转角 90°,带宽 62.5,FOV 24 cm ×24 cm,层厚 6.0 mm,间隔1.5mm,矩阵128×128,1次激励。每个病灶扫描11层,扫描30个时相,成像时间57s。对比剂为Gd-DTPA,剂量为0.1mmol/kg体重,由高压注射器经肘前静脉注药,流率3ml/s。注药结束后注射20 ml生理盐水冲洗对比剂连接管道。采用GE Functool2软件包软件获取CBV图。
4例行CT平扫检查。采用GEHigh speed 8层螺旋 CT,扫描条件 120 KV,100mA,矩阵 512×512,以听眦线为基线向上扫描,层厚5~10mm、层距10mm。
2 结果
2.1 病变部位、数目 本组病例均单发。囊实性病变4例,囊性病变1例,实性病变6例。位于颞叶4例,额叶3例,颞顶枕交界区1例,丘脑2例,松果体-四叠体区1例。本组所有病例均通过MRI多层面、多方位成像准确定位。
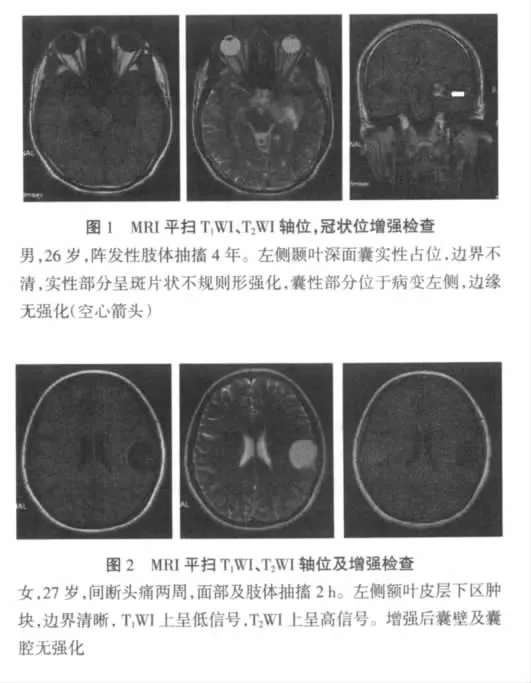
2.2 影像学特征 囊实性病变4例。实性部分占病变大部分,强化不均匀,3例呈不均匀团块状强化,1例呈结节样强化。囊性部分较小且多发,呈小泡样,位于病变边缘一侧,于T1WI上呈低信号、T2WI上呈高信号,增强后囊壁及囊腔无强化(图1)。囊性病变1例,位于左额叶皮层下区(图2),边界清晰,T1WI上呈低信号,T2WI上呈稍高信号,增强后囊壁及囊腔均无强化。实性病变6例。1例病变位于左侧丘脑区(图3),T1WI上呈稍低信号,T2WI上呈高信号,病变向同侧脑室突出生长,与周围脑质分界不清;增强后呈团块状明显不均匀强化。1例病变位于松果体-四叠体区,四叠体正常形态消失,于T1WI、T2WI上被等信号肿块取代,边界清晰,具有占位效应,幕上脑室扩张;增强后病灶边缘轻度强化,内部强化不明显。2例病变位于额叶,均累及皮层及皮层下区,T1WI、T2WI上以等信号为主,增强后病变呈轻度不均匀强化;其中1例病变内见不规则低信号区,结合CT及病理,为钙化;另1例行MR灌注成像(PWI)检查,病变灌注不均,较对侧正常脑组织灌注稍高,最大rCBV比值约为2.56,病变周围无强化区呈低灌注。rCBF图以低血流量为主(图4)。1例病变位于颞顶枕交界区,与左侧尾状核、丘脑分界不清,信号混杂,内部有少量陈旧性出血。1例右颞深面鞍旁病变,信号不均匀,其内可见不规则钙化,增强后呈环形不规则强化。本组仅2例病变周围有水肿带,范围较小。本组行颅脑CT平扫检查者3例,病变呈均质等密度或不均质,其中可见小条样钙化者2例。

3 讨论
1937年Penfield基于肿瘤细胞两端细胞突起为细长的毛发样胶质纤维丝而提出PA概念。病变以儿童及青少年多见,为儿童后颅窝最常见的肿瘤,约占儿童期全部脑肿瘤的10%~20%[3]。后颅窝PA的典型影像学表现为大囊腔及其旁壁结节[4]。幕上PA少见[5],可发生于颞叶、基底节区及额叶[6],影像学表现多样,准确定性较困难。
3.1 病理学特征 PA病理上可分为两型[7],一型好发于成年人大脑和小儿及青少年脑桥,呈弥漫性浸润生长,易发生间变而转变为多形性胶质母细胞瘤,称为成年型PA;另一型好发于小儿和青年人的小脑、丘脑,生长缓慢、界限清楚,常与四脑室关系密切,具有良性的生物学特征,称为幼年型PA。二者生物学特征不同,但都具有长形瘤细胞和倾向于居中线部位的共同特性。
典型大体病理概括为界限清晰、质地较硬、囊性变肿块,其中边界和质地因发生部位及变性改变可呈现不典型表现。囊大小不一,当其体积大大超过瘤体本身时,可将瘤体推至一侧,呈现壁结节征象。组织学上同为极型(毛样)星形细胞所构成,细胞突起细长,单极或双极,瘤内富有成熟的胶质纤维,亦可有一般星芒细胞。免疫组织化学检查GFAP、Vim、S2100多为阳性。
3.2 发病部位、年龄及性别 PA多发生于脑室系统周围近中线区,最常见于小脑,源于小脑蚓部,继发侵犯小脑半球,其次位于视神经或视交叉[8],幕上病变少见。本组中仅1例位置表浅(额叶皮层下区);余均位于脑质近中线区(额、颞叶深面或丘脑区),占本组病变的90.9%,符合PA多位于大脑中线周围的规律。病人平均年龄27岁,18岁以上8例,18岁以下3例,发病年龄与文献报道的幕上PA成人多见一致[9]。无性别差异。
3.3 影像学表现 后颅窝PA常表现为囊实性占位,边界清晰,囊腔较大,将肿瘤推向一侧,形成囊内壁结节,呈明显均匀强化,囊壁多有强化。本组4例囊实性病变囊性部分较小且多发,位于病变一侧,囊壁及囊腔均不强化;实性部分占病变大部分,边界不清,多呈不均匀团块状不规则强化。6例实性病变强化方式多样且不均匀,多数与周围脑质分界不清。本组病变形态及强化方式与后颅窝PA常见表现不一致,分析可能的原因为肿瘤压迫周围组织发生囊变,或者肿瘤细胞中液体进入肿瘤周围形成小囊肿;PA易沿血管周围间隙浸润生长造成其边界不清晰。多数PA具有良性生物学特征,无血脑屏障的破坏,其强化程度是由于肿瘤血管细胞内的对比剂胞饮小泡通过胞饮作用,从瘤内的有孔毛细血管渗透到细胞间隙引起肿瘤强化[10],可以出现肿瘤强化不均匀的情况。PA强化程度与其恶性度无相关性,当每高倍视野中出现多个核分裂象,伴微血管增生和假栅栏状坏死时[11],PA出现恶变(PA间变型)。1例完全囊性病变,囊壁及囊腔均未见强化,与本组4例囊实性病变的囊性部分强化特点一致。囊壁是否强化,普遍的观点认为,不强化者是假囊,由非肿瘤性的胶质细胞和受压的脑组织构成;强化明显者则反应性增生的新生血管或肿瘤成分较多[12]。外科治疗中,是否切除囊壁,国内外学者观点不同。Sgouros等[13]对仅切除壁结节的病人随访观察发现其预后良好,认为囊壁不应处理。另有学者认为通过术中囊壁病理结果来决定是否切除囊壁[14]。目前国内多数学者倾向切除强化的囊壁。
本组病例中1例病变内部少量陈旧性出血,2例出现不规则钙化。PA肿瘤组织中血管丰富,有酷似毛细血管瘤或海绵状血管瘤样区域,可出现陈旧性出血;因其生长缓慢,肿瘤中亦可见钙化。不可因此误诊为其他类型神经上皮细胞肿瘤。PA为低级别肿瘤,瘤周水肿较轻,病理上均为血管源性水肿,其内极少有肿瘤细胞浸润,术中可以保留水肿带。本组仅有2例病变有轻微水肿,范围明显小于肿瘤直径,符合上述水肿特征。
近年来,影像新技术越来越多的运用于肿瘤的诊断中。磁共振灌注成像(PWI)通过测定rCBV的变化反映肿瘤血管生成,后者是区别肿瘤恶性度的关键因素之一。本组1例病变区rCBV较对侧正常脑组织稍高,但明显低于多篇文献报道[15-16]的高级别星形细胞肿瘤。文献报道,PA磁共振波谱(MRS)多表现为Cho/NAA、Cho/Cr升高,但较高级别星形细胞瘤低,反映肿瘤细胞的增殖情况;Lip轻度升高,Lac降低;PA中坏死少见,Lac降低代表线粒体代谢改变或低级别星形细胞瘤中葡萄糖利用的差异性[17]。通过弥散张量成像(DTI)获得的部分各向异性值(FA)可以发现,PA的FA值比胶质母细胞瘤有显著性减低[18]。
3.4 鉴别诊断
3.4.1 囊实性及完全囊性PA的鉴别诊断 多形性黄色瘤型星形细胞瘤:多位于大脑半球表浅部位,以颞叶最多见。典型表现为大囊伴壁结节,壁结节可明显强化,囊壁强化程度不一。虽然具有与幕上PA相似的影像学表现,但其发病部位更为表浅。
神经元及混合性神经元-神经胶质起源肿瘤:如节细胞胶质瘤、节细胞瘤、胚胎发育不良性神经上皮肿瘤(DNET)等病变,具有大脑半球带有壁结节的囊实性肿块的影像学表现,与幕上PA影像学表现相似,鉴别困难。
幕上室管膜瘤(部分囊性型):好发于顶叶,实性部分多数可见钙化,囊壁轻-中度环形强化,可以此与幕上PA鉴别。
其他肿瘤:一些囊肿性病变,如脑实质内神经上皮囊肿,周围脑实质内可有胶质改变,囊壁有轻微强化,注意与完全囊性PA鉴别。脑寄生虫病,具有大囊的表现,但某些病例具有特征表现,如囊虫病囊内可见强化的头节,同时仔细询问病史有助于鉴别诊断。
3.4.2 实性PA的鉴别诊断 淋巴瘤:多位于中线旁脑质内,以基底节及脑室旁居多,CT上为等或稍高密度,MRI上T2WI多为稍高信号,实质性强化或环形强化。与本组病例中发生于丘脑部位病变较难区别,但淋巴瘤一般对放疗较为敏感,可临床治疗后复查。转移瘤:好发于中老年人,常多发,多位于皮髓质交界处,增强后呈不均匀环状或不规则结节状强化,壁结节内突,瘤周水肿明显。当临床找到原发病灶时,更支持转移瘤的诊断。
幕上室管膜瘤(完全实质型):好发于额叶,出血及钙化多见,瘤周水肿明显,易与幕上PA鉴别。
综上所述,幕上PA可呈囊实性、实性或完全囊性。本组病变与后颅窝常见PA表现不同,具有其特征性。诊断时应结合病人年龄,综合分析病灶发病部位、病变形态、强化表现以及周围水肿情况,同时应灵活运用多种影像技术,如MRS、DTI及PWI等,以获得更多鉴别肿瘤信息,提高诊断正确率。
[1]Polednak AP,Flannery JT.Other central nervous system and eye cancer[J].Cancer,1995,75(1 suppl):330
[2]张云亭.WHO中枢神经系统肿瘤分类对于影像学研究的指导意义[J].国际医学放射学杂志,2008,31(3):156
[3]Burger PC,ScheithauerBW,PaulusW,et al.Pilocytic astrocytoma[M]//Kleihues P,CaveneeW.Pathology and geneticsof tumours of thenervoussystem.Lyon,France:IARC,2000:45-51
[4]王渊,张明,鱼博浪,等.大脑半球毛细胞性星形细胞瘤1例[J].中国医学影像技术,2006,22(3):340
[5]Burkhard C,DiPatre PL,Schler D,etal.A population-based study of the incidence and survival rates in patientswith polocytic astrocytoma[J].JNeurosurg,2003,98(6):1170
[6]Forsyth PA,Shaw EG,Scheithauer BW,etal.Supratentorialpilocytic astrocytomas.A clincopathologic,prognostic and folw cytometric studyof51 patients[J].Cancer,1993,72(4):1335
[7]黄文清.神经肿瘤病理学[M].军事医学科学出版社,2005:236-237
[8]Osborn AG.Diagnostic imaging.Brain[M].Library ofCongressCataloging,2004:I-6:30
[9]Stüer C,Vilz B,MajoresM,et al.Frequent recurrence and progression in pilocytic astrocytoma in adults[J].Cancer,2007,86(5):2799
[10]TakeuchiH,Kubota T,Sato K,etal.Ultrastructureof capillary endothelium in pilocytic astrocytomas[J].Brain Tumor Pathol,2004,21(1):23
[11]赵有才,李南云,周晓军.毛细胞型星形细胞瘤的临床和病理学研究进展[J].中华病理学杂志,2007,36(12):846
[12]赵本胜,余永强,钱银峰,等.毛细胞性星形细胞瘤的CT、MR表现[J].临床放射学杂志,2007,26(6):539
[13]Hayostek CJ,Shaw EG,Scheithauer B,et al.Astrocytomas of the cerebellum.A comparative clinicopathologic study of pilocytic and diffuseastrocytomas[J].Cancer,1993,72(3):856
[14]Beni-Adani L,GomoriM,Spektor S,etal.Cystwallenhancement in pilocytic astrocytoma:neoplastic or reactive phenomenon[J].Pe-diatrNeurosurg,2000,32(5):234
[15]肖俊强,卢光明,李苏建,等.磁共振DWI和PWI在胶质瘤术前分级中的应用研究[J].医学影像学杂志,2009,19(4):376
[16]杨本强,周丽娟,吴越,等.2D 1H-MRS与PWI技术相结合在评价胶质瘤中的应用[J].解剖学进展,2008,14(2):183
[17]Hwang JH,Egnaczyk GF,Ballard E,etal.Proton MR spectroscopic characteristics of pediatric pilocytic astrocytomas[J].AJNR Am J Neuroradiol,1998,19(3):535
[18]Beppu T,Inoue T,Shibata Y,et al.Measurement of fractional anisotropy using diffusion tensor MRI in supratentorial astrocytic tumors[J].JNeuroonco,2003,63(2):109

