氢氯噻嗪在Caco-2细胞模型中的体外转运研究
廖晓欢,王俊俊,韩凤梅,杜鹏,陈勇
(湖北大学 中药生物技术湖北省重点实验室,武汉 430062)
氢氯噻嗪(hydrochlorothiazide)是临床上广泛应用的口服利尿药和抗高血压药,它通过抑制肾小管对钠和水的再吸收,减少血容量和细胞外液量,降低心输出量,达到降压作用[1].Caco-2细胞(the human colon adenocarcinoma cell lines)来源于人类结肠癌细胞,与人小肠上皮细胞形态相似.Caco-2细胞模型是进行药物肠道摄取和代谢研究最常用的体外细胞模型[2-3].目前,还少见关于氢氯噻嗪在Caco-2细胞模型体外转运的研究报道.本实验运用Caco-2细胞模型,研究转运时间、药物浓度、P-gp抑制剂维拉帕米(verapamil)和pH对氢氯噻嗪跨膜转运的影响,探讨氢氯噻嗪的体外吸收机制,以期为含有氢氯噻嗪的中药复方吸收机制提供参考.
1 仪器与试剂
Olympus XDS-1B型倒置显微镜,Sigma公司2K15C型低温高速离心机,上海迅达医疗仪器公司XD-711型酶标仪,岛津UV-1601紫外分光光度计,Heal Forse CO2培养箱,Millipore公司Millicell-ERS型跨膜电阻仪,Agilent 1100 Series高效液相色谱仪(包括DAD二极管阵列检测器;Agilent ChemStation色谱工作站),韩国Biotron公司真空离心浓缩机,美国Costar公司Transwell细胞培养板,Millipore公司millicell膜.
氢氯噻嗪(HCTZ,批号100309-200001,纯度>98%)、维拉帕米(Ver,批号100223-200102,纯度>98%)购于中国药品生物制品检定所;DMEM培养基购于Gibico公司;胎牛血清购于杭州四季青生物工程材料有限公司;非必需氨基酸购于Sigma公司;胰酶、青霉素-链霉素购于吉诺生物有限公司;碱性磷酸酶试剂盒购于南京建成生物有限公司;色谱纯乙腈购于美国Fisher公司.Caco-2细胞购自中国典型培养物保藏中心,实验所用的细胞传代数为25~60代.
2 方法
2.1细胞单层模型建立Caco-2细胞培养于37 ℃,含5%CO2的环境中,采用DMEM培养基,其中含10%胎牛血清、1%非必需氨基酸、1%谷氨酰胺以及青霉素-链霉素双抗液.
隔天换一次培养液,每3 d按1∶3的比例传代.将对数生长期细胞按1×105个·mL-1接种到12孔Transwell板上,接种后隔天换液,7 d后每日换液,培养至21 d.参照文献方法[4],检测碱性磷酸酶活性和各孔跨膜电阻(跨膜电阻值大于400 Ω·cm-2),选择Caco-2细胞单层生长状态完好、符合转运条件的Millicell膜用于转运实验.
2.2 HCTZ的跨膜转运实验根据MTT的实验结果,用pH7.4 Hank’s缓冲盐溶液(HBSS溶液)配制浓度为100、200、500 mg·L-1的HCTZ溶液,过滤除菌.取符合转运条件且细胞生长状态完好的Millicell膜,用37 ℃预热的空白pH7.4 HBSS溶液清洗细胞单层3次(此步骤在30 min内完成),之后放入37 ℃CO2恒温培养箱30 min.A→B侧的转运:将0.5 mL各浓度的药物溶液加到细胞绒毛面Apical(A)侧作为供给池,同时基底面Basolateral(B)侧加入1.5 mL空白的HBSS溶液作为接受池.B→A侧的转运:将1.5 mL各浓度的药物溶液加到B侧作为供给池,同时A侧加入0.5 mL空白HBSS溶液作为接受池.分别于30,60,90,120 min从接受池中取样0.5 mL(A→B侧的转运)或0.2 mL(B→A侧的转运),同时补加等量空白HBSS溶液.用HPLC测定药物的吸收量,分别考察转运时间、浓度、pH值、P-gp抑制剂Ver对HCTZ吸收与转运的影响.
2.3 HCTZ定量分析条件
2.3.1 色谱条件 色谱柱:Inertsil DOS-P(4.6 mm×150 mm,5 μm);流动相为乙腈∶水(17∶83);流速1.0 mL·min-1;检测波长270 nm;进样量20 μL;柱温25 ℃.
2.3.2 样品前处理方法 取转运样品在4 ℃,12 000 g条件下高速离心10 min,取上清于37 ℃真空离心浓缩挥干,用流动相200 μL复溶后涡旋震荡1 min,再于4 ℃,12 000 g离心10 min,取上清液20 μL进样检测.
2.4数据处理表观渗透系数Papp(apparent permeability coefficients)代表药物转运能力的大小,Papp=(dQ/dt)/(A×C0) cm·s-1[5]
其中,dQ/dt为单位时间药物转运量(μg·min-1),
A为聚碳酯膜的表面积(此实验中为1.13 cm2),
C0为HCTZ的初始浓度(mg·L-1).
由于每次取样后都要补液,对药物的通透产生了稀释作用,因而要对药物的累积吸收浓度TRcum(mg·L-1)进行校正,

其中An为第n个样品通透量的测定值,VSn为第n个样品的采样体积,VR为接受池体积.
3 结果
3.1 HCTZ的HPLC分析方法在本色谱条件下,空白HBSS溶液对HCTZ的检测无干扰,色谱分离良好.精密称取HCTZ对照品适量,用空白HBSS液制成质量浓度分别为0.15、0.5、2、4、8、15 mg·L-1对照品溶液,所得系列对照品溶液按“2.3.2”项操作后进样.以HCTZ色谱峰面积为横坐标,浓度为纵坐标进行线性回归,得到标准曲线为y=0.021 9x-0.192 1,r=0.999 6,线性范围为0.15~15 mg·L-1.
配制HCTZ0.2 mg·L-1、2 mg·L-1、15 mg·L-1质控浓度的HBSS溶液,分别进样测定峰面积,计算药物质量浓度,以测得的质量浓度与实际质量浓度相比较,求得方法回收率为98.52%~102.01%.每样本测定6次,连续测定3 d,HCTZ的日内精密度和日间精密度均小于5%.
3.2 HCTZ的跨膜转运
3.2.1 时间及浓度对HCTZ转运的影响 不同浓度HCTZ通过Caco-2细胞单层膜型的累积转运浓度随时间变化的结果见表1.HCTZ3个作用浓度A→B方向的转运量在前90 min随作用时间的延长基本增加,低、中两个作用浓度B→A方向的转运量前90 min随作用时间的延长而降低.
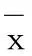
表1 HCTZ在Caco-2细胞中的累积吸收浓度(n=3,±s) mg·L-1
根据公式Papp=(dQ/dt)/(A×C0) cm·s-1,计算出HCTZ在120 min时的表观渗透系数,结果见表2.结果表明,HCTZPappA→B随浓度的升高而降低,且不同浓度下PappB→A/PappA→B值均大于1.5.

表2 HCTZ在Caco-2细胞中的表观渗透系数(n=3,±s)
*与HCTZ 100 mg·L-1比较,P<0.05.
3.2.2 Ver对HCTZ转运的影响 Ver对HCTZ的表观渗透系数Papp的影响结果见表3.Ver能极显著增加HCTZ通过Caco-2单层细胞模型的PappA→B(P<0.01),减少HCTZ通过Caco-2单层细胞模型的Papp B→A,Papp B→A/PappA→B从加入前的2.81下降到加入后的0.67,有极显著性差异(P<0.01).
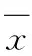
表3 Ver对HCTZ转运的影响(n=3,±s)
**与HCTZ组比较,P<0.01.
3.2.3 pH值对HCTZ转运的影响 pH值对HCTZ转运的影响结果见表4.在pH6.0条件下,PappA→B是pH7.4条件下的3.9倍,有极显著性差异(P<0.01);同时,Papp B→A是pH7.4条件下的53%,结果亦有显著性差异(P<0.05).
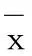
表4 pH对HCTZ转运的影响(n=3,±s)
*与pH7.4组比较,P<0.05;**与pH7.4组比较,P<0.01.
4 讨论
通过测定不同浓度受试药物的表观渗透系数可以确定药物的转运机制.若在整个质量浓度范围内(于漏槽条件下)测得Papp值保持恒定,则被动扩散为主要转运机制;若Papp A→B与Papp B→A相同也可确定被动扩散为主要转运机制,若Papp B→A/PappA→B>1.5,则提示可能存在主动转运机制[6].HCTZ 100 mg·L-1与200 mg·L-1以及100 mg·L-1与500 mg·L-1时的PappA→B均有显著性差异(P<0.05),因此,HCTZ在整个浓度范围内的表观渗透系数不是恒定不变的,且在整个浓度范围内HCTZ的Papp B→A/PappA→B>1.5,表明HCTZ在Caco-2细胞内可能存在主动转运机制.同时,Papp A→B值随HCTZ浓度的增加而逐渐减小,这可能与Caco-2细胞的转运载体有限有关.
P-糖蛋白是由多药耐药(multidrug resistance,MDR)基因编码的分子量为170×103的膜蛋白,存在于细胞层的绒毛面一侧,系一种能量依赖性的药物外排泵[7].P-糖蛋白存在于Caco-2细胞AP 面的细胞膜上,它将细胞内的HCTZ作为底物排出细胞外,使得A→B的转运速率减慢,而B→A的转运速率增大.Ver是P-糖蛋白的专属抑制剂.本实验在加入Ver后,基本抑制了P-gp对HCTZ的外排作用,使HCTZPappA→B值极显著增大,转运加快,而Papp B→A降低,转运减慢,说明HCTZ可能是P-gp的作用底物.
HCTZ属于弱酸性物质,在pH6.0条件下,HCTZ大量以非解离的(脂溶性)的形式存在,由于消化道上皮细胞具有脂质膜的功能,只允许脂溶性的非解离的酸或碱通过,酸性药物在酸性条件下吸收较强.因此,HCTZ在pH6.0条件下的吸收较pH7.4时有显著提高.
综合上述实验结果,我们推测HCTZ在Caco-2细胞模型中的吸收可能存在由载体介导的主动转运,同时它还受到P-gp的外排作用.
参考文献:
[1] 张宗任,郎九立.不同剂量的氢氯噻嗪对原发性高血压的治疗研究[J].中国实用医药,2008,3(9):47.
[2] Ingels F,Deferme S,Destexhe E,et al.Simulated inestinal fluid as transport medium in the Caco-2 cell culture model[J].International Journal of Pharmaceutics,2003,232(1):183-292.
[3] Allen R H,Rpbert A C,Philip S B.Caco-2 cell monolayers as a model for drug transport across the intestinal mucosa[J].Pharm Res,1990,7(9):902-910.
[4] 杨秀伟,杨晓达,王莹,等.中药化学成分肠吸收研究中Caco-2细胞模型和标准操作规程建立[J].中西医结合学报,2007,5(6):634-641.
[5] 宋丽,张宁,徐德生.芍药苷在Caco-2细胞模型中吸收机制的研究[J].中草药,2008,39(1):41-44.
[6] Artursson P,Karlsson J.Correlation between oral drug absorption in humans and apparent drug permeability coefficients in human intestinal epithelial(Caco-2) cells[J].Biochem Biophys Res Commun,1991,175(3):880-885.
[7] Haber B A,Mohn K L,Diamond R H,et al.Induction patterns of 70 genes during nine days after hepaterctomy define the temporal course of liver regeneration[J].J Clin Invest,1993,91:1319-1341.

