脉冲强光对大肠杆菌细胞膜损伤及胞内酶活性的影响
张佰清 郭佳佳
(沈阳农业大学食品学院,辽宁 沈阳 110161)
脉冲强光对大肠杆菌细胞膜损伤及胞内酶活性的影响
张佰清 郭佳佳
(沈阳农业大学食品学院,辽宁 沈阳 110161)
通过脉冲强光处理对数生长期大肠杆菌细胞悬液,研究菌体细胞膜通透性及胞内酶活性的变化。结果表明,蛋白质的漏出量及丙二醛的生成量均随大肠杆菌存活率的下降而增加,在处理电压1 500V、闪照次数32次的条件下,蛋白质漏出量为13.03μg/mL,丙二醛生成量为2.76nmol/L,对氯化钠的耐受性明显低于对照组(P<0.01)。此外,胞内酶活性与处理前相比均有所降低,超氧化物歧化酶活性最低降至83.78%,过氧化氢酶活性最低降至76.92%。因此,细菌屏障结构破坏所造成的细胞膜渗透压及通透性改变,可使细菌胞内物质发生改变,甚至导致菌体死亡,羟自由基可能对致死细胞的协同作用有一定的意义。
脉冲强光;大肠杆菌;细胞膜损伤;胞内酶活性
脉冲强光作为一种冷杀菌技术,是利用极强的直流电通过充有惰性气体的灯管,发出比地面上太阳光强近2万倍的光能,照射于食品表面,从而有效致死各种微生物[1]。该技术对食品的风味和营养成分影响很小,可有效的保持食品质量,延长货架期。目前对其在微生物致死效果方面的研究较多,而对致死机理的报道较少。因此,选择卫生检测标准菌大肠杆菌进行试验,通过研究细胞膜损伤及胞内抗氧化酶活性的变化,分析脉冲强光对微生物细胞产生的不同生物效应,从而为其致死机理提供理论依据[2]。
1 材料与方法
1.1 试验仪器
电热恒温培养箱:DNP-9082型,上海精宏实验设备有限公司;
数显恒温水浴锅:HH-6型,国华电器有限公司;
紫外可见分光光度计:UV-2000型,尤尼科(上海)仪器有限公司;
台式高速离心机:TG16-WS型,湘仪离心机仪器有限公司;
脉冲强光冷杀菌装置:波长范围为200~1100nm、光脉冲的脉冲宽度为20μs、最大输入能量为644J,自行研制;
全温振荡培养箱:HZP-250型,上海精宏实验设备有限公司;
电子天平:JY2002型,上海精密科学仪器有限公司;
手提式不锈钢蒸气消毒器:YX280A型,上海三申医疗器械有限公司;
超声波细胞粉碎机:Y92-Ⅱ型,宁波新芝生物科技股份有限公司;
数字式酸度计:PHS-25型,上海日岛科学仪器有限公司;
超净工作台:SZX-ZP型,上海博讯实业有限公司医疗设备厂。
1.2 试验材料及试剂
大肠杆菌(E.coli)菌种:沈阳农业大学土地与环境学院微生物实验室;
培养基:牛肉膏蛋白胨琼脂培养基,LB液体培养基;
盐酸、氢氧化钠、乙醇(95%)、结晶牛血清蛋白、考马斯亮蓝G-250、磷酸(85%)、三氯醋酸、硫代巴比妥酸、磷酸氢二钠、磷酸二氢钠、三羟甲基氨基甲烷、丙三醇、二乙三氨五乙酸、邻苯三酚、VC、30%H2O2等:分析纯(AR),国药集团化学试剂有限公司。
1.3 试验方法
1.3.1 脉冲强光处理 将摇瓶培养至对数生长期的E.coli悬液经5 000r/min离心10min得菌体沉淀,重新悬浮于50mmol/L磷酸缓冲液(pH 7.8)中,使菌悬液浓度约为109CFU/mL。在每个直径为75mm的培养皿中加入6mL的菌悬液,放在杀菌处理室中央,按照试验设置进行处理[3]。每个处理3次重复,结果取平均值。处理电压:800,1 000,1 500,2 000,2 500V;闪照次数:4,8,16,24,32。
1.3.2 漏出蛋白质含量的测定 取脉冲强光处理后的菌悬液,4℃下以12 000r/min的转速离心8min,得到的上清液为粗酶液,蛋白质含量的测定采用考马斯亮蓝染色法[4]。蛋白质渗漏量按式(1)计算:
蛋白质渗漏量=试验组蛋白含量-对照组蛋白含量(1)
1.3.3 脉冲强光与NaCl的协同作用 将未经处理的对照组及经脉冲强光处理后的菌悬液,分别接种在普通营养琼脂培养基及另加质量分数为1%、3%、5%、7%、9%NaCl的普通营养琼脂培养基上。置37℃温箱培养24h,用平板计数法进行活菌计数,比较在不同NaCl含量培养基上的E.coli存活率。
1.3.4 杀菌效果与羟自由基(·OH)作用的观察 用50mmol/L磷酸缓冲液(pH 7.8)悬浮E.coli菌体,经脉冲强光处理后以普通营养琼脂平板涂布法活菌计数。另用1mol/L甘油悬浮菌体,脉冲强光处理后按前述方法活菌计数。杀菌率按式(2)计算:

1.3.5 细胞膜脂质过氧化产物的测定 参照陈勤的TBA法[5]并略加改进。脉冲强光处理后的菌悬液冰浴下用超声波破碎细胞(功率600W,连续破碎5s,间隔30s,破碎15次),再于4℃下6 000r/min离心20min取上清液用于丙二醛(MDA)含量的测定。
1.3.6 胞内酶活性的测定 将破壁后的E.coli菌悬液于4℃下10 000r/min离心20min,上清液即为粗酶液。超氧化物歧化酶(SOD)活性测定采用改良的邻苯三酚自氧化法,过氧化氢酶(CAT)活性测定采用Beers&Sizers法,并做相应改进[6]。相对酶活性按式(3)计算:

2 结果与分析
2.1 漏出蛋白质含量的考察
蛋白质广泛存在于细菌细胞壁、细胞膜及细胞质中,对细菌的生长代谢起着重要的作用。蛋白质严重受损,会直接导致菌体死亡。由表1可知,在闪照6次的条件下,漏出蛋白含量与处理电压呈正相关,当处理电压从1 000V到2 000V时,漏出蛋白含量明显增加,当处理电压超过2 000V时,增加缓慢;在处理电压为1 500V的条件下,漏出蛋白含量与闪照次数呈正相关,当闪照次数从1次到8次时,漏出蛋白含量明显增加,当闪照次数大于8次时,增加缓慢,当闪照次数为32次时,达到最高值13.03μg/mL。随着脉冲强度的增加,漏出蛋白不断增加,可能是脉冲强光作用于菌体胞壁或胞膜,使之通透性增加的结果。当脉冲强度过大时,曲线较低强度处理趋于平缓,这可能是因为高强度脉冲处理存活下来的菌体本身较少,故被杀灭的也少,致使漏出蛋白质含量的增加也减少。

表1 脉冲强光对E.coli漏出蛋白质含量的影响Table 1 Effect of pulsed light irradiation on the leakage of protein content of E.coli
2.2 对NaCl耐受性考察
E.coli经脉冲强光照射后,置NaCl溶液中,可加速其死亡。由图1可知,经1 200V、闪照5次脉冲强光处理后的菌悬液对NaCl的耐受性明显低于未经脉冲强光处理的对照组(P<0.01),并且E.coli存活率随着NaCl浓度的增高而显著降低,当NaCl浓度为3%时,存活率已下降为31.5%。这可能是因为脉冲强光使菌体胞膜受到损伤,引起通透性增加,从而对潜在性抑制剂的敏感性增高,屏障作用有所降低,胞外高渗溶液更容易加速菌体的死亡。
2.3 ·OH生成量对杀菌效果的影响
由于菌体处于水环境中,故·OH是主要的自由基。·OH是一种非常活跃的自由基,可导致细胞膜成分的过氧化,从而引起细胞膜流动性、通透性、不对称性和完整性的破坏,致使细胞死亡。
由图2、图3可知,E.coli的存活率与脉冲强度的增加呈负相关。在闪照5次的条件下,存活率随处理电压的增大而降低,处理电压为1 500V时,存活率仅为5.92%;在处理电压为1 200V的条件下,存活率随闪照次数的增大而降低,闪照8次,存活率已降低到8.62%。当1mol/L甘油俘获·OH后E.coli的存活率均有所增加,但差异不显著(P>0.05)。加入甘油后,E.coli存活率高于对照组,这是因为甘油俘获·OH后使其不能攻击菌体或攻击作用减少,也就是说菌体死亡一部分是·OH生成的结果。但这并不是脉冲强光致死微生物的主要原因。
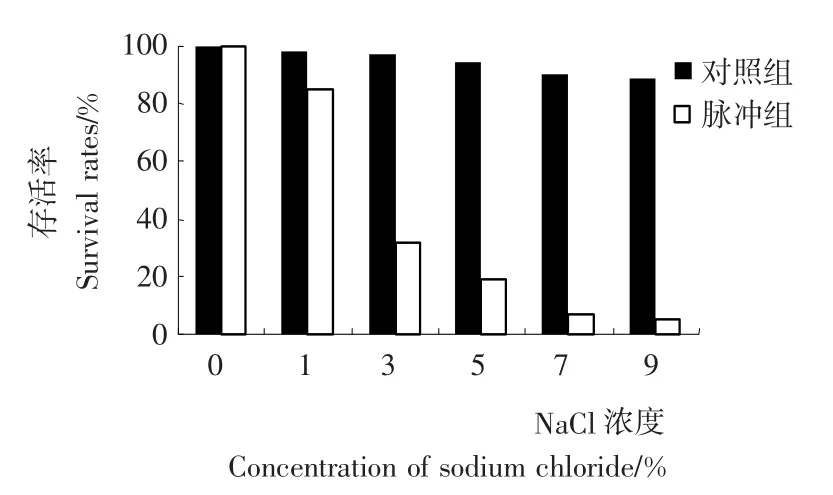
图1 脉冲强光作用后E.coli对NaCl的耐受性变化Figure 1 Effect in NaCl tolerance of E.coli after pulsed light irradiation
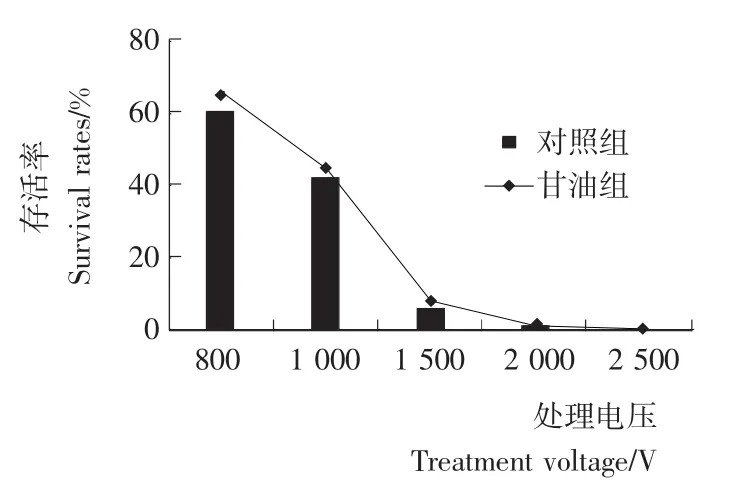
图2 处理电压对E.coli存活率的影响Figure 2 Effect of treatment voltage on the survival rate of E.coli
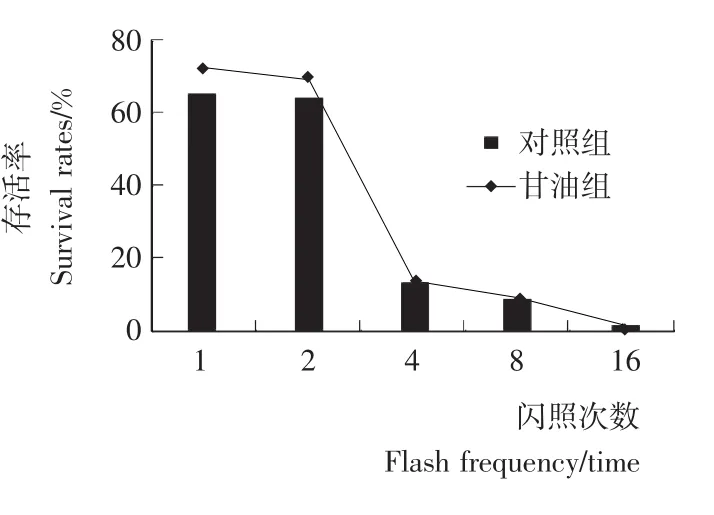
图3 闪照次数对E.coli存活率的影响Figure 3 Effect of irradiation times on the survival rate of E.coli
2.4 脉冲强光作用与MDA生成量的关系
机体产生的氧自由基能通过脂质过氧化物的分解产物改变细胞膜的流动性和渗透性,引起细胞损伤。因而MDA的含量常常可以反映机体内脂质过氧化的程度,间接地反映出细胞损伤的程度。
由表2可知,在闪照5次的条件下,MDA的生成量随处理电压的增大而增多;在处理电压为1 500V的条件下,MDA的生成量随闪照次数的增大而增多。测定结果表明,脉冲强光可使E.coli脂质过氧化,MDA的生成量与E.coli存活率相关。

表2 脉冲强光作用后E.coli胞内MDA生成量检测Table 2 Change of MDA in E.coli after pulsed light irradiation
2.5 胞内酶活性的变化
由于氧化应激态会造成细胞的损伤,而抗氧化酶系则可清除自由基,预防氧化应激态的发生。SOD、CAT是抗氧化酶系的两种基础代谢酶,通过检测其活性变化来反映脉冲强光对E.coli处理后细胞损伤状况。表3,表4分别显示的是脉冲强光作用后E.coli胞内SOD和CAT的活性变化。

表3 脉冲强光作用后E.coli胞内SOD活性变化Table 3 Change of SOD activity in E.coli after pulsed light irradiation

表4 脉冲强光作用后E.coli胞内CAT活性变化Table 4 Change of CAT activity in E.coli after pulsed light irradiation
由表3、表4可知,随着脉冲强度的增大,SOD和CAT的活性都有所降低,但这种降低幅度不大。在处理电压为1 200V的条件下,闪照32次时,SOD活性降低了14.49%;在处理电压为2 000V的条件下,闪照40次时,CAT活性降低了23.08%。SOD和CAT是细胞内重要的抗氧化酶,它们的失活应该不是细胞死亡直接引起的,因为细胞死亡后细胞内的酶应该是逐渐失活的,而电压800V、闪照4次的脉冲条件处理后就己经能够使细胞内的酶活性有所降低了。
3 结论
随着脉冲强度的增加,蛋白质漏出量和MDA生成量均有所增加,在处理电压为1 500V、闪照次数由4次增加至32次的条件下,蛋白质漏出量由6.75μg/mL增加至13.03μg/mL,MDA生成量由1.46nmol/L增加至2.76nmol/L;对NaCl的耐受性明显低于对照组,当NaCl浓度为9%时,对照组的存活率为88.4%,而脉冲组的存活率仅为4.8%。菌悬液中·OH与未经脉冲强光处理的相比较有所增加,胞内抗氧化酶活性降低,SOD活性最低降至83.78%,CAT活性最低降至76.92%。以上数据表明,脉冲强光处理对E.coli的细胞膜造成了严重损伤,并大幅降低了胞内酶的活性,这也可能是E.coli致死的主要原因之一。
1 周万龙,高大维.脉冲强光杀菌技术的研究[J].食品科学,1998(1):16~19.
2 Dunn J,Ott T,Clark W.Pulsed-light treatment of food and packaging[J].Food Technology,1995(9):95~98.
3 钱存柔.微生物学实验[M].北京:北京大学出版社,1985:176.
4 陈雅蕙,袁明秀.生物化学实验原理和方法[M].北京:北京大学出版社,2006:240~242.
5 陈勤.抗衰老的研究方法[M].北京:中国医学科技出版社,1996:485~490.
6 施特尔马赫.酶的测定方法[M].钱嘉渊,译.北京:中国轻工业出版社,1992:186~188.
Damage ofE.colicell membrane and intracellular enzymic activity induced by pulsed light irradiation
ZHANG Bai-qingGUO Jia-jia
(Food Science College of Shenyang Agricultural University,Shenyang,Liaoning110161,China)
After pulsed light treatment on the suspension ofE.coliin logarithmic growth phase,research the change of cell membrane permeability and intracellular enzymic activity.The result indicated that protein leakage and MDA formation increased with the decline of the survival rate ofE.coli.Through pilot studies,drawn input voltage to 1 500V,flash as 32times,the leakage of protein was 13.03μg/mL and the formation amount of MDA was 2.76nmol/L.NaCl tolerance was obviously lower than the control group(P<0.01).In addition,intracellular enzymic activity lower than untreated,SOD was decreased to 83.78%as well as CAT was decreased to 76.92%.Therefore,the damage of cell barrier structure caused the change of osmotic pressure and cell membranes permeability.It can change intracellular bacterial substances even it caused cell died.It would be certain meaning that synergistic reaction which hydroxyl radicals acted on lethality cell.
pulsed light;E.coli;membrane damage;intracellular enzymic activity
10.3969 /j.issn.1003-5788.2010.05.017
张佰清(1966-),男,沈阳农业大学副教授。E-mail:sybaiqingxl@sina.com
2010-06-11

