刺葡萄皮花色苷的光热降解特性研究
邓洁红谭兴和王 锋黄 菲张 涛
(1.湖南农业大学食品科技学院,湖南 长沙 410128;2.食品科学与生物技术湖南省重点实验室,湖南 长沙 410128;3.湖南生物机电职业技术学院,湖南 长沙 410127)
刺葡萄皮花色苷的光热降解特性研究
邓洁红1,2谭兴和1,2王 锋1,2黄 菲1张 涛3
(1.湖南农业大学食品科技学院,湖南 长沙 410128;2.食品科学与生物技术湖南省重点实验室,湖南 长沙 410128;3.湖南生物机电职业技术学院,湖南 长沙 410127)
为了解刺葡萄皮花色苷在光照及加热条件下的稳定性,明确其贮藏和应用条件,对刺葡萄皮花色苷的光热降解特性进行研究。结果表明:常温条件下,pH 1~3色素液花色苷稳定性较好;避光及室内自然光照条件下放置20d内刺葡萄皮花色苷的稳定性无显著差异,但强光条件下,刺葡萄皮花色苷稳定性明显下降;刺葡萄皮花色苷热降解符合动力学一级反应规律,pH 为1.0、3.0、4.5时,其热降解活化能Ea分别为99.385 6,83.364 5,73.741 9kJ/mol,说明低pH条件下,刺葡萄皮花色苷的热稳定性较好,但pH 1.0色素液在≥80℃加热时的花色苷半衰期t1/2≤4.10h,而pH 3.0、4.5色素液在同样加热条件下的t1/2≤14.12h、13.20h;高温处理(≥80℃)时,pH 3.0的色素液稳定性优于其余pH条件。
刺葡萄皮花色苷;稳定性;热降解;动力学
天然色素取代合成色素已成趋势。从植物中提取的花色苷色素,色泽鲜艳自然,使用安全,且具有一定的生理活性功能。研究[1-2]表明,花色苷等多酚类物质具有预防心脑血管疾病、预防癌症、抗氧化、消除自由基、改善肝脏功能等作用。但相比合成色素,花色苷色素不稳定、易降解,其稳定性受热、光、氧、金属离子、pH值、溶剂、花色苷浓度和结构、酶等因素的影响[3-5]。食品加工中的许多操作单元都不可避免用到热处理,如浓缩、杀菌等,将花色苷色素作为食品着色剂和添加剂使用,研究花色苷的热稳定性对于该类色素的应用非常重要。近年,中国学者对部分植物花色苷的热降解动力学进行了研究,如聂千[6]研究了笃柿色素的热降解动力学;励建荣等[7]研究了杨梅汁花色苷热降解特性;赵新淮[8]对黑加仑果渣红色素的热稳定性;方忠祥等[9]对紫肉甘薯中花色苷热降解动力学进行了研究,分别得出不同植物花色苷的热降解活化能及半衰期等重要参数。通过研究其热降解规律,有助于了解花色苷的降解机理,预测各种温度下的反应速率,继而采取合适的热处理参数。
刺葡萄 (vitis davidii fo3x.)属东亚品种,广泛分布于陕西、甘肃、华中、华南及西南等地。近年在湘西、湘西北地区对野生刺葡萄的人工培植获得成功,使当地刺葡萄产量逐年提高。刺葡萄果皮厚实、果肉小,作为食用鲜果其市场受到一定限制。笔者前期研究[10]表明,新鲜刺葡萄果皮花色苷含量达到2.5mg/g,为欧美葡萄品种的5倍以上,是优异的天然植物色素资源,开发和应用前景广阔,但关于刺葡萄皮花色苷的光热稳定性研究尚未见有关报道。本试验主要研究pH值、光照、热处理对刺葡萄皮花色苷稳定性的影响,对刺葡萄皮花色苷的热降解动力学进行深入分析和探讨,其目的在于建立热加工重要参数群,获得刺葡萄皮色素在应用中保持色泽的有利条件,为刺葡萄皮色素的扩大应用提供理论基础和实践指导。
1 材料与方法
1.1 试验材料
1.1.1 原料
刺葡萄:购于湖南省芷江县,洗净、晾干表面水,手工剥皮,冷冻干燥,粉碎,过60目筛,棕色瓶保存。
1.1.2 主要仪器
电子天平:ALC-210.4,北京赛多利斯仪器系统有限公司;
精密酸度计:pH-3C型,上海雷磁仪器厂;
分光光度计:722型,上海校光技术有限公司;
紫外分光光度计:UV-2450,日本岛津;
数显式电热恒温水浴锅:PC-1000,上海跃进医疗机械厂;
旋转蒸发器:RE52-3型,上海实验仪器厂有限公司;
真空循环水式多用泵:SHB-Ⅲ,郑州长城科工贸有限公司;
离心机:TDL-5,上海安亭科学仪器厂;
单道移液器:YQ005-YQ007,日本立洋。
1.1.3 主要试剂
盐酸、氢氧化钠、氯化钾、磷酸氢二钠、乙醇等:均为市售分析纯。
1.2 试验方法
1.2.1 刺葡萄皮色素提取 称取葡萄皮粉于三角瓶,以料液比1∶15加入70%(V/V)乙醇(含0.03%盐酸)提取,于50℃水浴锅内浸提1h,过滤,再用旋转蒸发仪(温度≤40℃)真空浓缩,回收乙醇,将得到的浓缩液进行抽滤[10]。
1.2.2 pH值对刺葡萄皮色素稳定性的影响试验 分别取1mL色素浓缩液用pH=1~7的缓冲液定容至50mL,其中pH 1为HCl-KCl缓冲液,其余为磷酸盐缓冲液;避光静置1h,在最大吸收波长处测定吸光度作为初始值A0,然后分别在遮光和自然光照条件下保存20d,期间每隔1d取样测吸光度A1,以A1/A0近似计算花色苷残存率。根据分光光度计扫描结果,最大吸收波长设定为:pH为1时520nm,pH为2~5时525nm,pH为6~7时550nm。
1.2.3 光照对刺葡萄皮色素稳定性的影响试验 依据1.2.2试验结果,用pH 1.0,3.0,4.5的缓冲液配制色素稀释液,分别于室内自然光及室外强光照射下保存9d,期间每隔1d测最大波长吸光度,检测光照条件对色素稳定性的影响。试验选择在10月中下旬进行,室外光照充足均匀。
1.2.4 热对刺葡萄皮色素稳定性的影响试验 取3份色素浓缩液,分别以HCl-KCl缓冲液和磷酸盐缓冲液调色素液为pH 1.0,3.0,4.5,将色素液分装在棕色试剂瓶中,恒温水浴锅加热处理,每2h取样一次,冷却后分别用pH 1.0的HCl-KCl缓冲液,pH 4.5的柠檬酸-磷酸氢二钠缓冲液定容,静置1h后,测最大吸收波长处吸光度Amax及700nm处吸光度A700nm(以蒸馏水作空白),以示差法A= (Amax-A700nm)pH 1.0-(Amax-A700nm)pH 4.5测定色素液吸光度值[11],以A热处理后/A热处理前计算花色苷残留值,对刺葡萄色素进行热降解动力学分析。各处理温度分别为:50,60,70,80,90℃。
1.2.5 刺葡萄皮花色苷热降解动力学参数解析 Arrhenius方程[5-7]描述了花色苷降解的动力学一级反应规律:

式中:
k——热降解反应常数;
C—— 色素液中花色苷最终浓度,mg/mL;
C0——色素液中花色苷初始浓度,mg/mL;
t—— 时间,h。
当用差示法测定色素液吸光度时,可用式(2)代替式(1),使计算简化。

式中:
A——色素液最终吸光度;
A0——色素液初始吸光度;
k——热降解反应常数;
t—— 时间,h;
k0—— 频率常数;
R—— 气体常数,8.314×10-3kJ/(mol·K);
Ea—— 热降解活化能,kJ/mol;
T—— 温度,K。
根据刺葡萄皮花色苷的热降解-ln(C/C0)-t图可进行热降解参数分析。
1.2.6 数据分析方法 试验数据以平均数表示。数据分析采用DPS统计软件,均值的多重比较采用Bonferroni法,P<0.05为差异显著。
2 结果与分析
2.1 pH值对刺葡萄皮色素稳定性的影响
如图1所示,等量刺葡萄皮花色苷色素液在pH 1~7的缓冲液中呈现出不同的初始吸光度A0,并伴有相应的颜色变化。在pH 1~4范围内,吸光度随pH值的上升而降低,颜色由红转紫;在pH 4~7范围内,其吸光度随着pH值的上升而增加,颜色由紫变蓝,颜色变化结果与Dao的研究[12]相一致。这可能是花色苷形式由红色的黄烊盐转变为蓝色醌式碱所致。
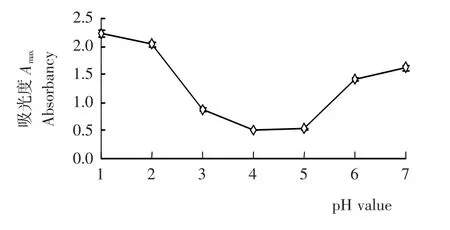
图1 刺葡萄皮花色苷在pH 1~7的初始吸光度Figure 1 The initial absorbancy of VSA at pH 1~7
由图2a可见,在常温避光条件下,pH 1~2的色素液稳定性很好,吸光度变化曲线平稳,观察期内(20d)花色苷残存率分别为93.7%和92.7%(见图3);pH 3的色素液比较稳定,20d内花色苷残存率为82.0%;pH 4~5的色素液稳定性较差,20d内花色苷残存率为36.8%和40.5%,且pH 1~5色素液吸光度的下降多发生在第4~5天;pH 6~7色素液在前2d内吸光度迅速下降,之后缓慢持续下降,表现出不稳定性,20d内花色苷残存率只有19.9%和20.6% 。由此可见,pH值对花色苷稳定性的影响较大,因此,刺葡萄皮色素适合在酸性较强的条件下使用。
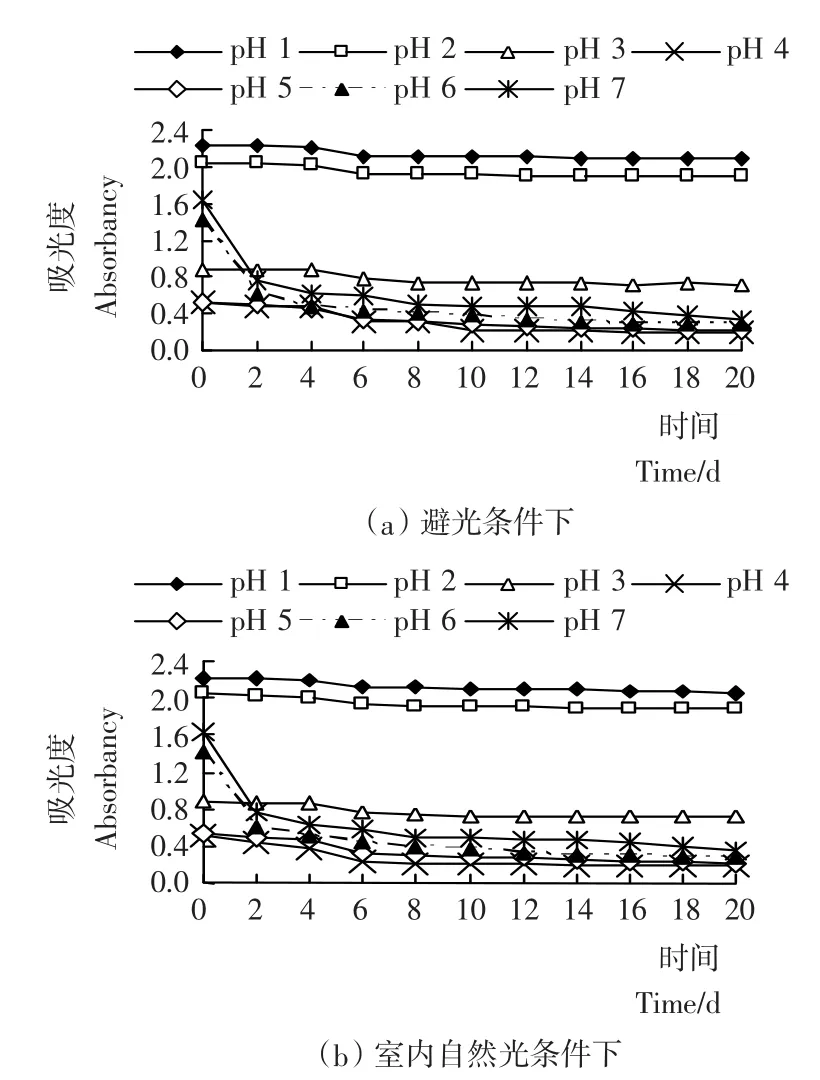
图2 pH值对刺葡萄皮花色苷稳定性的影响Figure 2 Effects of pH value on stability of VSA
比较图2a、b,在常温室内自然光照条件下,pH值对刺葡萄皮色素液吸光度的影响与避光条件下相似,且第20天花色苷保存率相差不大(如图3),因此,光照对花色苷稳定性影响的试验仅比较室内自然光照和室外强光照射两种情况。

图3 不同pH值下刺葡萄皮花色苷20d的残存率(避光及自然光照条件下)Figure 3 The residual rate of VSA at different pH value(20d,light-avoided or natural-light)
2.2 光照对刺葡萄皮色素稳定性的影响
刺葡萄皮色素液在室内自然光照及室外强光照射下的吸光度变化见图4。在3种pH值条件下,强光照射使色素液吸光度呈现短暂上升(第1天)后以更快的速度下降,说明紫外线短期照射对色素液有一定的加强色泽的作用,而长期照射使刺葡萄色素降解速度加快。紫外照射对花色苷的短期辅色作用在文献[13]中曾见报道。3种pH值条件下,强光照射9d,样液花色苷残存率分别为69.5%、53.7%、28.0%,而 室内 自然光照的对 比 值 为 91.9%、79.6%、38.9%。

图4 光照对刺葡萄皮花色苷稳定性的影响Figure 4 Effect of light on the stability of VSA
2.3 热对刺葡萄皮色素稳定性的影响
2.3.1 热处理对刺葡萄皮花色苷残留值的影响 由图5可知,在不同的pH值条件下,刺葡萄皮花色苷的热稳定性不同,pH 3.0的稳定性优于pH 4.5,在中等温度(50~60℃)条件下,pH 1.0的稳定性与pH 3.0相似,50℃加热32h,花色苷残留值分别为0.823和0.843,在而在较高温度(80~90℃)条件下,pH 1.0的稳定性变差,80℃加热12h花色苷残留值为0.135,而pH 3.0条件下的数据为0.508,这可能是因为强酸性导致花色苷高温水解所致。在相同pH值条件下,加热温度和时间对花色苷的稳定性影响较大,温度越高,加热时间越长,花色苷残留值越小,因此,刺葡萄皮花色苷不适合高温长时间处理。

图5 热处理对刺葡萄皮花色苷残留值的影响Figure 5 Effect of heat treatment on the residual rate of VSA
2.3.2 刺葡萄皮花色苷热降解动力学参数解析 分别对pH 1.0,3.0,4.5的色素液热稳定性作-ln(C/C0)-t图并进行线性回归,结果见图6。
结果表明线性关系良好(R2>0.97),刺葡萄皮花色苷热降解符合动力学一级反应规律。
在研究花色苷的热稳定性时,花色苷半衰期t1/2是一个重要的参数。计算花色苷降解一半所需的时间,可利用式(1)推导出公式:

式(6)中的k值可根据图6中每条直线的斜率求出。作-lnk-1/T关系图并线性回归,根据式(5),则直线的斜率为Ea/R,截距为-lnk0,由此可求出不同pH色素液的热降解活化能Ea。刺葡萄皮花色苷(VSA)的热降解动力学参数见表1。

图6 刺葡萄皮花色苷热降解ln(C/C0)-t的关系Figure 6 The ln(C/C0)-t relationship of degradating VSA under heating
反应常数k表明花色苷热降解的速率,而活化能是决定反应速率的一个重要因素(另一个重要因素是频率常数k0),在一定温度下,活化能越大,热降解反应速率越慢。表1数据显示,以活化能计,pH 1.0>pH 3.0>pH 4.5,说明低pH值条件下,刺葡萄皮花色苷的热稳定性较好,有利于色素的热处理及保存。但值得注意的是,当pH 1.0,色素液在80~90℃的高温下,花色苷水解加剧,致使热降解速率加快。
2.3.3 刺葡萄皮花色苷热降解温度系数 由表1可知,降低温度使刺葡萄皮花色苷的半衰期大大延长,可见温度对花色苷热降解反应影响明显。为量化温度对反应速率的影响,引用Vanthoff规则:

式中:
Q10——温度系数,其值越大,表示热降解反应速率对温度变化越敏感;
T1,T2—— 变化前、后的加热温度,℃;
k1—— 温度T1时的速率常数;
k2—— 温度T2时的速率常数。

表1 刺葡萄皮花色苷热降解动力学参数Table 1 The kinetic prameters of thermal degradation of VSA
刺葡萄皮花色苷热降解的温度系数Q10见表2。pH 1.0条件下,刺葡萄皮花色苷在70~80℃的Q10值明显大于其它温度范围内的Q10,说明当热处理温度从70℃提高到80℃时,花色苷降解速率迅速加快,而80~90℃时,降解速率变化不敏感。pH 3.0和pH 4.5条件下,花色苷降解速率对温度反应最敏感的区域均发生在80~90℃范围内。

表2 刺葡萄皮花色苷热降解的温度系数Q10Table 2 The thermal degradation parameter Q10of VSA under different temperature
3 讨论
3.1 pH值对刺葡萄皮色素的影响
刺葡萄皮色素的主要成分为花色苷,其稳定性受到多种因素的影响,花色苷降解的直观变化为颜色变淡。pH值是影响刺葡萄皮色素颜色强度的主要因素,在强酸性条件下(pH≤2.0)呈鲜红色,这是因为黄烊阳离子(AH+)占主导[14-15];在pH=2.5~4.0时,刺葡萄皮花色苷呈自然的紫红色或紫色;pH=4.5~6.0为蓝紫色;碱性条件下为蓝绿到黑褐色。pH值不仅影响刺葡萄皮色素的呈色,对其稳定性的影响也很大,在避光及室内自然光照条件下,pH=1~3的色素液表现出较好的稳定性,随着pH值上升,刺葡萄皮色素液的稳定性下降。因此,刺葡萄皮花色苷适合在较强酸性条件下使用。笔者[16]前期研究表明,刺葡萄皮色素应用于汽水、果冻、酸奶等食品获得较好着色效果。
3.2 光对刺葡萄皮色素的影响
光照对刺葡萄皮花色苷有一定的降解作用。在pH 1.0、3.0、4.5 3种酸度下,室内自然光照与避光条件对花色苷降解的影响区别不显著(观察期20d);室外强光加速花色苷的降解。因此该色素在处理和贮藏过程中,应尽量避免强光照射,长期保存应避光。有观点[17]认为,光诱导花色苷降解主要是存在分子态氧的原因,因此,刺葡萄皮色素在食品中应用时,采用真空包装也是提高产品稳定性的有效措施。
3.3 热对刺葡萄皮色素的影响
通过对半衰期t1/2及温度系数Q10的分析,pH 1.0色素液在80℃以上的条件下花色苷热降解半衰期明显下降。该研究结果与其它植物来源花色苷的热降解性呈现出一定差异,文献[18]报道,pH 1.0杨梅汁花色苷在85℃以上高温下的半衰期仍然大于pH 3.1及pH 4.5样品的对应值。而综合比较,pH 3.0条件对保持刺葡萄皮花色苷在高温下的稳定性最为有利。经测定,新鲜刺葡萄皮色素原液的pH值为3.08,接近自然生长状态的pH值环境是否加强了植物花色苷的稳定性,值得进一步研究和探讨。根据刺葡萄皮花色苷热处理半衰期的特点,在该色素热加工过程中,尤其是高温热处理时(≥80℃),应控制色素液的pH值在3.0左右。
4 结论
(1)pH值对刺葡萄皮花色苷的稳定性影响明显,pH 1~3适合色素液的保存。
(2)室内自然光照对刺葡萄皮花色苷的影响与避光条件下无显著差异。
(3)刺葡萄皮花色苷的热降解符合动力学一级反应方程。同一pH值条件下,降低温度能有效延长刺葡萄皮色素的半衰期;不同pH条件下,刺葡萄皮花色苷降解所需的活化能Ea(pH 1.0)>Ea(pH 3.0)>Ea(pH 4.5),Ea分别为99.385 6,83.364 5,73.741 9kJ/mol,说明低pH值有利于刺葡萄皮花色苷的保存。加热温度超过80℃ 时 ,pH 1.0色素液花色苷的半衰期t1/2≤4.10h,远低于pH 3.0、pH 4.5色素液的对应值(t1/2≤ 14.12,13.20h),高温水解反应加速了花色苷的热降解。
1 高尧来,温其标,张福艳.葡萄酒中的多酚类物质及其保健功能[J].食品与发酵工业,2002,28(8):68~72.
2 Bakker J,Timberlake C F.The distribution of anthocyanins in grape skin extracts of port wine cultivars as determined by high performance liquid chromatography[J].Journal of Science of Food and Agriculture,1985(36):1 315~1 324.
3 Mazza G,Brouillard R.The mechanism of copigmentation of anthocyanins in aqueous solutions[J].Phytochemistry,1990(29):1 097~1 102.
4 De Rosso V V,Mercadante A Z.Evaluation of colour and stability of anthocyanins from tropical fruits in an isotonic soft drink system[J].Innovative Food Science and Emerging Technologies,2007,8(3):347~352.
5 Aysegul Kirca,Mehmet Ozkan,Bekir Cemeroglu.Effects of temperature,solid content and pH on the stability of black carrot anthocyanins[J].Food Chemistry,2007(101):212~218.
6 聂千.笃柿色素热稳定性的动力学研究[J].哈尔滨商业大学学报(自然科学版),2003,19(6):697~699.
7 励建荣,岑沛霖,Joyce D C.杨梅汁内花色苷热降解动力学研究[J].科技通报,2002,18(1):1~5.
8 赵新淮.黑加仑果渣红色素的稳定性及热降解动力学[J].食品工业科技,1998,19(3):8~9.
9 方忠祥,倪元颖,唐建成.紫肉甘薯中花色苷热降解动力学研究[J].食品工业科技,2004,25(3):111~114.
10 邓洁红,谭兴和,郭时印,等.响应面法优化刺葡萄皮色素提取工艺参数[J].湖南农业大学学报(自然科学版),2007,33(6):694~699.
11 Wrolstad R E,Robert W Dursta,Jungmin Lee.Tracking color and pigment changes in anthocyanin products[J].Trends in Food Science and Technology,2005(16):423~428.
12 Dao L T,Takeoka G R,Edwards R H,et al.Improved method for the stabilization of anthocyanidins[J].Journal of Agricultural and Food Chemistry,1998(46):3 564~3 569.
13 Bakowska A,Kucharska AZ,Oszmianski J.The effects of heating,UV irradiation and storage on stability of the anthocyaninpolyphenol copigment complex[J].Food Chemistry,2003(81):349~355.
14 庞志中.花色苷研究概况[J].北京农业科学,2000,18(5):37~42.
15 Cristina G V,Peter B.Influence of structure on colour stability of anthocyanins and flavylium salts with ascorbic acid[J].Food Chemistry,1999(64):21~26.
16 潘小红,谭兴和,邓洁红,等.刺葡萄色素对酸奶感官理化性质和乳酸菌的影响[J].食品工业科技,2007,28(9):183~185.
17 Attoe E L,Von Elbe J H.Photochemical degradation of betanine and selected anthocyanins[J].Journal of Food Science,1981(46):1 934~1 937.
18 辛修锋,余小林,胡卓炎,等.杨梅澄清汁及浓缩汁中花色苷热降解动力学研究[J].农业工程学报,2007,23(9):251~255.
Study on the photic and thermal degradation characteristics of vitis skin anthocyanins
DENG Jie-hong1,2TAN Xing-he1,2WANG Feng1,2HUANG Fei1ZHANG Tao3
(1.College of Food Science and Technology,Hunan Agricultural University,Changsha,Hunan410128,China;2.Hunan Provincial Key Laboratory of Food Science and Biological Technology,Changsha,Hunan410128,China;3.Hunan Biological and Electromechanical Polytechnic,Changsha,Hunan410127,China)
Light and heating are the important facts to impact the stability of anthocyanins.The photic and thermal degradation characteristics of vitis skin anthocyanins(VSA)were studied in order to realize its storage and application conditions.The results showed as follows:VSA was stable at pH1~3under nomal temperature;There was not significant difference between the stability of VSA under light-avoided condition and that of under natural-light(20d),and the stability of VSA declined due to sunlight;It proved that the thermal degradation of VSA follows the one-stage kinetic reaction equation;At pH 1.0,pH 3.0,pH 4.5,the thermal degradation Activation Energy(Ea)were 99.385 6,83.3645and 73.741 9kJ/mol respectively,and that meant higher thermal stability of VSA could be achieved at lower pH.At pH1.0when heating temperature was risen up to 80℃,however,the half life of VSA was shorter(t1/2≤4.10h)than that at pH 3.0(t1/2≤14.12h)and at pH 4.5(t1/2≤13.20h),it suggested that the hydrolization reaction should be paid more attention to under vey high temperatures and very strong acidity,pH 3.0VSA was of the best stability when processed under very high temperatures(≥80℃).
vitis skin anthocyanins(VSA);stability;thermal degradation;kinetics
10.3969 /j.issn.1003-5788.2010.05.016
湖南省自然科学基金资助项目(编号:08JJ6005);湖南农业大学稳定人才基金(编号:09WD35)
邓洁红(1967-),女,湖南农业大学教授,博士。E-mail:hongjiedeng@163.com
2010-05-10

