质粒pBR322DNA与内切酶EcoRI相互作用的研究
张志勇,王艳伟,杨光参
(温州大学物理与电子信息工程学院,浙江温州 325035)
质粒pBR322DNA与内切酶EcoRI相互作用的研究
张志勇,王艳伟,杨光参†
(温州大学物理与电子信息工程学院,浙江温州 325035)
借助原子力显微镜(AFM)对DNA与内切酶的切割与结合作用进行研究.当缓冲液中有Mg2+存在时,内切酶EcoRI会在单一识别位点处切割pBR322DNA,如果缓冲液中的Mg2+用Ca2+代替,内切酶EcoRI则会与pBR322DNA在单一识别位点处结合,并且切割率与结合率都随着内切酶浓度的增加而增加.
DNA;内切酶;切割;结合
DNA是生物体的遗传物质,同时也是染色体的主要组成部分[1-2].限制性内切酶是生物学中广为使用的一种工具酶,能使多核苷酸链发生断裂,但是它只对脱氧核糖核酸内的一定碱基序列中的某一特定位置发生作用,把这个特定位置的链切开,所以通过内切酶可以将某一个遗传基因给切下来[3-5].如果再将这一基因连在其它细胞遗传基因上,组成新细胞,则该新细胞会具有新的遗传特性与功能.因此,限制性内切酶的存在使DNA分子之间的重组成为了可能.
DNA与内切酶的相互作用在生物学中有重要意义.DNA与蛋白质分子相结合的精确位点图谱和不同细胞状态下结合位点的测定对研究复杂细胞体系的机理与功能,特别是基因表达的控制是十分关键的.原子力显微镜(AFM)高度分辨率可达0.1 nm,宽度分辨率可达2 nm,已广泛用于表征各种DNA与蛋白质的复合物.原子力显微镜中,云母是研究DNA构象变化和DNA-蛋白质相互作用的常见基底[6-7],其表面具有原子级别的平整度,而且带有负电荷,有利于吸附在表面的核酸的处理,这也是原子力显微镜广泛应用于纳米生物科学研究的重要原因[8-9].
带负电的云母表面与带负电的磷酸根骨架间有天然的排斥作用,为了消除这种作用,常在沉积缓冲液中加入二价离子[10-11]或者三价离子[12].1983年,Terry等人[13]研究了控制EcoRI与DNA特异性作用与非特异性作用的热动力学系数,1986年,McClarin等人[14]确定了EcoRI与DNA作用复合物的具体结构,1999年,Wright[15]等人又进一步提出了EcoRI与DNA结合与分离的动力学机制,这些研究结果为进一步在云母片上面研究DNA与内切酶的相互作用提供了主要依据.
EcoRI是一种小的内切酶(31KDa),通过二聚体的形式与DNA发生作用,其识别序列是5’-GAATTC-3’[16].本文利用AFM对内切酶EcoRI与质粒pBR322DNA的相互作用进行研究.结果表明,内切酶EcoRI与质粒pBR322DNA有单一的识别位点,有酶辅助因子镁离子存在于缓冲液中时,内切酶会对DNA有切割作用,如果缓冲液中的镁离子用钙离子代替,那么内切酶的切割作用会被限制,蛋白反而会与DNA结合,并且切割率与结合率都随着内切酶浓度的增加而增加.
1 材料与方法
1.1 材 料
PBR322DNA(4632bp,环状)购于NEB(北京)公司,原始浓度是500 ng·μL-1.内切酶EcoRI购买于sigma(美国)公司,原始浓度是5 unit·μL-1.氯化镁与氯化钙等化学试剂都是分析纯,购于北京经科宏达公司.实验用水都是超纯水(经密理博超纯水系统过滤、去离子化处理).云母做成1 cm × 1 cm的正方形,每次用前都用透明胶重新解离,以保证云母片表面的平整度与清洁.
1.2 AFM成像
本文使用的AFM是日本京都岛津公司生产的,型号为SPM-9600.文中所有图像都是在空气中采用轻敲模式获得的,扫描速度都是3 Hz,图片像素都是512 × 512.AFM图像中关于DNA高度、宽度等信息的分析都是从SPM-9600自带的离线分析软件获得的.
1.3 AFM样品准备
1)用移液器量取200 μL缓冲液(20 mmol·L-1Tris-HCl、50 mmol·L-1NaCl、10 mmol·L-1MgCl2·6H2O或者20 mmol·L-1Tris-HCl、50 mmol·L-1NaCl、10 mmol·L-1CaCl2·6H2O)放入离心管中,贴上标签.向缓冲液中加入0.5 μL的λ-DNA(500 ng·μL-1)与不同量的EcoRI(5 unit·μL-1)内切酶轻弹混匀.再将离心管置于37℃的干式恒温箱内放置30分钟.
2)用移液器吸取20 μL离心管中的混合液,滴在已经处理过的云母片上,盖上玻璃罩,防止灰尘落入影响成像的效果,沉积2分钟(使用计时器计时).沉积2分钟后用超纯净水洗涤云母表面的样品,用移液器吸取超纯净水,从云母片的一端滴,再从云母片的另一端吸,在洗涤过程中,移液器的枪头不要触碰云母片,以防破坏云母片,不利于观察,此过程重复10 – 15次.接着用氮气将样品吹干,在吹的过程中吹的方向与洗涤的方向保持一致.
3)用以上的步骤制作多个样品,样品按照顺序标记好,记录每个样品的具体时间与条件.最后将样品放在玻璃皿中,在室温干燥箱内干燥2个小时以上.将制好样品放于AFM下观察成像.
2 结果与讨论
2.1 内切酶与DNA的切割作用
有关内切酶与DNA作用的研究与讨论很多,大多数内切酶与DNA的相互作用都需要Mg2+作为催化辅助因子[17-19].有镁离子存在时,内切酶具有很大的切割活性,内切酶会识别DNA4-8碱基对的特异序列,然后在这个识别位点上或者附近切割 DNA[20-22].本文利用 AFM 对内切酶EcoRI与质粒pBR322DNA的相互作用进行研究,用含有Mg2+的缓冲液实验,实验结果如图1所示,环状的DNA被切开,变成线状结构,并且只有一个断口.从图1还可以看出,随着内切酶浓度的增加,DNA被切割的数目也在增加.
从切割后不同DNA结构的统计图(图1的D、E、F)可以看出,刚开始内切酶浓度较小时,内切酶浓度增加对切割率的影响不是很大,当内切酶的浓度大于5 unit·μL-1时,DNA被切割的比例明显增加.
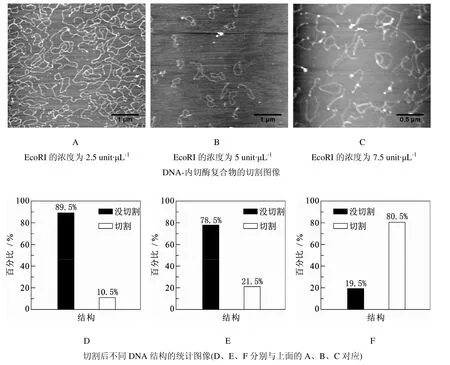
图1 有Mg2+存在的条件时, 内切酶EcoRI与DNA的切割作用图
2.2 内切酶与DNA的结合作用
用含有Ca2+的缓冲液代替Mg2+缓冲液进行实验,实验结果如图2所示.从图2中可以清晰看见DNA上面有结合的内切酶,并且内切酶的浓度越大,其与DNA的结合率越高.内切酶的浓度比较低时,DNA上面的内切酶很少,只有个别DNA上面有一个结合的内切酶,随着内切酶浓度的增加,每个DNA上面几乎都有结合的内切酶酶,而且不止一个(这是由一些非特异性的结合导致的,不止在识别位点与DNA结合),甚至当内切酶的个数多到一定程度,DNA之间因为内切酶的作用会发生交联,或者凝聚.由此可见,有Ca2+存在时,内切酶的切割作用被限制,内切酶与DNA的特异性识别位点有结合作用.与浓度对切割率的影响不同,刚开始内切酶浓度较小时,内切酶浓度增加对结合率的影响就很大,在内切酶的整个实验浓度范围内,结合率都在随内切酶浓度的增加而快速增加.有钙离子存在时,内切酶可以结合到DNA的特定位点,这在基础生物化学中有重要意义.
内切酶与DNA的特异性识别位点有结合作用,是因为有Ca2+存在时,内切酶与DNA作用会产生特异性蛋白-金属-DNA复合物[20-22],这种稳定的三元复合物会阻碍内切酶对DNA的切割作用,增加两者的结合性.
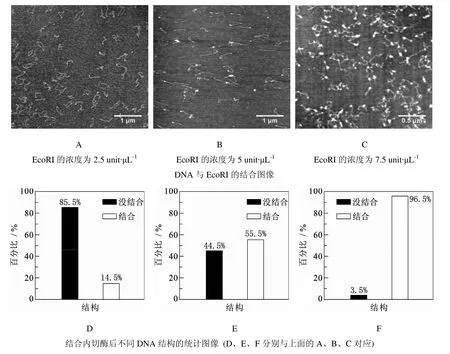
图2 有Ca2+存在时, 内切酶EcoRI与DNA的结合作用图
3 结 论
内切酶EcoRI与质粒pBR322DNA的相互作用主要有两种,它们之间有单一的特异性识别位点.在有酶辅助因子镁离子存在时,内切酶对DNA有切割作用,环状DNA被切成线状,而且只有一个断口;如果用钙离子代替镁离子实验,内切酶的切割作用就会被限制,蛋白会在识别位点处与DNA结合,一根DNA上面会结合一个内切酶的二聚体.内切酶EcoRI与质粒pBR322DNA的结合率与切割率都随内切酶的浓度增加而增加,结合率增加的速度更快一些.
[1] Watson J D, Crick F. The structure of DNA [J]. Cold Spring Harbor Symposia on Quantitative Biology, 1953, 18: 123-124.
[2] Dulbecco R. A turning point in cancer research: sequencing the human genome [J]. Science, 1986, 231(4742): 1055-1056.
[3] Kuspa A, Loomis W F. Tagging developmental genes in Dictyostelium by restriction enzyme-mediated integration of plasmid DNA [J]. Proceedings of the National Academy of Sciences of the United States of America, 1992, 89: 8803-8807.
[4] Smith H O, Birnstiel M L. A simple method for DNA restriction site mapping [J]. Nucleic acids research, 1976, 3: 2387-2398.
[5] Nathans D, Smith H O. Restriction endonucleases in the analysis and restructuring of DNA molecules [J]. Annual review of biochemistry, 1975, 44(1): 273-293.
[6] Hamon L, Pastré D, Dupaigne P, et al. High-resolution AFM imaging of single-stranded DNA-binding (SSB) protein-DNA complexes [J]. Nucleic acids research, 2007, DOI: 10.1093/nar/gkm147.
[7] Sorel I, Piétrement O, Hamon L, et al. The EcoRI-DNA Complex as a Model for Investigating Protein-DNA Interactions by Atomic Force Microscopy [J]. Biochemistry, 2006, 45: 14675-14682.
[8] Oh S J, Hong B J, Choi K Y, et al. Surface modification for DNA and protein microarrays [J]. OMICS: A journal of Integrative Biology, 2006, 10(3): 327-343.
[9] Liu Q, Wang L, Frutos A G, et al. DNA computing on surfaces [J]. Nature, 2000, 403(6766): 175-179.
[10] Pastré D, Piétrement O, Fusil S, et al. Adsorption of DNA to mica mediated by divalent counterions: a theoretical and experimental study [J]. Biophysical journal, 2003, 85(4): 2507-2518.
[11] Rivetti C, Guthold M, Bustamante C. Scanning Force Microscopy of DNA Deposited onto Mica: Equilibration versus Kinetic Trapping Studied by Statistical Polymer Chain Analysis [J]. Journal of molecular biology, 1996, 264(5): 919-932.
[12] Pastré D, Hamon L, Landousy F, et al. Anionic polyelectrolyte adsorption on mica mediated by multivalent cations: a solution to DNA imaging by atomic force microscopy under high ionic strengths [J]. Langmuir, 2006, 22(15): 6651-6660.
[13] Terry B, Jack W, Rubin R. et al. Thermodynamic parameters governing interaction of EcoRI endonuclease with specific and nonspecific DNA sequences [J]. Journal of Biological Chemistry, 1983, 258(16): 9820-9825.
[14] McClarin J A, Frederick C A, Wang B C, et al. Structure of the DNA-Eco RI endonuclease recognition complex at 3 A resolution [J]. Science, 1986, 234(4783): 1526-1541.
[15] Wright D J, Jack W E, Modrich P. The kinetic mechanism of EcoRI endonuclease [J]. Journal of Biological Chemistry 1999, 274(45): 31896-31902.
[16] Allison D, Kerper P, Doktycz M, et al. Direct atomic force microscope imaging of EcoRI endonuclease site specifically bound to plasmid DNA molecules [J]. Proceedings of the National Academy of Sciences of the United States of America, 1996, 93(17): 8826-8829.
[17] Brautigam C A, Steitz T A. Structural and functional insights provided by crystal structures of DNA polymerases and their substrate complexes [J]. Current Opinion in Structural Biology, 1998, 8: 54-63.
[18] Galburt E A, Stoddard B L. Catalytic mechanisms of restriction and homing endonucleases [J]. Biochemistry, 2002, 41: 13851-13860.
[19] Yang W, Lee J, Nowotny M. Making and breaking nucleic acids: two-Mg2+-ion catalysis and substrate specificity [J]. Molecular Cell, 2006, 22: 5-13.
[20] Roberts R J, Halford S E. Type II restriction enzymes [C] // Linn S M, Lloyd R S, Roberts R J. Nucleases. New York: Cold Spring Harbor Laboratory Press, 1993: 35-88.
[21] Aggarwal A K. Structure and function of restriction endonucleases [J]. Current Opinion in Structural Biology, 1995, 5: 11-19.
[22] Perona J J. Type II restriction endonucleases [J]. Methods, 2002, 28: 353-364.
Study on Interaction between Plasmid pBR322DNA and Endonuclease EcoRI
ZHANG Zhiyong, WANG Yanwei, YANG Guangcan
(College of Physics and Electronic Information Engineering, Wenzhou University, Wenzhou, China, 325035)
The interaction of cleaving and binding between DNA and endonucleases EcoRI was observed by atomic force microscope (AFM). The findings showed that in the presence of Mg2+in buffer, endonucleases EcoRI can cleave pBR322DNA on one specific recognition site; while, if Ca2+took the place of Mg2+in buffer, endonucleases EcoRI can bind pBR322DNA on the specific recognition site. The cleaving and binding ratio would increase with the increase of concentration of endonucleases.
DNA; Endonuclease; Cleaving; Binding
(编辑:王一芳)
Q633
A
1674-3563(2011)05-0032-06
10.3875/j.issn.1674-3563.2011.05.006 本文的PDF文件可以从xuebao.wzu.edu.cn获得
2011-03-29
国家重点基础研究项目(2007CB935900);国家自然科学基金(10974146, 20934004);浙江省自然科学基金(Y6090222)
张志勇(1980- ),男,湖南宁远人,硕士研究生,研究方向:生物物理.† 通讯作者,yanggc@wzu.edu.cn

