发酵石榴酒的色泽变化
庄惠婷,杜金华,郭春宝,王聪
石榴 (Punica granarumL.)为石榴科石榴属植物,含有大量具有抗氧化作用的酚类物质,如总酚、花色苷等[1]。石榴品种与生长条件都会影响石榴中每种花色苷的含量及其比例。不同花色苷间的比例对石榴酒色度和颜色稳定性有显著影响[2]。影响这 2种性质的根源是花色苷 B环的羟基化形式,蓝色随羟基数目的增加而加深;红色则随着甲基化数目的增多而增强。然而,花色苷极易受某些理化因素的影响而发生降解或引起褪色,如酶、温度、氧气、光、pH值、糖及其降解产物、金属离子以及植物中的代谢产物等[3]。果酒的色度、色调是评价果酒外观质量的一个重要指标,根据果酒的色度和色调,能够判断一瓶果酒的氧化程度和质量好坏。因此,研究酿造过程及发酵前后石榴酒色泽变化具有重要意义,可以为酿造工艺的改进提供参考依据。
试验以 3种石榴为原料,通过测定色度、色调、花色苷含量,研究了发酵过程中 3个指标的变化情况及发酵前后石榴汁色泽的变化,对色度、色调、花色苷含量进行了相关性分析。
1 材料与方法
1.1 材料
青皮甜石榴、青皮酸石榴-购于泰安市水果批发市场;泰山红石榴-购于泰安市白马石民俗文化村榴香园;果酒干酵母;果胶酶等。
1.2 主要试剂
H2SO3(分析纯):天津市大茂化学试剂厂;KCl(分析纯):天津市凯通化学试剂有限公司;HCl(分析纯):莱阳市康德化工有限公司;乙酸钠 (分析纯):天津市凯通化学试剂有限公司。
1.3 主要仪器
UV-2100型分光光度计,尤尼柯 (上海)仪器有限公司;电子天平,梅特勒-托利多仪器 (上海)有限公司;DELTA 320 pH计,梅特勒-托利多 (上海)有限公司。
1.4 试验方法
1.4.1 石榴汁制备
选择新鲜、成熟、无病斑的石榴,用冷水清洗,除去表面杂物。手工去皮,尽可能使籽粒与隔膜分离,添加适量的果胶酶然后将籽粒压榨取汁,将榨出的混浊汁用纱布过滤。将石榴汁分为 2组:一组添加 50 mg/L的 SO2,另一组不添加,静置过夜备用。
1.4.2 发酵石榴酒
调整石榴汁,果酒干酵母石榴汁活化,添加量按酵母使用说明,添加到石榴汁中,在自然 pH、20℃恒温条件下密闭发酵。发酵后期通过测定含糖量连续2 d不再降低时终止发酵。发酵结束测各个理化指标。倒桶澄清时补加 SO2,适情况而定补加量。测定石榴原汁、发酵过程中及结束后的色度、色调、花色苷含量。
1.4.3 分析方法
1.4.3.1 色度、色调测定
石榴酒经 0.45μm孔径的滤纸过滤,以水做空白对比 (在测定前也经 0.45μm滤纸过滤),装入比色杯中使用分光光度计分别在 420 nm和 520 nm波长处比色,色度值 =A420+A520,色调值 =
1.4.3.2 花色苷测定方法
采用 pH差示法,参考 Giust和 W rolstad(2001)[5]的方法并做了改进。
取 1 mL果汁分别用 pH值 1.0〔0.2 mol/L KCl∶0.2 mol/L HCl体积比 =25∶67〕与 pH4.5〔1 mol/L NaAc∶1 mol/L HCl∶H2O体积比 =100∶60∶90〕的缓冲溶液分别稀释至适当倍数,室温暗处放置 30 min,以蒸馏水为对照,测定λmax下的吸光值A(以 1%HCl-H2O溶液稀释,在 400~600 nm进行波长扫描)。按下式计算花色苷相对含量。
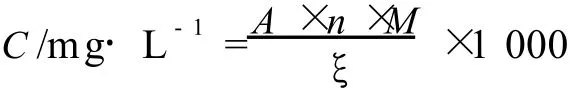
式中 :A=(Aλmax-A700)pH1.0-(Aλmax-A700)pH4.5;
n,稀释倍数;M,花色苷相对分子质量 (449.2);ξ,花色苷摩尔吸光系数 (26900)。
1.5 数据分析
试验结果均为 3次平行试验的平均值。采用Excel、DPS数据处理软件进行数据分析。
2 结果与分析
2.1 花色苷最大吸收波长确定
由图1可知,3个品种石榴汁的最大扫描波长略有不同,青皮甜石榴最大扫描波长为 513nm,青皮酸石榴为 496nm,泰山红石榴为 514 nm。这可能主要是由于不同品种所含的花色苷的种类和含量决定的。目前,已发现有 500种多花色苷[6]和 23种花青素[7-8]。在 23种花青素中仅有 6种是最常见的,他们是分别是天竺葵色素 (Pg)、芍药色素 (Pn)、矢车菊色素 (Cy)、锦葵色素 (Mv)、牵牛花色素 (Pt)和飞燕草色素 (Dp)[9]。Yunfeng等[10]报道石榴汁中 3种主要的花色苷是:飞燕草花色苷、矢车菊花色苷、天竺葵花色苷,但在不同石榴品种中含量比例不同可能是导致最大扫描波长不一致的主要原因。
2.2 发酵过程中色泽变化
2.2.1 发酵过程中花色苷含量的变化
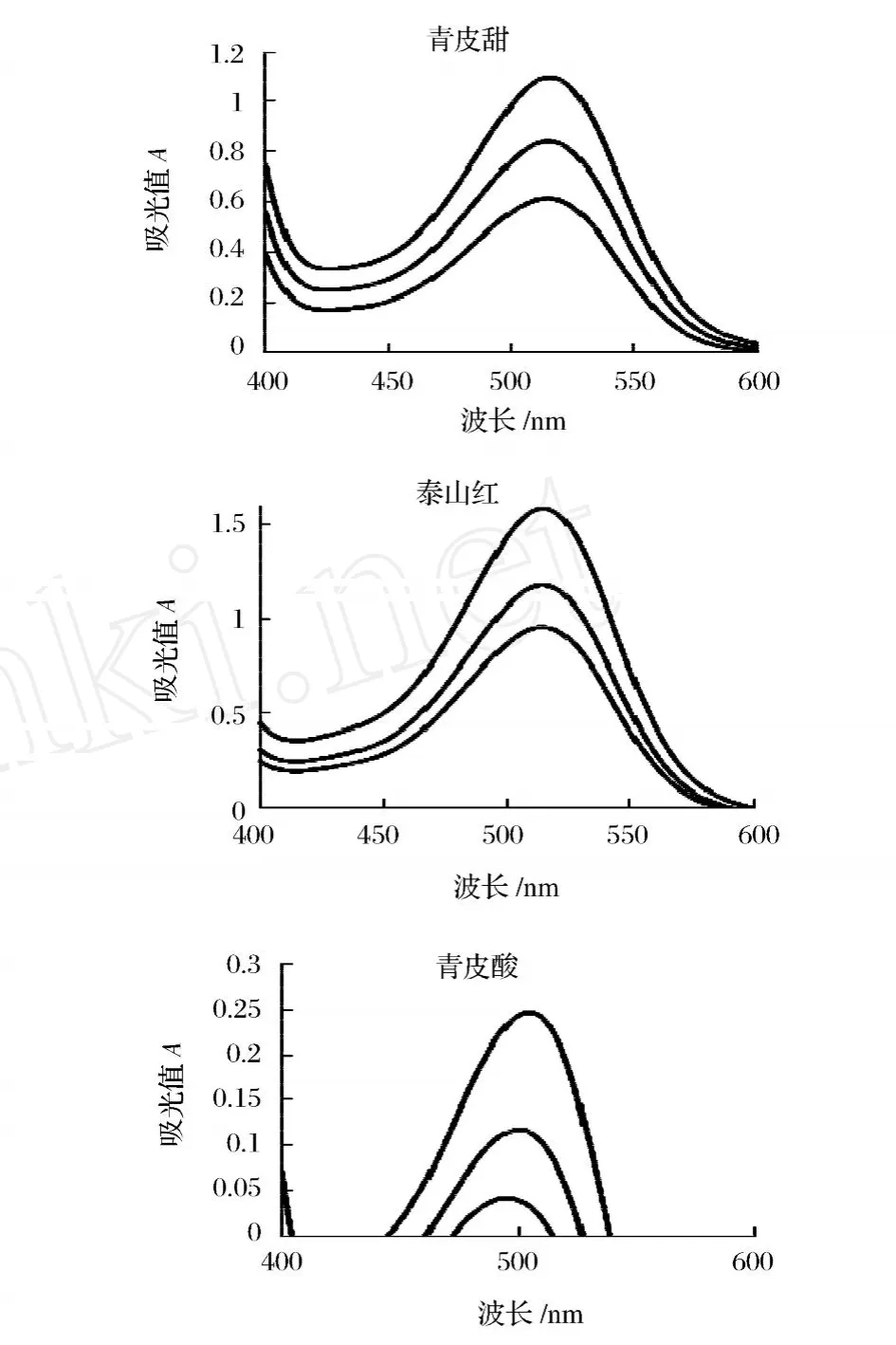
图1 3品种石榴汁花色苷扫描图谱注:同一图中的不同曲线是在不同稀释倍数下测得的。
由图2可以看出发酵过程中花色苷含量明显减少且前 3天的下降速度最快,后期趋于平稳。发酵结束时 3品种间花色苷含量具有显著性差异 (P<0.01),泰山红含量最高为 50.7 mg/L,青皮甜、青皮酸次之。进行发酵时仅与皮、籽接触几天的醪会出现颜色损失。损失的原因主要是由于复合物解离而引起光吸收减弱。在整个发酵过程中青皮甜石榴不添加 SO2处理的花色苷损失率为 28.49%,添加 SO2处理的为 34.47%;泰山红不添加 SO2处理的花色苷损失率为 34.28%,添加 SO2处理的为 31.70%(无显著性差异P>0.05);青皮酸石榴不添加处理的花色苷损失率为 30.02%,添加处理的为 35.05%。添加SO2处理的损失率高主要是由于:SO2会在果汁或果酒中酸的作用下形成 HSO3-,进而对花色苷 2位碳亲核进攻生成无色的花色苷亚硫酸盐复合物[5]。2.2.2 发酵过程中色度的变化
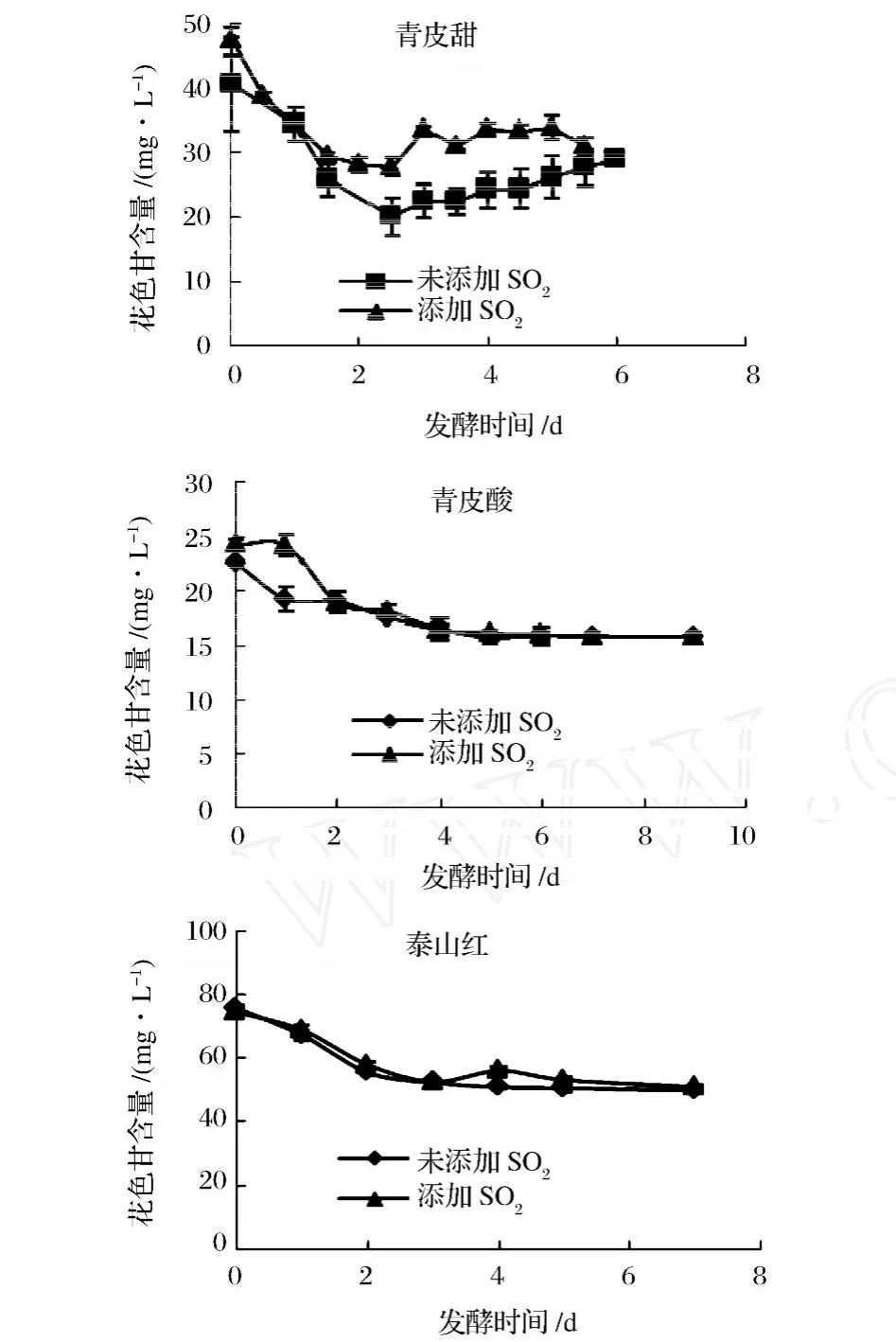
图2 发酵过程中花色苷含量变化
由图3可以看出,发酵结束时青皮酸石榴的色度值分别为 1.328、1.323,高于青皮甜和泰山红,与青皮甜和泰山红间具有显著性差异 (P<0.01),这主要是由于青皮酸石榴滴定酸含量较青皮酸、泰山红高,酸可维持低 pH值,有利于颜色的稳定性。随着 pH值升高,花色苷脱色,最终会变成蓝色。添加 SO2的色度值略低于不添加 SO2的,但两者间无显著性差异(P>0.05)。在发酵过程中,随着发酵时间的延长色度值大体上呈下降趋势。品种不同色度损失的情况也不同,泰山红损失最高。色度损失情况与 pH变化情况有关,在发酵过程中 pH值略有上升,这可能是导致色度损失的主要原因。
2.2.3 发酵过程中色调的变化
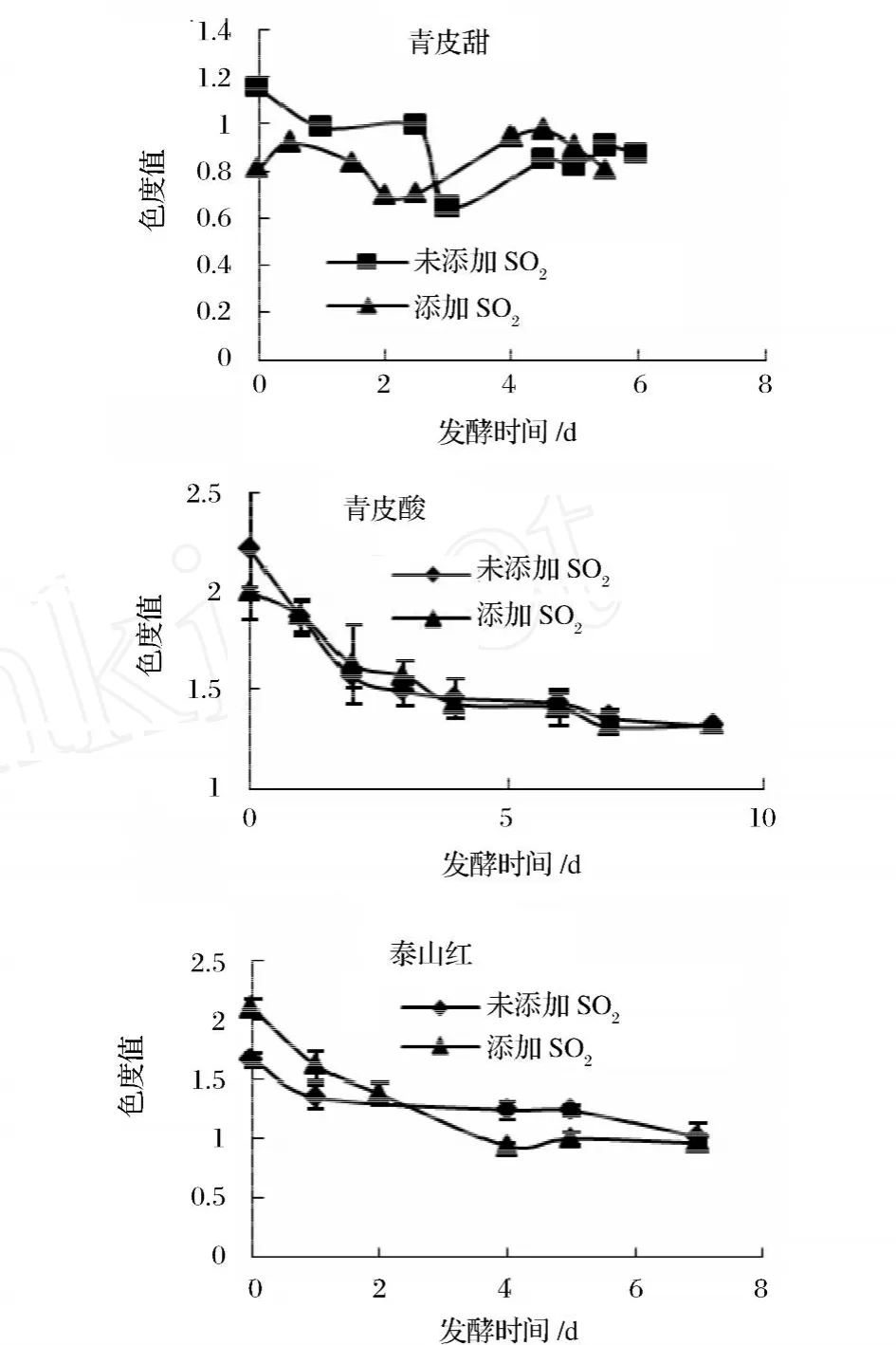
图3 发酵过程中色度变化
由图4可以看出,色调变化与色度变化具有一致性,在发酵过程中色调值减小。发酵结束时,在 3品种中青皮酸与泰山红色调值较高,2品种间具无显著差异(P>0.05),与青皮酸间有显著性差异 (P<0.01)。同一品种间不添加 SO2与添加 SO2色调之间无显著差异 (P>0.05)。色调主要是反映各颜色间的变化、转移情况,发酵过程中色调变小,发酵过程中 pH值的变化会对色调产生影响。随着 pH值的变化,花色苷在水溶液中的存在形式及颜色发生变化,从而使石榴酒在不同波长下的吸光值发生变化,导致色调变化。
2.3 石榴汁、石榴酒色泽比较
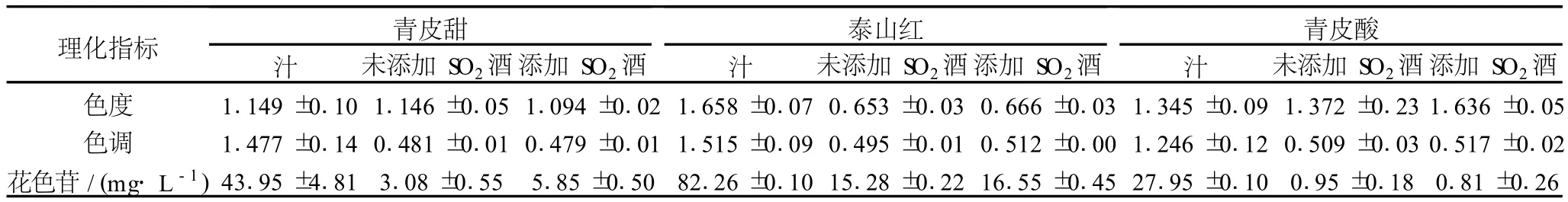
表1 石榴汁、石榴酒色泽比较
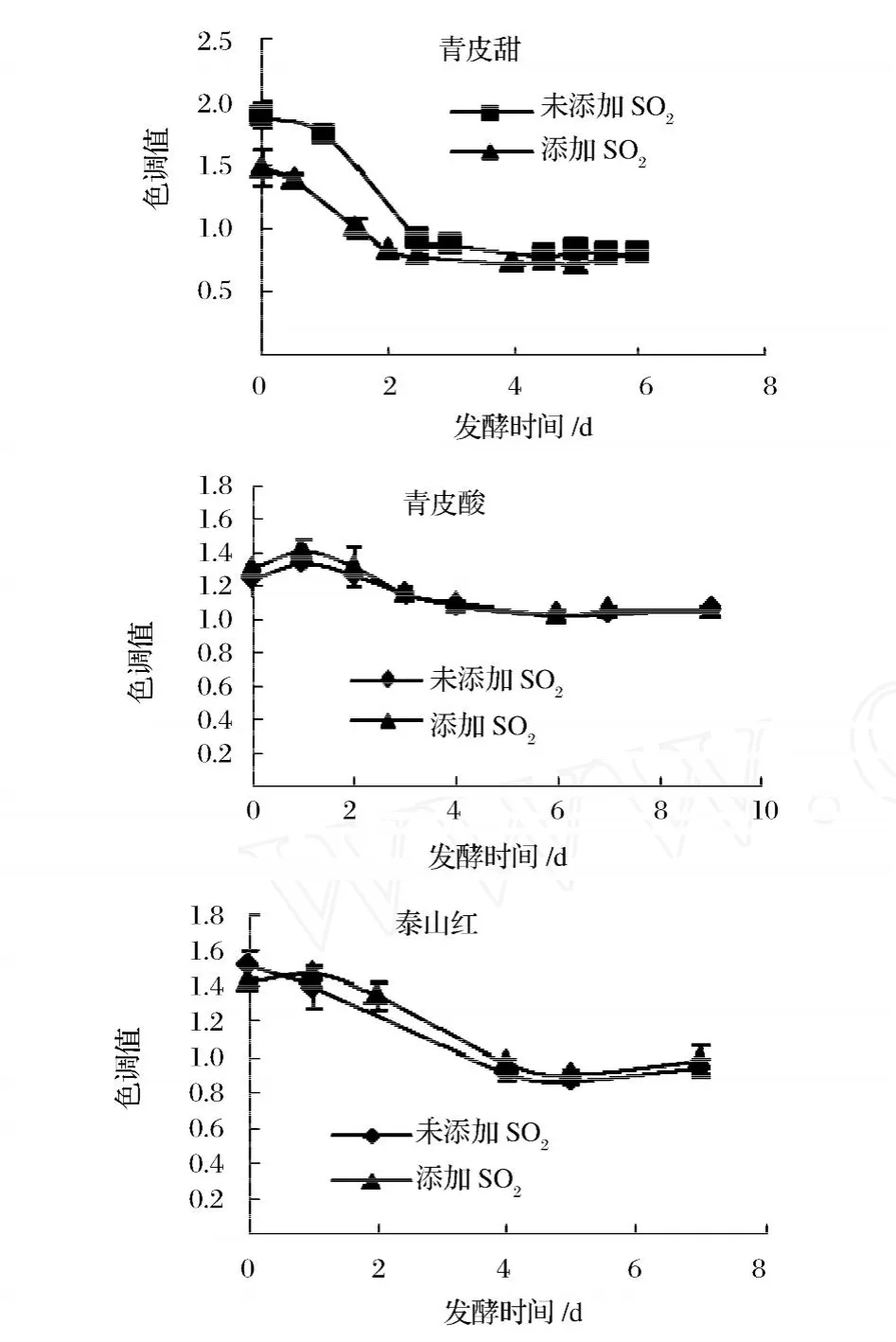
图4 发酵过程中色调变化
表1为石榴原汁与石榴酒色泽比较情况,由表1 可以看出,经过发酵,石榴汁色泽变化较大,色泽明显降低。这可能主要是由于酿造过程中采用浸渍发酵法生产石榴酒,搅拌过程使发酵罐内氧气充足,呈色物质氧化分解所致。将花色苷含量与色度、色调 2指标进行相关性分析,结果显示花色苷与色度之间相关性不显著 (Pearson相关系数为 0.199,P=0.608>0.05),回归方程为y=0.002 9x+1.090 5;与色调之间相关性极显著 (Pearson相关系数为 0.885,P=0.002<0.01),回归方程为y=0.015 3x+0.468 7。由此可知对于石榴汁及石榴酒花色苷与色度无显著相关性,与色调极显著性相关。
3 结论
青皮甜、青皮酸、泰山红 3个品种石榴汁的最大扫描波长分别为 513nm、496 nm、514 nm。经过发酵石榴汁花色苷、色度、色调都有一定程度的下降。泰山红汁花色苷含量最高为 82.26 mg/L,3品种间花色苷含量具有显著性差异 (P<0.01);青皮酸石榴的色度值高于青皮甜和泰山红,有显著性差异 (P<0.01);青皮酸与泰山红色调值较高,2品种间无显著性差异(P>0.05),与青皮甜间具有显著性差异 (P<0.01)。本试验中添加 50 mg/L的 SO2,发酵过程中是否添加 SO2两组的花色苷、色度、色调值无显著性差异(P>0.05)。石榴汁及石榴酒花色苷与色度无显著相关性,与色调极显著相关。
[1] Li X F.Evaluation of antioxidantproperties of pomegranate peel extract in comparison with pomegranate pulp extract[J].Food Chemistry 2006,96:254-260.
[2] Jais wal V,Der Marderosian A,Porter J R.Anthocyanins and polyphenol oxidase from dried arils of pomegranate(Punica granatumL.)[J].Food Chemistry 2010,118:11-16.
[3] 阚建全 .食品化学[M].北京:中国农业大学出版社,2002:294-295.
[4] 朱宝镛 .葡萄酒工业手册 [M].北京:中国轻工业出版社.
[5] GiustiM M,W rolstad R E.Anthocyanins Characterization and measurement with UV-visible spectroscopy in Current Protocols in Food Analytical Chemistry[M].New York:JohnW iley and Sons,Inc,2001:1-13.
[6] Castañeda-Ovando A,Pacheco-Hernández M L,Páez-HernándezM E,et al.Chemical studies of anthocyanins:A review[J].Food Chemistry,2009,113:859-871.
[7] KongJM,ChiaL S,GohN K,et al.Analysis and biological activities of anthocyanins[J].Phytochemistry,2003,64(5):239-240.
[8] Rein M.Copigmentation reactions and color stability of berry anthocyanins[D].Helsinki:University of Helsinki,2005:10-14.
[9] Clifford M N.Anthocyanins-nature occurrence and dietary burden[J].Journal of the Science of Food and Agriculture,2000,80(7):1 063-1 072.
[10] Li Y F,Guo C J,Yang J J,.Evaluation of antioxidant properties of pomegranate peel extract in comparison with pomegranate pulp extract[J].Food Chemistry,2006,96:254-260.

