柱前在线衍生-HPLC内标法快速测定脑蛋白水解物注射液中的氨基酸
冯 辉 董祥君 吴 焱 孙海侠
(1.长春市产品质量监督检验院,长春 130012; 2.山东科兴生物制品有限公司,济南 250200)
脑蛋白水解物注射液(cerebroprotein hydrolysate injection)是以健康猪脑(或牛脑)经酶水解制成的无菌制剂,主要成分是游离氨基酸和小分子多肽[1]。据药理和临床试验表明:脑蛋白水解物注射液能调节和改善神经元的代谢,促进突触的形成,诱导神经元的分化,保护神经细胞免受各种缺血和神经毒素的损害。该制剂临床用于治疗颅脑外伤,脑血管病后遗症伴有记忆力减退及注意力集中障碍等症状[2]。脑蛋白水解物注射液中各种氨基酸含量是评价其质量标准的一项重要指标。目前报道的用HPLC测定脑蛋白水解物注射液中氨基酸含量的方法很多[1-7],这些方法普遍使用外标法定量且分析时间至少需要30 min。虽然外标法是色谱分析常用的定量方法之一,但是当样品的前处理比较复杂,尤其是使用柱前衍生时,由于每个样品衍生效率可能有所不同,往往会造成较大的测定误差。较长的分析时间会造成试剂和时间等的浪费,增加检测成本。
笔者在前人研究的基础上,在样品处理前加入内标,校正物理和化学损失,从而提高了分析的准确性和可靠性。使用反相C18短柱二元高压梯度洗脱分析时间仅需14 min,比传统氨基酸分析方法节省时间1倍以上,大大提高了检测效率。采用OPA和FMOC-Cl联合柱前在线衍生,节省了大量人力和时间,同时又提高了分析结果的重复性。使用DAD和FLD联合检测,既保证一级和二级氨基酸全部测定,又比单独使用紫外检测器的灵敏度提高10倍以上[8]。
1 实验部分
1.1 主要仪器与试剂
高效液相色谱仪:Agilent 1100型,配G1322A真空脱气机、G1312A双元泵、G1329A自动进样器、G1330A自动进样器控温装置、G1316A柱温箱、G1315B二极管阵列检测器、G1321A荧光检测器和A08.03化学工作站,美国Agilent公司;
真空泵:DOA-V130-BN型,美国Waters公司;
台式离心机:EBA21型,德国Hettich公司;
快速混匀器:Inchi HM-10型,日本Jircas公司;
甲醇、乙腈:色谱纯,美国Fisher公司;
三氯乙酸、NaH2PO4·H2O:优级纯,美国Sigma-Aldrich公司;
色氨酸、内标戊氨酸、硼酸缓冲液、OPA和FMOC:色谱纯,美国Agilent公司;
17种氨基酸(丙氨酸、精氨酸、天门冬氨酸、胱氨酸、谷氨酸、组氨酸、甘氨酸、异亮氨酸、亮氨酸、赖氨酸、蛋氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、酪氨酸和缬氨酸)标准混合液及固体粉末标准品:色谱纯,瑞士Fluka公司;
盐酸:优级纯,北京化学试剂厂;
NaOH:分析纯,北京化学试剂厂;
实验用水为双蒸水;
脑蛋白水解物注射液样品:吉林华康药业股份有限公司。
1.2 色谱条件
(1)色谱柱:Zorbax Eclipse AAA C18柱(75 mm×4.6 mm,3.5 μm);流动相A:称取NaH2PO4·H2O5.52 g溶于1 000 mL水中,用10 mol/L NaOH调节至pH 7.8,过0.45 μm膜;流动相B:乙腈-甲醇-水(体积比45∶45∶10);流速:2 mL/min;柱温:40℃;DAD检测波长:紫外波长338 nm(谱带宽10 nm),参考波长390 nm(谱带宽20 nm);FLD检测波长:0.0~8.5 min内,激发波长340 nm,发射波长450 nm,8.5~14.0 min内,激发波长266 nm,发射波长305 nm。
(2)流动相梯度洗脱程序
0.0~1.0 min,B:0%;1.0~9.8 min,B:0%~57%;9.8~10.0 min,B:57%~100%;10.0~12.0 min,B:100%;12.0~12.5 min,B:100%~0%;12.5~14.0 min,B:0%。
(3)自动衍生程序
分别吸取 2.5 μL硼酸缓冲液和 0.5 μL标准溶液或样品测定液,充分混合,静置30 s;洗针;吸取 0.5 μL OPA充分混合;洗针;吸取0.5 μL FMOC充分混合;吸取32 μL水,充分混合;进样量为18 μL。
1.3 试液配制
(1)氨基酸混合标准液的配制:准确称取适量色氨酸和戊氨酸,用0.1 mol/L HCl分别配制成浓度为18 mmol/L和50 mmol/L的储存液,临用时稀释。将浓度为1 mmol/L的17种氨基酸混合标准液稀释至不同浓度,再与适当浓度的色氨酸和戊氨酸溶液按一定比例混合,配制成浓度分别为4.5、45、225、450、900 μmol/L的19种氨基酸(戊氨酸的浓度均为250 μmol/L)系列混合标准溶液。
(2)提取液配制:准确称取适量戊氨酸,用5%的三氯乙酸配制成浓度为2 551.02 μmol/L的溶液,临用时稀释为浓度为255.102 μmol/L的提取液。
1.4 样品处理
准确量取脑蛋白水解物注射液样品20 μL于1.5 mL离心管中,加入提取液充分混合(混合后内标戊氨酸的浓度为250 μmol/L)。室温静置15 min后以14 000 r/min离心15 min,取上清液100 μL于HPLC样品瓶中,按1.2中的自动衍生程序衍生后测定。
2 结果与讨论
2.1 内标物的选择
由于每个脑蛋白水解物注射液样品的前处理尤其是衍生效率往往很难一致,所以造成测定结果的误差较大。如果使用内标法,在样品处理之前将已知浓度的Nova作为内标物加到样品中,使之与其它氨基酸在相同的样品处理和衍生条件下进行测定,便可起到校正物理和化学损失的作用,达到提高测定的准确性和可靠性的目的。
内标法的关键是选择合适的内标物[9]。本研究选用Nova为内标,首先它不存在于天然蛋白质中,即不存在于脑蛋白水解物中,其性质与其它氨基酸十分相近,且能完全溶解于被测样品中;在色谱分离中Nova峰接近其它氨基酸峰,位于各峰之间,且与它们能完全分开。由此可见,Nova是使用内标法测定脑蛋白水解物注射液中氨基酸含量时理想的内标物。
2.2 提取溶剂和提取时间的选择
脑蛋白水解物注射液成分较为复杂,尤其是肽类物质对氨基酸的提取与测定有严重的影响,因此必须在提取游离氨基酸的同时将其除去。本试验选用了甲醇、乙腈、三氯乙酸、高氯酸和磺基水杨酸等不同浓度的溶液作为提取溶剂,结果发现,5%的三氯乙酸提取效果最好,既保证色谱分离过程中无干扰,又可以使所有氨基酸全部溶解;另外,使用5%三氯乙酸为提取液,避免了甲醇、乙腈等试剂的挥发和高氯酸等试剂的强腐蚀性对人体造成的伤害。
使用5%的三氯乙酸为提取溶剂,将脑蛋白水解物注射液分别于室温下提取5、10、15、20、25 min,结果表明,15 min以后游离氨基酸总量不再增加,所以提取的最佳时间为15 min。
2.3 衍生试剂的选择
OPA和FMOC-Cl是氨基酸分析的柱前衍生试剂,两者联合使用有如下优点:(1)OPA和FMOC-Cl与氨基酸衍生反应时间都很短,只需30 s即可完成[10],特别适合在线衍生;(2)衍生时OPA首先与一级氨基酸反应,然后FMOC-Cl 再与未被衍生的二级氨基酸反应,两者起到互补的作用,大大提高了衍生效率;(3)衍生所产生的副产物在氨基酸之后被洗脱出来,不影响分离和定量。
2.4 检测方式的选择
本研究使用DAD和FLD联合检测氨基酸的衍生物。使用FLD检测时干扰少,基线噪音小,检测灵敏度比DAD高出几个数量级[11],但是 Lys的响应值小,用 DAD来补充便可解决这一问题。如果在不具备FLD的情况下,单独使用DAD在8.5 min处进行波长转换(紫外波长262 nm,谱带宽16 nm;参考波长324 nm,谱带宽8 nm)也可以完成一级和二级氨基酸的检测,但是存在受基质干扰大、基线不稳定和检测灵敏度低的缺点。
2.5 色谱图
图1分别为氨基酸标准混合液和脑蛋白水解物注射液样品色谱图,其中a、c为DAD检测信号,b、d为FLD检测信号。
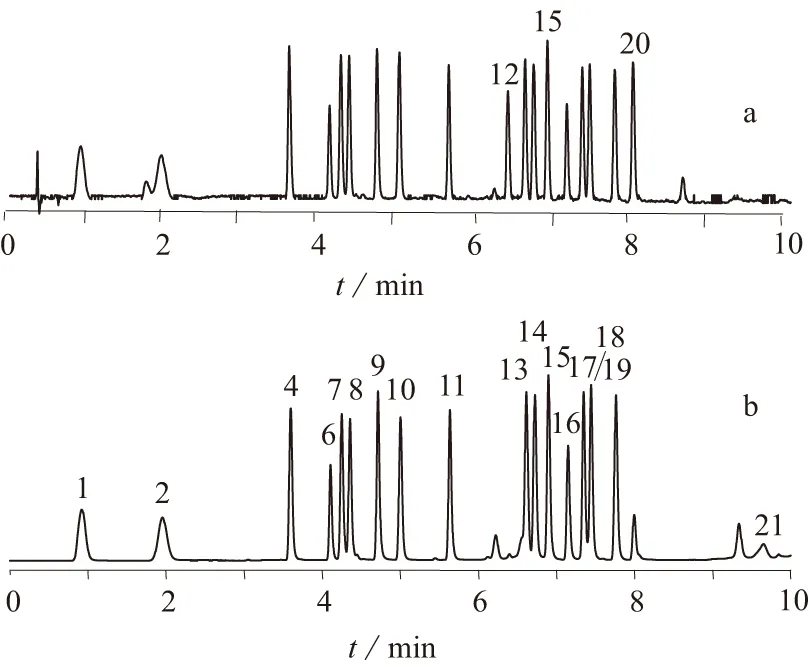

1—天冬氨酸; 2—谷氨酸; 3—天冬酰胺; 4—丝氨酸;5—谷氨酰胺; 6—组氨酸; 7—甘氨酸; 8—苏氨酸; 9—精氨酸; 10—丙氨酸; 11—酪氨酸; 12—胱氨酸; 13—缬氨酸; 14—蛋氨酸; 15—戊氨酸; 16—色氨酸; 17—苯丙氨酸; 18—异亮氨酸; 19—亮氨酸; 20—赖氨酸; 21—脯氨酸图1 氨基酸混合标准液(a、b)和脑蛋白水解物注射液样品(c、d)色谱图
由图1可见,各种氨基酸经衍生后,在1.2的色谱条件下得到了很好地分离,几种比较难分离的氨基酸对甘氨酸/苏氨酸、缬氨酸/甲硫氨酸和苯丙氨酸/异亮氨酸的分离度分别是1.60、1.56和1.33,均超过了准确测量所需最低分离度1.25。完成每个样品分析仅需14 min,较传统的氨基酸分析方法缩短分析时间1倍以上,大大提高了检测效率。图中3号峰和5号峰分别是天冬酰胺和谷氨酰胺,它们是天门冬氨酸和谷氨酸在脑蛋白水解过程中的前体。如果一个样品中不含有这两种氨基酸,则很可能不是脑蛋白的水解物,而是由直接添加人工氨基酸制得。所以样品中是否含有天冬酰胺和谷氨酰胺可作为鉴别脑蛋白水解物注射液真伪的一项标准。
2.6 空白试验
按1.2色谱条件分别测定空白的5%三氯乙酸提取液和带内标的5%三氯乙酸提取液,前者除衍生试剂所产生的色谱峰外未发现干扰峰,后者除内标峰和衍生试剂峰外也未发现干扰峰。
2.7 衍生产物的稳定性
将氨基酸衍生产物分别放置0、6、12、24 h后进行色谱分析,结果发现各衍生产物在放置24 h后,峰面积有轻微的减少,但不十分明显,说明衍生产物在24 h以内稳定。
2.8 线性关系、检出限和定量限
将1.3(1)中所配制的5种浓度的氨基酸混合标准液,按1.2的色谱条件进行测定,以各氨基酸峰面积Y为纵坐标,氨基酸浓度X(μmol/L)为横坐标进行线性回归,各氨基酸浓度在4.5~900 μmol/L范围内具有良好的线性关系,相关系数r在0.998 7~0.999 9之间。以信噪比S/N=3计算检出限(LOD),以信噪比S/N=10计算定量限(LOQ),结果见表1。由于赖氨酸是使用DAD检测,所以LOD和LOQ明显高于用FLD检测的其它氨基酸。

表1 16种氨基酸的线性回归方程、相关系数、检出限和定量限
2.9 回收试验
准确量取已测定出氨基酸含量的脑蛋白水解物注射液样品9份,分成3组,每组3份,每组分别按氨基酸含量80%、100%和120%左右加入氨基酸的固体标准品,测定其回收率和相对标准偏差,结果列于表2。从表2可见,各氨基酸的回收率在95.39%~105.33%范围内,相对标准偏差为2.13%~5.26%(n=3)。说明该方法准确度和精密度高,方法可靠。

表2 16种氨基酸回收率(n=3)
2.10 精密度试验
按1.2色谱条件测定脑蛋白水解物注射液,进行日间和日内精密度试验(n=7),结果见表3。由表3可见,日内相对标准偏差小于5%,日间相对标准偏差小于10%,符合药物分析的要求。

表3 16种氨基酸的日内和日间测定精密度(n=7)
2.11 实际样品测定
分别采用内标法和外标法对3个不同批次的脑蛋白水解物注射液样品(Ⅰ、Ⅱ、Ⅲ)进行氨基酸含量的测定,每个样品测定5次,计算平均值,同时计算标准偏差和相对标准偏差,结果见表4。
从表4可以看出,两种方法测定结果的平均值相差不是很大,但是内标法精密度远优于外标法。由于表中数据为分析5次的统计结果,但是日常分析中一般为2次平行测定,所以相对标准偏差还要大。建议在条件允许的情况下,应尽量使用内标法测定脑蛋白水解物注射液中的氨基酸含量。
3 结语
该法与传统氨基酸测定方法相比,分析时间缩短1倍以上,并提高了检测的灵敏度和准确性,适用于脑蛋白水解物注射液中氨基酸含量的快速测定。

表4 内标法和外标法样品测定结果分析
续表4

氨基酸Ⅰ内标法(X—±SD)/mg·mL-1RSD/%外标法(X—±SD)/mg·mL-1RSD/%Ⅱ内标法(X—±SD)/mg·mL-1RSD/%外标法(X—±SD)/mg·mL-1RSD/%Ⅲ内标法(X—±SD)/mg·mL-1RSD/%外标法(X—±SD)/mg·mL-1RSD/%苏氨酸0.34±0.024.810.31±0.026.450.38±0.024.750.41±0.024.880.39±0.024.130.42±0.025.16精氨酸1.05±0.022.241.14±0.065.140.91±0.033.301.04±0.054.651.03±0.033.110.94±0.044.41丙氨酸2.81±0.062.122.75±0.114.003.26±0.072.143.19±0.144.392.68±0.082.872.74±0.103.87缬氨酸1.77±0.042.231.78±0.063.372.25±0.052.222.20±0.074.181.84±0.052.921.92±0.094.91蛋氨酸0.58±0.023.920.47±0.036.500.44±0.024.550.49±0.035.330.46±0.024.250.42±0.025.35色氨酸0.63±0.034.240.61±0.045.550.46±0.024.340.50±0.035.240.60±0.023.380.63±0.045.49苯丙氨酸1.81±0.062.351.83±0.053.402.23±0.052.342.29±0.093.931.90±0.063.141.85±0.063.23异亮氨酸1.79±0.042.381.82±0.094.952.20±0.041.822.27±0.093.961.93±0.042.051.83±0.073.88亮氨酸5.30±0.111.985.35±0.162.996.89±0.101.506.79±0.192.805.84±0.142.415.78±0.173.06赖氨酸5.23±0.193.715.20±0.193.926.22±0.152.416.31±0.213.505.21±0.194.025.30±0.205.22脯氨酸2.22±0.104.542.41±0.145.752.36±0.114.662.45±0.135.311.67±0.084.981.71±0.105.54
[1] 钟玉旭, 李复兰, 皱立家,等. 动物脑水解物研究概况[J].中国生化药物杂志,1996,17(4):177-179.
[2] 张华,徐德昌,杨鑫,等. 动物脑蛋白水解液中游离氨基酸的测定[J].现代仪器,2006(1):36-38.
[3] 王琌,陈刚,周秀清,等. 猪脑蛋白水解物注射液的多种氨基酸含量分析[J].长春中医学院学报,2002,18(3):48.
[4] 宁宗超,李彬.脑蛋白水解物注射液氨基酸含量及肽图测定[J].黑龙江医药,2002,15(6):430-432.
[5] 高贵,翁樑,韩四平,等. 应用AQC柱前衍生荧光检测脑蛋白水解液中的氨基酸[J].中国生物制品学杂志,2003,16(6):365-367.
[6] 孙中武,李想. 脑蛋白水解物类药物中氨基酸含量的比较分析[J].东北林业大学学报,2005,33(4):45-47,51.
[7] 许峰,赵广荣,张海燕. 脑蛋白水解物注射液中氨基酸的分析方法[J].中国药业2006,15(2):27-28.
[8] 张晓彤,云自厚.液相色谱检测方法 [M].北京: 化学工业出版社,2000:310.
[9] 汪正范.色谱定性与定量[M].北京:化学工业出版社,2000:164.
[10] 宋志峰,王丽,纪锋,等. 氨基酸分析中的柱前衍生技术[J].吉林农业科学,2004,29(6):54-58.
[11] 王立,汪正范, Mou S F.色谱分析样品处理[M]. 北京:化学工业出版社,2000:171.

