连翘酯苷对顺铂耳毒性防护作用的实验研究
黄世勇 陶泽璋 肖伯奎
顺铂具有肾毒性、耳毒性、神经毒性和骨髓抑制等多种毒副作用[1],剂量越大,其引发毒副作用的风险也就越大,使其应用受到一定的限制。临床资料表明,大剂量顺铂可致双耳进行性感音神经性聋,这是影响该药使用乃至停药的一个重要因素[2]。因此,在保留顺铂抗肿瘤作用的同时,如何降低其耳毒性,是临床上一个亟待解决的课题。近年来有关顺铂的自由基致聋机制逐渐引起较多的关注,如何找到高效的抗自由基物质,是当前研究的一个热点。连翘酯苷是从中草药连翘中提取的一种单体物质,为连翘的主要活性成分,具有显著的清除氧自由基、抗氧化功效[3]。本研究在顺铂引发豚鼠内耳损伤模型的基础上,观察连翘酯苷对顺铂耳毒性的防护作用,并初步探讨其作用机制,试图为临床应用提供实验依据。
1 材料与方法
1.1实验药物主要试剂及仪器 顺铂注射剂为齐鲁制药有限公司生产,批号:910022208,10毫克/支;连翘酯苷冻干粉由天津一方科技有限公司提供,含量>98%,为淡黄色粉末状物质,批号100225,保存于4 ℃冰箱中,临用前配制;超氧化物歧化酶活性试剂盒及丙二醛试剂盒购自南京建成生物工程研究所。实验器材:解剖显微镜(OLYMPUS SZS1);MEM-3202型诱发电位仪(日本光电公司生产) ;配备单反数码相机显微摄影装置的OLYMPUS E330研究级显微镜。
1.2实验动物分组及处理 成年健康豚鼠42只,雌雄不限,250~350 g,均经电耳镜检查排除外耳道炎及中耳炎,耳廓反射灵敏。分笼适应性喂养1 周后随机分为3组,空白组(10只):腹腔注射生理盐水8.0 ml·kg-1·d-1,连续8天;顺铂组(16只):将顺铂用生理盐水配制成0.25 mg/ml,然后腹腔注射顺铂2.0 mg·kg-1·d-1,连续8天;拮抗组(16只):前2天腹腔注射连翘酯苷25.0 mg·kg-1·d-1[4],第3天起腹腔注射连翘酯苷后30 min,再腹腔注射顺铂2.0 mg·kg-1·d-1,连续8天。整个过程中避免接触噪声,每天测量体重以调整药量并严密观察豚鼠的毛发及精神状况等变化。每组豚鼠首次用药前及末次用药后第二天行ABR阈值检测,末次检测完毕后,心脏穿刺采血[5]用于血清总超氧化物歧化酶(total superoxide disumutase,T-SOD)活性和丙二醛(malondialdehyde,MDA)含量检测,最后断头处死取耳蜗,行硝酸银染色全耳蜗铺片观察、耳蜗组织切片观察及扫描电镜观察。
顺铂组6只、拮抗组3只动物因内耳损伤、造模不成功以及死亡而未列入统计范围内。28个耳蜗用于硝酸银染色全耳蜗铺片及毛细胞定量观察,其中,空白组8个、顺铂组8个、拮抗组12个;26个耳蜗用于耳蜗切片标本制备,其中,空白组8个、顺铂组8个、拮抗组10个;12个耳蜗用于扫描电镜样品的制备,空白组4个、顺铂组4个、拮抗组4个。
1.3ABR检测 1%戊巴比妥钠(40 mg/kg ) 腹腔注射麻醉,维持动物的自主呼吸,在隔声电屏蔽室内进行。短声刺激,刺激率为20次/秒,扫描时间10 ms,带通滤波100~3 000 Hz ,声输出范围0~100 dB nHL。记录电极置于头项正中,对侧外耳道后壁为参考电极,鼻尖为地极[6]。
1.4全耳蜗铺片及毛细胞定量观察 耳蜗铺片标本制备:动物断头处死后,取出双侧听泡,打开听泡,蜗尖钻孔,开放卵圆窗和圆窗,从蜗尖灌注新鲜配制的0.5%硝酸银溶液2~3次,使液体自前庭阶、鼓阶由卵圆窗、圆窗流出,再用10%福尔马林溶液灌注并将标本置于固定液中,自然光下曝光2~3小时,解剖显微镜下剥离耳蜗蜗壳,取全程基底膜,放置于滴有甘油的载波片中,分回封片。在400倍光镜下,观察基底膜毛细胞形态,从蜗顶向底回逐个视野进行计数外毛细胞。将基底膜的全长转换为百分比长度表示,计录每5%距离中的外毛细胞数量,同时将采集到的数据录入计算机。记录每个耳蜗样品的数据,并将同组中不同样品相应单位百分比长度内的外毛细胞数量与数据库中该种属健康动物相应单位百分比长度内的外毛细胞均数进行比较,并转换成该样本外毛细胞的残存率再组内取均数,从而得出该组动物的耳蜗外毛细胞残存率的曲线图[7~11]。将三组豚鼠耳蜗外毛细胞残存率曲线图进行对比并行定性和定量分析。
1.5耳蜗切片标本制备 取各组动物听泡,暴露耳蜗,蜗尖钻孔,自蜗尖灌注10%福尔马林溶液0.5~1.0 ml,将标本置于同种固定液中4 ℃过夜。10%EDTA脱钙一周。常规石蜡包埋,平行蜗轴方向连续切片,切片厚度约10 μm。行HE染色,封片,400倍光镜下观察Corti 器、血管纹、螺旋神经节形态学情况,摄片[12]。
1.6扫描电镜标本制备 取各组动物听泡,暴露耳蜗,蜗尖钻孔,以2.5%戊二醛灌流,并置于相同固定液中,4 ℃过夜。次日清洗后在解剖显微镜下剥去耳蜗骨壳,并轻柔剥下螺旋韧带,暴露耳蜗基底膜,锇酸处理,PBS清洗3次,梯度酒精脱水,100%醋酸异戊酯替换,CO2临界点干燥,粘台,喷金,2 500倍扫描电镜下观察摄片。
1.7血清T-SOD活性和丙二醛含量的测定 心脏穿刺采血,3 000 r/min离心10 min,取上清液,-20 ℃冰箱保存待测。检测指标包括血清总超氧化物歧化酶(total superoxide disumutase,T-SOD)活性和丙二醛(malondialdhyde,MDA)含量。T-SOD活性采用黄嘌呤氧化酶法,以每毫升反应液中SOD抑制率达到50%时对应的SOD量为一个活性单位(1U),结果以U/ml表示;MDA含量采用硫代巴比妥酸比色法,结果以nmol/ml表示[13]。
1.8统计学方法 所有实验数据均采用SPSS 13.0统计软件处理,ABR反应阈行自身前后对照比较应用配对t检验;组间比较采用单因素χ2分析,多个样本均数的两两比较采用q检验;以P<0.05为差异有统计学意义。
2 结果
2.1各组一般情况比较 空白组给药前后精神状况和日常活动无明显变化;顺铂组给药期间动物活动减少,食欲减退,毛发竖立,疏松脱落,耳廓反射减退,甚至消失;拮抗组给药期间也有轻度的毛发疏松,但活动、食欲、耳廓反射等变化较顺铂组明显轻。
2.2各组ABR阈值比较 三组豚鼠给药前后ABR阈值见表1。给药前,三组豚鼠ABR阈值无明显差异,给药后,顺铂组和拮抗组豚鼠反应阈较用药前提高,顺铂组阈值增高更明显。

表1 各组豚鼠给药前后ABR阈值比较
注:△与同组给药前比较,P<0.05;*与其余两组给药后比较,P<0.05
2.3全耳蜗铺片毛细胞定量观察
2.3.1耳蜗铺片毛细胞形态学观察 各组内毛细胞未见明显损伤,损伤主要为外毛细胞。正常组毛细胞排列规则整齐,无缺失及损伤;拮抗组毛细胞排列规则,外毛细胞有散在缺失,纤毛结构不清晰;顺铂组外毛细胞缺失数目增加,甚至成片缺失,外毛细胞结构紊乱(图1)。
2.3.2外毛细胞计数及残存率 空白组外毛细胞完整未见明显缺失(缺失率约1.0%);顺铂组外毛细胞缺失最多且以底回最重,平均缺失率约53.42%,且外毛细胞缺失率自第一排向第三排逐渐增多,由顶回向底回逐步增加;拮抗组外毛细胞有散在缺失,程度介于空白组和顺铂组之间。各组动物外毛细胞残存率见图2,组间比较存在显著性统计学差异(P<0.05)。各组内毛细胞未见明显缺失或损伤。
2.4耳蜗组织切片观察 空白组未见明显异常;拮抗组除了可见少许外毛细胞变性缺失外,血管纹无明显异常,螺旋神经节细胞轻度退变;而顺铂组除了外毛细胞缺失外,还可见Corti器的结构紊乱、血管纹肿胀,血管扩张,螺旋神经节细胞数目明显减少(图3)。
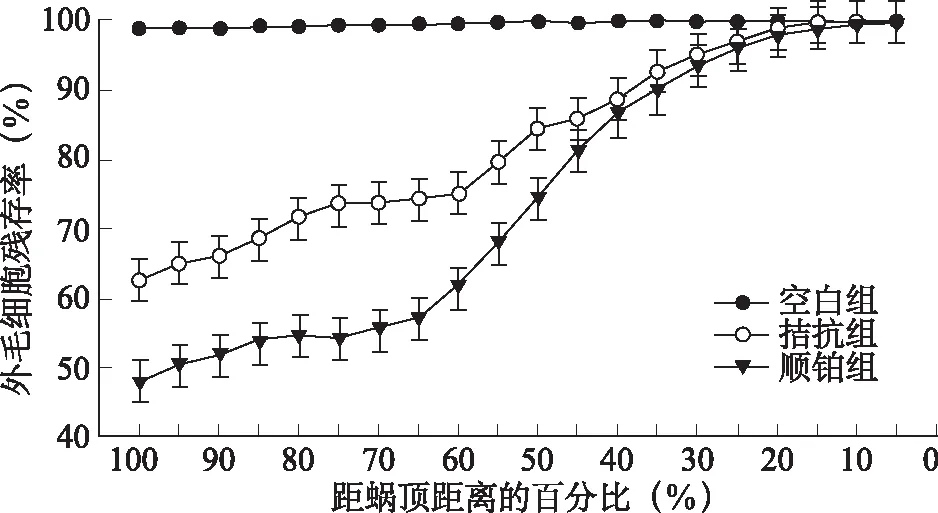
图2 各组耳蜗铺片外毛细胞残存率比较
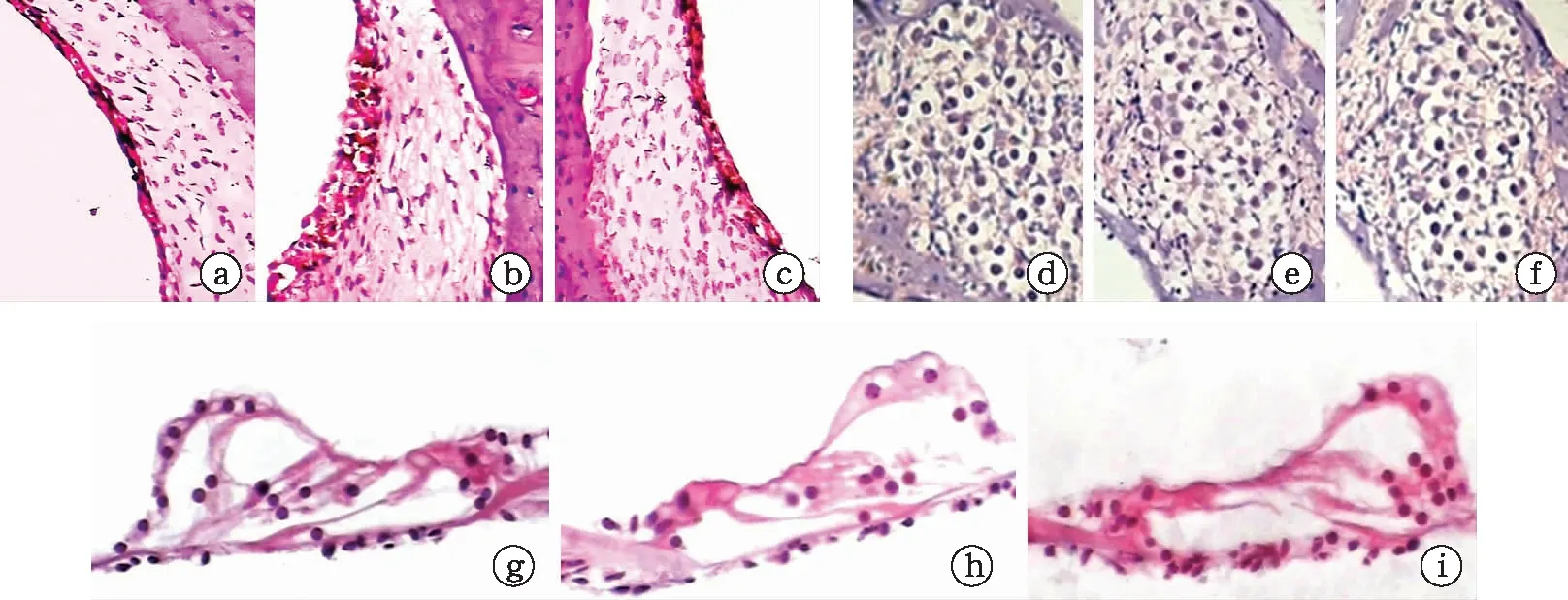
图3 耳蜗组织切片观察(HE染色,×400)(a~c为血管纹,d~f为螺旋神经节,g~i为Corti器。a、d、g为空白组,b、e、h为顺铂组,c、f、i为拮抗组)
2.5扫描电镜观察结果 空白组耳蜗Corti器中,三排外毛细胞纤毛排列整齐,未见明显缺失及损伤,顺铂组Corti器中,内毛细胞纤毛肿胀,外毛细胞倒伏,散乱,甚至呈片状缺失;拮抗组Corti器中,内毛细胞纤毛肿胀呈簇,大部分外毛细胞排列稍有散乱,但未见明显缺失;拮抗组毛细胞损伤程度介于空白组和顺铂组之间(图4)。
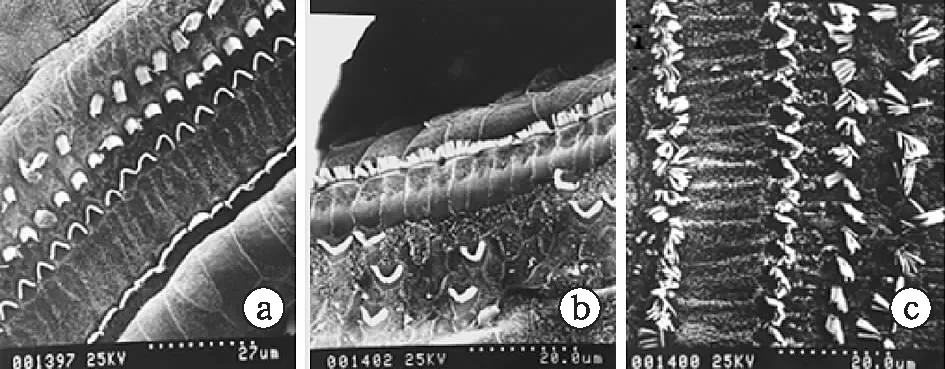
图4 各组耳蜗毛细胞扫描电镜观察
2.6血清T-SOD活性和MDA含量比较 拮抗组T-SOD活性较空白组显著下降,MDA含量较空白组显著升高(P<0.05);顺铂组T-SOD活性低于拮抗组,而MDA含量高于拮抗组,差异有统计学意义(P<0.05)。
表3 各组豚鼠血清T-SOD活性和MDA含量比较
注:*与其余两组比较,P<0.05
3 讨论
豚鼠顺铂耳毒性造模过程中,顺铂剂量不宜过大或过小,否则很容易导致豚鼠在出现耳毒性损害之前便因肾毒性而死亡。本研究预实验发现2 mg·kg-1·d-1是合适的剂量,一般用药后4天左右蜗底即出现毛细胞损伤,到第5至6天,毛细胞缺失与正常未处理组比较,具有统计学差异。本实验观察到动物连续腹腔注射顺铂8天,基底膜底回外毛细胞损伤明显,达50%以上,而此时豚鼠死亡率相对较低,仅30%左右,故认为2 mg·kg-1·d-1腹腔注射8天是合适的,既造成了基底膜较大范围的损伤,使豚鼠ABR反应阈明显增高,又不至于使豚鼠的死亡率过高。
顺铂耳毒性的作用机制目前尚未完全阐明,一般认为机制主要有以下几种:内耳蓄积的直接损伤、对内耳代谢的影响、血清电解质平衡改变、氧化应激损伤[14]。其中,氧化应激损伤尤为重要。现已发现的诸多防护剂均与拮抗氧化应激损伤有关。如硫代硫酸钠、蛋氨酸、谷胱苷肽等,其机制主要为清除耳蜗组织氧自由基,减轻因氧化应激反应造成的耳蜗组织细胞损伤[15]。
连翘酯苷为从连翘中提取的一种单体物质,为连翘的主要活性成分,具有显著的清除组织的氧自由基、抗氧化功效[3]。然而,连翘酯苷能否通过清除耳蜗氧自由基,抑制脂质过氧化反应,从而对顺铂的耳毒性起防护作用,尚未见报道。故本实验在建立顺铂导致豚鼠内耳损伤模型的基础上,观察连翘酯苷对顺铂耳毒性的防护作用。
本实验发现,顺铂耳毒性主要累及外毛细胞,其损害首先从耳蜗底回开始并逐渐向蜗顶发展,基底膜底回外毛细胞破坏严重,可达50%以上,越靠近蜗顶损伤越轻;血管纹和螺旋神经节也多有累及,主要表现为血管纹肿胀和血管扩张,螺旋神经节细胞数目明显减少。而连翘酯苷可部分拮抗顺铂对内耳组织的损伤,这在拮抗组和顺铂组两组间外毛细胞损伤的比较上较为明显,在底回基底膜,顺铂组外毛细胞缺损率高达50%以上,而拮抗组外毛细胞缺损率仅在40%以下;另外,连翘酯苷还可明显减轻由顺铂导致的外毛细胞肿胀,同时拮抗组血管纹和螺旋神经节所受的损伤也相对较小。
自由基包括氧自由基和氮自由基,正常状态下,耳蜗内产生的氧自由基与耳蜗内的抗氧化防御系统保持动态平衡[16]。生理状态下各种自由基具有很高的生物活性,可产生许多生理功能,但当自由基生成过多或其清除系统功能下降时将蓄积过多的自由基,从而对机体产生损伤[17]。SOD是抗过氧化的重要酶,对机体的氧化与抗氧化平衡起着关键作用,它可以清除超氧化物阴离子,保护毛细胞免受损伤,还可以使脂质过氧化物还原为相应的醇,减少自由基的生成,它的含量可以反映顺铂耳中毒时脂质过氧化的作用的强弱;氧自由基可引发脂质过氧化反应并因此生成过多的脂质过氧化物,导致其代谢终产物MDA含量显著增多。因此,T-SOD活性和MDA含量的测定可间接反映耳蜗组织在顺铂耳毒性时清除氧自由基的能力。本实验结果显示,顺铂组动物耳蜗组织中T-SOD活力明显低于正常对照组(P<0.05),表明机体清除自由基的能力显著下降,提示超氧阴离子自由基含量明显增多。拮抗组豚鼠ABR阈值较顺铂组明显降低,T-SOD含量较顺铂组明显升高,MDA含量明显降低,提示连翘酯苷可能通过增强体内清除氧自由基的能力,降低耳蜗内的氧化应激反应,减轻因氧化应激反应造成的耳蜗组织细胞损伤,从而说明连翘酯苷可拮抗顺铂耳毒性,对听力有一定的保护作用。本研究结果增进了对连翘酯苷药理作用的认识,为其临床应用提供了新的思路。
4 参考文献
1 McAlpine D, Johnstone BM. The ototoxic mechanisms of cisplatin[J]. Hear Res, 1990,47:191.
2 Schaefer SD, Post JD, Close LG, et al.Ototoxidty of low-and moderate-dose cisplatin[J].Cancer, 1985, 56:1 934.
3 Qu HH, Zhang YM, Wang Y,et al. Antioxidant and antibacterial activity of two compounds (forsythiaside and forsythin) isolated from Forsythia suspense[J]. The Journal of Pharmacy and Pharmacology,2008, 60:261.
4 黄继汉, 黄晓晖, 陈志扬,等.药理试验中动物间和动物与人体间的等效剂量换算[J].中国临床药理学与治疗学杂志, 2004 , 9:1 069.
5 栗铭谏, 李洪政, 樊利峰.一次性采制多量豚鼠血清方法的改进[J].陕西医学检验, 2001,16:21.
6 陶泽璋,肖伯奎,刘剑锋,等.卡那霉素耳中毒后豚鼠耳蜗热休克蛋白的表达[J]. 听力学及言语疾病杂志,2000,8:74.
7 亓卫东, 丁大连, 蒋海燕,等.全耳蜗毛细胞定量分析系统[J].听力学及言语疾病杂志,2007,15:158.
8 Viberg A, Canlon B.The guide to plotting a cochleogram[J].Hearing Res, 2004, 197:1.
9 Sjaak FLK, Stephen JO, Wijbenga J, et al. Partial recovery of cisplatin-induced hearing loss in the albino guinea pig in relation to cisplatin dose[J].Hearing Res,2002,164:138.
10 Greenwood DD.Comparing octaves, frequency ranges, and cochlear-map curvature across species[J].Hearing Res, 1996, 94:157.
11 Marjolein WM, John CMJ, Guido F.Time sequence of degeneration pattern in the guinea pig cochlea during cisplatin administration.A quantitative histological study[J].Hearing Res,2004,197:44.
12 费文彬, 丁海峰, 刘维荣,等.DPOAE监测一次性大剂量顺铂致豚鼠耳毒性的实验研究[J]. 听力学及言语疾病杂志,2006,14:357.
13 Watanabe KI, Hess A, Bloch W, et al. Nitric oxide synthase inhibitor suppresses the ototoxic side effect of cisplatin in guinea pigs[J].Anticancer Drugs, 2000,11:401.
14 Leonard PR,Craig AW.Ototoxicity: Therapeutic opportunities [J]. DDT,2005, 10:1 313.
15 Van den Berg JH, Beijnen JH, Balm AJM, et al. Future opportunities in preventing cisplatin induced ototoxicity [J]. Cancer Treatment Reviews,2006,32:390.
16 Leonard PR,Craig AW, Debashree M, et al. Mechanisms of cisplatin-induced ototoxicity and prevention[J]. Hearing Res,2007,,226:157.
17 Watanabe K, Tomiyama S, Jinnouchi K, et al. Expression of inducible nitric oxide synthase in the cochlea following immune response in the endolymphatic sac of guinea pigs[J]. ORL J Otorhinolaryngol Relat Spec, 2001,63:155.

