纳米金修饰的免疫传感器直接测定2,4-D的研究
钟菲菲,章建辉,李 乐,赖灯妮,彭新凯,胡朝晖
(长沙市食品质量安全监督检测中心,湖南 长沙 410018)
2,4-二氯苯氧乙酸(2,4-D)是一种较使用广泛的化学药品[1]。高浓度2,4-D可以用作除草剂;低浓度2,4-D可作植物生长调节剂,因此被广泛的应用于农业生产中。2,4-D作为植物生长调节剂能提高坐果率、增大果实[2];还有果实保鲜作用[3];并能促进植物生根、调节细胞生长[4],诱导根瘤的形成[5]。2,4-D的水溶性较高,挥发性较低,在自然界中难以生物降解或直接光解,导致2,4-D易于淋溶迁移进入水体[6]和土壤,进而在生物体内积累,对生物具有较高的急性毒性,在较高剂量时具有致畸性和潜在的基因毒性,对人类健康和自然生态环境都有较大危害[7]。2,4-D在植物体中的含量低及本身的特殊化学性质使得2,4-D的检测要求高,而目前的检测方法存在操作复杂、灵敏度不高、干扰大或对样品前处理要求高、样品需求量大等问题,因此迫切需要寻找检测2,4-D的新途径。
笔者利用自组装技术和静电吸附作用,将2,4-二氯苯氧乙酸抗体(anti-2,4-D)固定在由自组装L-半胱氨酸和静电吸附纳米金修饰的金电极表面,制备出无试剂型的免疫传感器,用于2,4-D的检测分析。
1 材料与方法
1.1 仪器与试剂
CHI660C电化学工作站,金电极,Ag/AgCl饱和电极和铂丝电极均由上海辰华仪器公司提供;2,4-二氯苯氧乙酸抗体(anti-2,4-D)由北京博奥森生物公司提供;电子天平,超声清洗仪和离心机由上海生化工程试剂公司提供;2,4-二氯苯氧乙酸(2,4-D),BSA,氯金酸和L-半胱氨酸由Sigma公司提供;H2O2(30%,水溶液)和其他试剂均为分析纯试剂;试验用水为二次蒸馏水。
1.2 免疫传感器的制备
参照文献[8]制备免疫传感器。金电极(∮=2 mm)分别用 1.0、0.3、0.05 μm 的 Al2O3粉抛光,然后分别用乙醇、水超声波清洗5 min,吹干后待用。将洗净过的金电极放入0.02 mol/L的L-半胱氨酸溶液中,开路自组装2 h,取出洗净后,将金电极浸入纳米金溶液中4℃过夜,取出后洗净晾干,即在电极的表面形成自组装纳米金修饰膜,将修饰好的电极置于anti-2,4-D溶液中37℃保持3 h,再用1%BSA封闭电极表面非特异性结合位点,用水洗涤,晾干,即得无试剂免疫传感器。
1.3 免疫检测与分析方法
将2,4-D溶液滴加在免疫电极表面,于37℃条件下孵育30 min,然后用水仔细清洗后待测。试验采用三电极系统:免疫电极为工作电极,铂丝电极为对电极,Ag/AgCl饱和电极为参比电极,以交流阻抗法作为免疫传感器表征和定性定量的判定方法。在 5 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6]+0.1 mol/L KCl+0.1 mol/L PBS(pH 7.0)溶液中,电位为 0.231 V,频率范围为0.05~106 Hz,交流电位为5 mV,25℃条件下进行交流阻抗表征。
1.4 阻抗分析原理
组装好的阻抗免疫电极与Ag/AgCl电极和铂丝电极构建的三电极系统浸入5 mL的含K3[Fe(CN)6]/K4[Fe(CN)6]的阻抗检测液中。在阻抗图谱测试参数下进行,一次测定中进行两次阻抗检测:2,4-D抗体吸附到电极表面后用BSA封闭多余蛋白吸附位点,此时检测阻抗,记为Z0;加入待测2,4-D后,在电极表面形成2,4-D—2,4-D抗体复合物后检测阻抗,记为Z1。则添加抗原后传感器阻抗的增长率为:
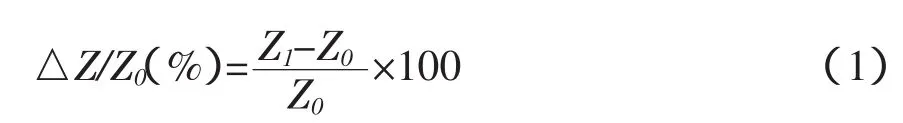
不同浓度的2,4-D对应不同的△Z/Z0,通过已知浓度的2,4-D和对应的△Z/Z0作出标准曲线可以对未知样品进行测定。为获得阻抗免疫传感器稳态下的阻抗值,同一状态下的电极被反复测定3次。
2 结果与讨论
2.1 传感器在制备过程中的交流阻抗表征
采用交流阻抗(EIS)表征电极修饰过程,将电极在修饰过程中于5 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6]+0.1 mol/L KCl+0.1 mol/L PBS(pH 值7.0)溶液中的交流阻抗表征如图1。裸电极时电子传递到电极表面只受到扩散控制,裸电极的EIS近似一条直线如图1-a。当电极修饰了L-半胱氨酸和纳米金后,交流阻抗的膜本体阻抗依次增大,如图1-b、c,说明电极表面已通过静电吸附成功地被修饰。纳米金修饰的金电极表面扫描电镜图见图2。当修饰的电极固定anti-2,4-D,并用BSA封闭非特异性结合位点后,电极的界面阻力再度增加,电极修饰过程交流阻抗的变化是抗体已经被组装到电极表面的有力证据,如图1-d。当电极进一步结合不同浓度的2,4-D后,其阻抗呈增大趋势(图1-e),这是因为抗原—抗体复合膜的形成,一方面增大了Fe(CN)63-/4-在通过膜时的阻力,另一方面,也使Fe(CN)63-/4-向电极表面扩散的有效截面积进一步变小,从而导致膜本身阻抗的增大。
2.2 anti-2,4-D吸附时间的优化
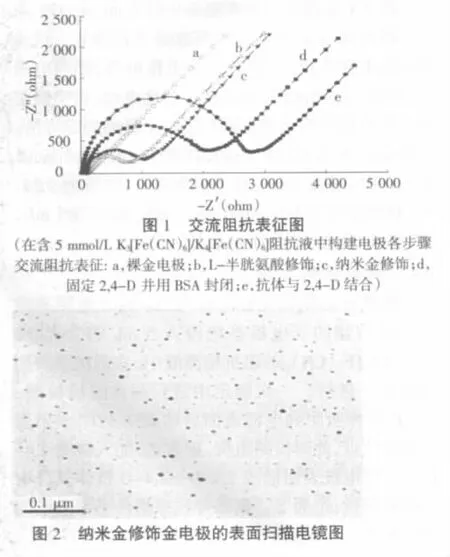
为得出最佳状态的工作传感技术,获得准确的检测结果,需要使电极在较短的时间里吸附到最好的具有生物活性且固定量大的2,4-D抗体,对anti-2,4-D 的吸附时间进行了优化,共设置 1、2、3、4、5、6 h共6个处理。如图3所示,在作用1、2 h后,所测得的阻抗变化值不大,说明anti-2,4-D吸附到电极表面上的量不大,还不能满足试验要求;当作用 3、4、5、6 h后,阻抗变化值逐渐加大;说明吸附在电极表面上anti-2,4-D的量也是越来越多。在本试验中,电极表面上anti-2,4-D的吸附量并不是越多越好,而是要确定一个量,而这个量,既能有较大量的生物活性的识别物质又能便于结果的分析,通过试验可看出,在吸附3 h后,anti-2,4-D的量即可满足试验的要求。因此,本试验选取了3 h为最佳anti-2,4-D吸附时间。
图3 anti-2,4-D吸附时间的影响
2.3 2,4-D与anti-2,4-D作用时间的优化
试验通过对2,4-D与anti-2,4-D的作用时间的优化,来确定抗原与抗体免疫反应的最佳程度。设置 5、15、30、45、60和 80 min共 6个时间。将 16 μL的2,4-D溶液滴加在固定了anti-2,4-D的电极表面上,在37℃下作用于设置的时间后,双蒸水清洗,室温下吹干,测阻抗值。如图4所示,作用30 min前,阻抗值随反应时间的增加而增加;当作用时间为30 min时,结合反应达到基本饱和程度,而后,随作用时间的延长,反应基本没有很大的变化,阻抗响应变化非常小。因此,选取了30 min作为2,4-D与anti-2,4-D的最佳作用时间。

图4 2,4-D与抗体作用时间对阻抗变化的影响
2.4 检测工作液pH值的影响
检测工作液 pH 值分别为 5.8、6.2、6.6、7.0、7.4、7.8和8.2时阻抗值的变化如图5所示。在pH值5.8到8.2这个区间内,阻抗值先升高后降低,在pH值7.0的时候阻抗值达到最高。这说明在此区间内,免疫电极在pH值7.0的时候时工作环境达到最理想。这与2,4-D—anti-2,4-D结合物置于pH值7.0的环境中能更稳定地保持在修饰电极上有关。在中性环境下蛋白质分子的表面张力最大,处于一种微弱的水化状态,较易吸附于金颗粒的表面,处于稳定状态,与普通蛋白质一样。2,4-D—anti-2,4-D结合物在酸性条件下可能会发生变性,从而影响正常的抗原—抗体免疫结合物的稳定性。因此免疫传感电极最理想的pH值为7.0。
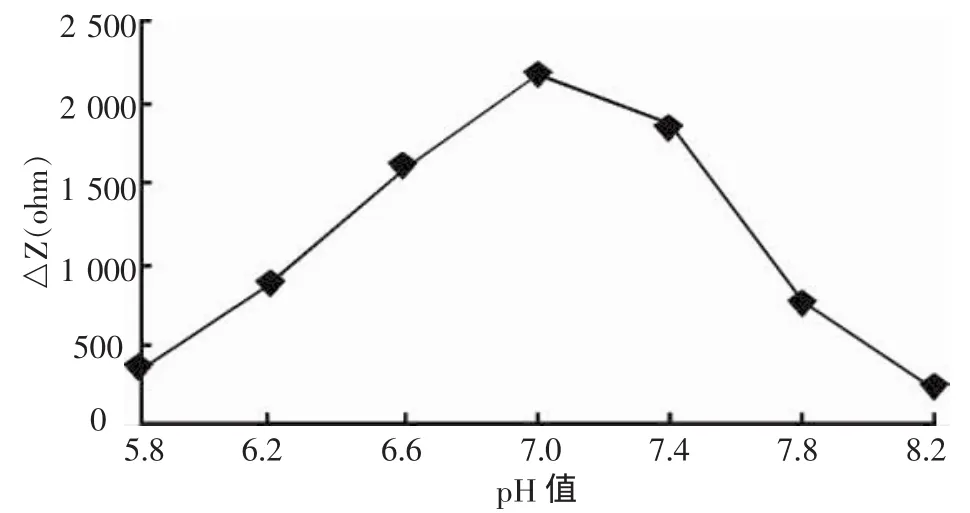
图5 不同pH值对2,4-D与抗体反应的影响
综合条件优化试验得出,检测2,4-D的无试剂型免疫传感器的最佳工作条件为:anti-2,4-D吸附时间为3 h;2,4-D与anti-2,4-D最佳作用时间为30 min;检测工作液最佳pH值为7.0。后续试验都在这个条件下进行。
2.5 标准曲线的制备
在确定免疫传感器最优参数后,对浓度为1~5 000 ng/mL的2,4-D进行测试,并绘制标准曲线。测试结果如图6所示,从图中可看出:当修饰的电极结合不同浓度的2,4-D,电极的界面阻力不同程度的增加,2,4-D的浓度越大,电极的界面阻力的增加程度越大,免疫传感器的响应信号——交流阻抗越大,从而得到一系列的阻抗曲线。
图7 在含 5 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6]的阻抗液中2,4-D浓度范围在1~5000 ng/mL绘制的Nyquist图(Zim vs.Zre),试验均在最优化条件下进行。

由图7可知,免疫传感器阻抗值的变化与溶液中2,4-D浓度成正比,阻抗变化率(y)与2,4-D浓度(x)在2,4-D浓度为1~5 000 ng/mL范围内成线性关系,回归方程是y=0.024 6 x+55.092,相关系数R2为0.998 6。根据3倍空白标准偏差的方法,该免疫阻抗免疫传感器的的检测下限为0.5 ng/mL。
2.6 样品的测定
2.6.1 方法回收率的测定 以0.1 mol/L PBS(pH值7.0)为稀释液,把标准2,4-D抗原配制成不同浓度的待测品,将该免疫电极置于样品溶液中培育30 min后,优化条件下测定阻抗值,求得待测品中2,4-D的浓度,并得到此方法的回收率在92.0%~102.7%之间。
2.6.2 实际样品的应用 利用该免疫传感器对芒果、豆芽、草莓、香橙等5个样品中2,4-D含量进行测量,并与应用普遍的国家标准方法——液相色谱(HPLC)的结果进行比较,结果中两方法的误差率均在实验规范要求之内(≤10%),具体结果见表1。
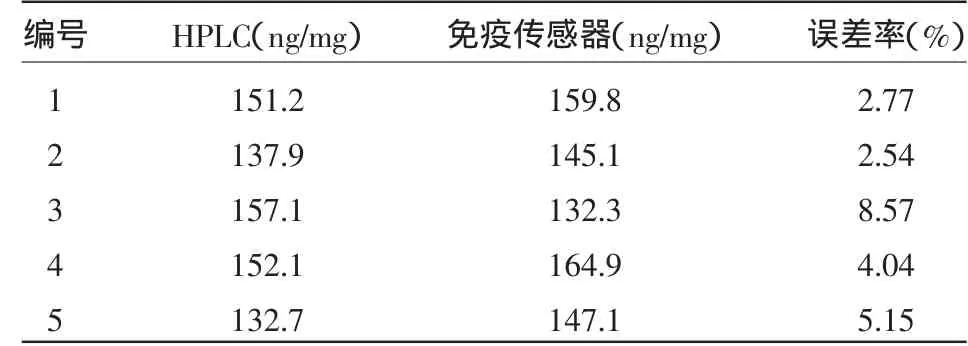
表1 样品测试结果
3 结论
利用纳米金固定2,4-二氯苯氧乙酸抗体(anti-2,4-D)的免疫传感器直接测定2,4-D。试验结果表明:在2,4-D浓度为1~5 000 ng/mL范围内响应值与浓度成线性关系,线性方程是y=0.024 6 x+55.092,相关系数R2达0.998 6,检测下限为0.5 ng/mL。经初步应用,证实此方法能较好的满足测定2,4-D的需要,是一种快速检测2,4-D的新途径。
[1]Robles-González I,Ríos-Leal E,Ferrera-Cerrato R,et al.Bioremediation of a mineral soil with high contents of clay and organic matter contaminated with herbicide 2,4-dichlorophenoxyacetic acid using slurry bioreactors:effect of electron acceptor and supplementation with an organic carbon source process[J].Biochemistry,2006,41:1951-1960.
[2]Michael F Anthony,Charles W Coggins Jr.The efficacy of five forms of 2,4-D in controlling preharvest fruit drop in citrus[J].Scientia Horticulturae,1999,81(3):267-277.
[3]庄荣玉.菌毒清与2,4-D混用对温州蜜柑保鲜贮藏的研究[J].食品与发酵工业,2001,27(12):31-34.
[4]韩玉波,张飞雄.2,4-D对小麦种子萌发和根尖细胞分裂的影响[J].首都师范大学学报(自然科学版),2003,24(1):64-66.
[5]曹有龙,高晓原,罗青,等.人工诱导根瘤菌/(ORS-571)与高粱结瘤共生固氮研究[J].宁夏农学院学报,1997,18(1):29-35.
[6]Rabia Sarikaya,Mehmet Yilmaz.Investigation of acutetoxicity and the effect of 2,4-D(2,4-dichlorophenoxyacetic acid)herbicide on the behavior of the common carp[J].Chemosphere,2003,52:195-201.
[7]Maleki N,Safavi A,Shahbaazi H R.Elect rochemical determination of 2,4-D at a mercury electrode[J].Analytica Chimica Acta,2005,530:69-74.
[8]黎雪莲,袁 若,柴雅琴,等.基于多层酶/纳米金固定甲胎蛋白免疫传感器的研究[J].化学学报,2006,64(4):325-330.

