主动脉壁内血肿的CT诊断价值
彭剑峰,黄红梅,夏学文,徐婉君
(广州市花都区人民医院,广东 广州 510800)
主动脉壁内血肿(AIH)被广泛认为是主动脉夹层(AD)的早期状态或先兆[1-2]。AIH的诊断主要依赖CT、MRI及TTE,因为它们具有很高的敏感性和特异性[3],但AIH发病急,而MRI检查时间长;TTE图像受患者肥胖、慢支炎肺气肿等因素影响较大,尤其对发生在降主动脉的AIH假阴性率更高,因此MRI及TTE通常不作为AIH的首选检查。螺旋CT具有良好的时间及空间分辨率、检查速度快,能清晰显示AIH的部位、范围等情况,临床诊断AIH常首选CT检查。
1 资料与方法
1.1 一般资料
回顾性分析我院2004年5月~2010年2月行螺旋CT扫描并诊断为AIH的患者共13例。男9例,女4例,年龄40~81岁,平均67.6岁。其中11例有长期高血压病史(5~32年),9例CT显示有主动脉粥样硬化表现。
1.2 临床症状
主要临床表现为:①撕裂样或刀割样胸骨后锐痛,可放射至前胸、后背及上腹。②血压波动大:最初血压可下降甚至休克,疼痛缓解后血压回升至正常偏高水平。
1.3 检查方法
13例均行螺旋CT平扫加增强扫描,使用西门子Somatom Plus 4螺旋CT扫描仪,扫描参数 120kV,220mAs,常规层厚、层距10mm扫描,病变部位薄层(层厚、层距3mm)扫描,矩阵512×512。增强对比剂采用碘海醇,剂量100ml,使用高压注射器肘静脉推注,速率为2.5~3.0ml/s,延迟60~90s行主动脉增强扫描。由两名有心血管经验的副主任医师共同做出诊断。
2 结果
2.1 AIH的分型、发生部位
AIH分型沿用主动脉夹层动脉瘤的Stanford分型方法,分A型(病变累及升主动脉)和B型(病变局限于降主动脉及其分支)。
本组13例AIH中,1例为A型,局限于升主动脉根部;12例为B型。B型AIH中,局限性3例,其中1例位于胸主动脉,2例位于肾动脉以下腹主动脉;广泛性9例,均累及胸腹主动脉,止于腹腔干上方3例,髂血管分叉上方5例,其中1例累及腹腔干,髂血管分叉以下1例并累及左侧髂总动脉。
2.2 AIH的CT表现
①主动脉壁呈新月形增厚11例,不均匀环形增厚2例,最大厚度为 5~19mm,平均 12.4mm(图 1,2),内壁光滑。 ②血肿密度不均,低密度2例,CT值约7~24HU,平扫时内膜呈相对弧形稍高密度;等密度4例,高密度7例,CT值约42~96HU(图2a,2b),增强后均未见强化。③主动脉粥样硬化9例,其中5例见内膜钙化斑内移,1例见主动脉壁穿透性小溃疡:平扫未见显示,增强时呈局限于壁内血肿的小龛影。④受累主动脉最大直径:升主动脉1例,约42mm;降主动脉12例,约 28~47mm。
2.3 AIH的伴发病变
心包积液1例,胸腔积液3例,DeBakeyⅢ型AD 1例,腹主动脉瘤1例,肺部炎症表现4例。
3 讨论
3.1 AIH的病因及发病机制
AIH发病率约占AD总数的10%~12.8%[4]。Murray等学者认为,AIH是AD的一种早期状态或先兆,可进展为典型AD,与典型AD不同的是AIH内膜片没有撕裂,血肿与动脉腔之间没有直接的血流交通。文献报道,AIH发病机制尚不明确,但与长期高血压状态及动脉粥样硬化密切相关[5-6]。AIH患者80%以上合并高血压病史[7],本组13例AIH患者11例有长期高血压病史,占总病例的84.6%,与文献相符合。高血压使主动脉壁长期处于应激状态,弹力纤维粘液变性,中层滋养动脉破裂,形成血肿[8]。动脉粥样硬化一方面增加了中层滋养动脉的脆性,更易引起滋养动脉破裂出血;另一方面,主动脉粥样斑块破溃脱落形成动脉粥样硬化斑块穿通溃疡(PAU),累及主动脉壁的内弹力层,并在主动脉壁中膜层内形成壁内血肿[9-10]。壁内血肿顺行或逆行蔓延,可累及主动脉分支血管,血肿引起压力增高及PAU进一步发展常最终导致内膜撕裂,形成典型AD;病变向外扩张时,可形成动脉瘤,其预后不良。若血肿逐渐吸收,假腔逐渐缩小甚至消失,则预后良好。此外,主动脉外伤、炎症等亦是导致AIH的原因之一。

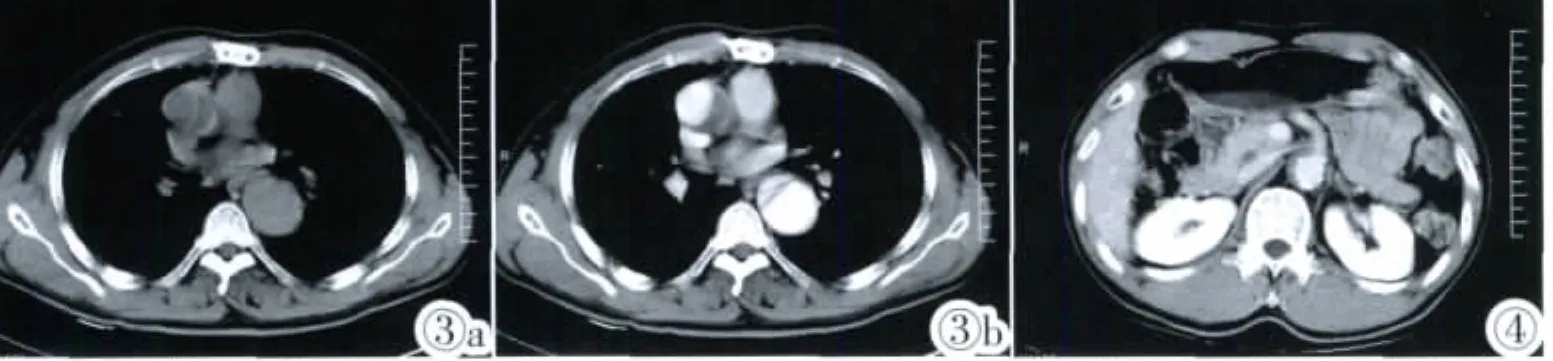
图 1a,1b Stanford B 型AIH,主动脉壁不均匀环形增厚,增强未见强化,内膜钙化斑内 移 约 7mm。图 2a,2b Stanford B型AIH,平扫血肿呈新月形高密度,最大厚度约14mm,其内壁光滑,未见内膜撕裂征象。伴发双侧胸腔积液。图3a,3b Stanford A型AIH,为慢性期血肿,平扫可见弧形线样稍高密度内膜,最大厚度约13mm,伴发DeBakeyⅢ型AD。图4 Stanford B型AIH,累及腹腔干,并见内膜钙化斑内移。Figure 1a,1b.Stanford type B AIH,the aortic wall was uneven annular thickening,without enhancement,calcified plaque shifts inward about 7mm.Figure 2a,2b.Standford type B AIH,plain scan showed crescent high-density hematoma,maximum thickness was about 14mm,inner wall smooth,no signs of intimal tear,accompanied with bilateral pleural effusion.Figure 3a,3b.Stanford type A AIH,a chronic hematoma,plain scan showed slightly high-density arc line of intima,maximum thickness was about 13mm,accompanied with De-BakeyⅢtype AD.Figure 4.Stanford type B AIH,involved the celiac a.,with the calcified plaque ingression.
3.2 AIH的CT诊断
AIH的典型CT表现为:①主动脉壁呈新月形和(或)不均匀环形增厚,最大厚度≥5.0mm,内壁光滑,增强后未见强化。血肿为急性出血时,密度较高,平扫时可清楚显示;当血肿与主动脉腔内血液密度相近时,平扫难以诊断,此时增强扫描可清楚显示血肿的厚度及有无强化情况。血肿为慢性出血时,血肿液化,密度接近水,平扫主动脉内膜呈线样光滑稍高密度,此点可与主动脉内附壁血栓鉴别(图3a,3b)。②主动脉粥样硬化表现,并见内膜钙化斑内移,少数病例可出现PAU,增强扫描可见向腔外突出的龛影。PAU进一步发展可形成典型AD,但一般多会在PAU的局部形成主动脉壁内的血肿[11]。③文献报道[12]的部分病例因内膜损伤形成小的渗漏孔,增强扫描对比剂通过渗漏孔进入血肿(假腔)内,形成不规则形增强区,此内膜渗漏征象本组未见显示。④部分AIH可累及主动脉分支血管(图4)。
CT不仅能清晰显示AIH的部位及累及范围,准确显示AIH的细小病变,还能直观显示主动脉的形态,及早诊断心包积液、胸腔积液等伴发病变,对临床治疗及判断预后具有重要意义。
3.3 AIH的CT鉴别诊断
AIH应与典型AD、主动脉粥样硬化、附壁血栓、大动脉炎等引起的主动脉壁增厚的病变相鉴别。由于AIH与典型AD均好发于老年人,两者的临床表现极其相似,影像上亦可有主动脉壁呈新月形或不均匀环形增厚、内膜钙化斑内移等征象,通过CT增强扫描显示:AIH内膜片没有撕裂,病变区未见强化表现,无真假腔形成,可明确诊断。但当AD内膜破口封闭且假腔由血栓充填时两者常难以鉴别,所幸这种情况并不常见,Hirst一组505例AD中仅有2例假腔内充满血栓[13]。
AIH与主动脉粥样硬化关系密切,其CT表现有一定的共同点,本组13例AIH患者9例合并主动脉粥样硬化,占总病例的69.2%,因此,两者常需鉴别。主要鉴别点总结如下:①病变形态:AIH多呈新月形或环形增厚,主动脉粥样硬化致管壁多不规则增厚;②病变密度:急性期AIH的密度多高于主动脉粥样硬化,而慢性期AIH的密度则低于后者;③病变部位:AIH可发生在主动脉的任何部位,而主动脉粥样硬化鲜有累及升主动脉;④AIH内膜钙化斑内移距离≥4.0mm,主动脉粥样硬化的钙化斑一般无移位;⑤主动脉内壁光滑度:AIH的内壁多较光滑,而主动脉粥样硬化常致管壁不规则增厚;⑥伴发病变:AIH可伴发心包积液、胸腔积液等病变,单纯主动脉粥样硬化一般无上述伴发病变;⑦随访复查:AIH治疗后随访管壁厚度及密度呈动态变化,主动脉粥样硬化所致的管壁增厚短期内一般无变化。
根据AIH急性发病的临床症状及CT影像特点,与慢性发病的附壁血栓及大动脉炎通常不难鉴别。附壁血栓通常无钙化斑内移,病变局限,可伴发在动脉瘤内;大动脉炎常累及侧支血管,病变间有正常血管存在,而AIH则恰恰相反。当主动脉瘤合并附壁血栓,机化的血栓内大量钙盐沉着时,血栓可见斑点状钙化,此时与AIH鉴别困难,但此种情况较为罕见。
综上所述,螺旋CT具有良好的时间及空间分辨率,检查速度快,能直接观察到AIH的各种细小特征,清晰显示AIH的部位及范围,为AIH的诊断及鉴别诊断提供重要依据,对临床及时诊断、制定合理的治疗方案具有重要的参考价值。
[1]Murray JG,Manisali M,Flamm SD,et al.Intramural hematoma of the thoracic aorta:MR image findings and their prognostic implications[J].Radiology,1997,204(2):349-355.
[2]Song JK,Kim HS,Kang DH,et al.Different clinical features of aortic intramural hematoma versus dissection involving the ascending aorta[J].J Am Coll Cardiol,2001,37(6):1604-1610.
[3]Constant SL,Bottomly K.Induction of Th1 and Th2 CD4+T cell responses:the alternative approaches[J].Annu Rev Immunol,1997,15(1):297-322.
[4]金敬琳,戴汝平,何沙,等.主动脉不典型夹层的电子束CT诊断[J]. 中华放射学杂志,2001,35(10):740-742.
[5]Macura KJ,Corl FM,Fishman EK,et al.Pathogenesis in acute aortic syndromes:aortic dissection,intramuralhematoma,and penetrating atherosclerotic aortic ulcer[J].AJR,2003,181(2):309-316.
[6]Svensson LG,Labib SB,Eisenhauer AC,et al.Intimal tear without hematoma:an important variant of aortic dissection that can elude current imaging techniques[J].Circulation,1999,99(10):1331-1336.
[7]郑敏文,孙力军,葛雅丽,等.主动脉壁内血肿——一种不典型夹层的电子束CT诊断[J].中国临床医学影像杂志,2003,14(1):28-31.
[8]Chao CP,Walker TG,Kalva SP.Natural history and CT appearances of aortic intramural hematoma[J].RadioGraphics,2009,29(3):791-804.
[9]Vilacosta I,San Román JA,Aragoncillo P,et al.Penetrating atherosclerotic aortic ulcer:documentation by transesophageal echocardiography[J].J Am Coll Cardiol,1998,32(1):83-89.
[10]Litmanovich D,Bankier AA,Cantin L,et al.CT and MRI in diseases of the aorta[J].AJR,2009,193(4):928-940.
[11]Kazerooni EA,Bree RL,Williams DM.Penetrating atherosclerotic ulcers of the descending thoracic aorta:evaluation with CT and distinction from aortic dissection[J].Radiology,1992,183(3):759-765.
[12]张小鹏,马祥兴.双源CT对主动脉壁内血肿影像诊断[J].医学影像学杂志,2009,19(7):842-844.
[13]周康荣.胸部颈面部CT[M].上海:上海医科大学出版社,1997.220-223.

