枯草芽孢杆菌产凝乳酶发酵条件的优化
丁明亮,欧阳安然,王望斐,顾正华,丁重阳,张 梁,石贵阳
枯草芽孢杆菌产凝乳酶发酵条件的优化
丁明亮,欧阳安然,王望斐,顾正华,丁重阳*,张 梁,石贵阳
(工业生物技术教育部重点实验室,江南大学生物工程学院,江苏 无锡 214122)
为进一步提高枯草芽孢杆菌(Bacillus subtilis)液态发酵产凝乳酶(milking-clotting enzyme,MCE)的能力,采用单因素试验和响应曲面法对枯草芽孢杆菌液态发酵的产酶条件进行研究和优化。结果表明:最优发酵工艺为:葡萄糖添加量16.2g/L,在500mL三角瓶中装53.3mL料液,接种量为体积分数0.130%,发酵时间120.43h,预测酶活力为1097.30SU/mL,经实验验证,在该条件下发酵产凝乳酶的酶活力为(1129.05±74.55)SU/mL,与模型预测值相符。
凝乳酶;枯草芽孢杆菌; 液态发酵; 响应曲面法; 优化
凝乳酶是乳酪生产中的关键酶,传统上利用牛犊第四胃(皱胃)提取制作,随着乳酪产业不断扩大,单纯靠宰杀幼畜的方法来生产凝乳酶已经不能满足现代工业对凝乳酶的需求[1]。20世纪50年代以来,研究者一直努力寻求新的凝乳酶来源[2],目前除动物凝乳酶外,还有植物凝乳酶(无花果树液和菠萝果实[3])和微生物凝乳酶(主要来源于真菌[4])。微生物的生长特性使得微生物凝乳酶具有广阔的发展前景[5],但关于微生物凝乳酶的研究主要集中在米黑毛霉(Mucor miehei)和微小毛霉(Mucor pusillus)的固态发酵产酶方面,关于细菌液态发酵的研究报道较少。细菌较丝状真菌,具有生长周期短、生产成本低、易于控制生长条件等优点,近几年得到研究者更多的关注。
本课题组前期研究筛选得到了1株具有较高产酶能力的细菌,经鉴定为枯草芽孢杆菌(Bacillus subtilis),在此基础上,本实验研究影响此株枯草芽孢杆菌液态发酵产凝乳酶的相关因素,对发酵条件进行优化并对该条件下发酵产凝乳酶的酶活力进行测定。
1 材料与方法
1.1 菌种与材料
本实验室筛选保藏的1株枯草芽孢杆菌(Bacillus subtilis)。
脱脂奶粉 黑龙江省光明松鹤乳品有限责任公司;麸皮由无锡市青山市场购得,并经JFSD-100-Ⅱ型粉碎机(上海嘉定粮仪有限公司,配有30目筛)粉碎。
1.2 培养基、试剂与仪器
斜面种子培养基(g/L):葡萄糖20、酵母膏10、琼脂条20、pH值自然,115℃灭菌20min;基础发酵培养基(g/L):麸皮 30、NaCl 5、MgSO4·7H2O 5、KH2PO42、CaCO33、pH值自然,121℃灭菌30min。
氯化钙、氯化钠、MgSO4·7H2O、磷酸二氢钾、碳酸钙 国药集团化学试剂有限公司。
DKB-8A型水浴锅 上海精宏实验设备有限公司;DKY-Ⅱ型恒温调速回转式摇床 上海杜科自动化设备有限公司。
1.3 方法
种子液于35℃、150r/min培养24h。发酵产凝乳酶的培养条件根据具体实验设计改变各参数的变量。单因素试验中,葡萄糖质量浓度依次采用0、20、40、60g/L;500mL三角瓶中的装液量依次采用40、60、80、100mL;接种量依次采用0.0125%、0.025%、0.0625%、0.125%;发酵时间依次采用24、48、72、96、120、144h。基于单因素试验,考察发酵培养基中葡萄糖含量、装液量、接种量和发酵时间对凝乳酶活力的影响,借助于Design-Expert7.1.6,采用全因子中心组合设计(Full-factorial CCD)[6]对发酵工艺进行优化。对试验数据进行二次多项式回归拟合,求得响应值与各因子的回归方程并进行实验验证。
采用Arima法进行凝乳酶活力的测定[7]:用0.01mol/L氯化钙溶液配制12%脱脂奶粉溶液,室温放置40min后使用,当天配制。取5mL 12%的脱脂奶粉溶液在35℃水浴锅中保温10min,加0.05mL酶液,立即摇匀,开始计时,把试管倾斜45°,旋转试管,观察壁上出现絮状沉淀时为凝乳终点,记录凝乳时间。40min凝固1mL脱脂乳的酶量定义为一个索氏单位(Soxhlet unit,SU)。按下式计算凝乳酶活力。

式中:MCE为凝乳酶活力/(SU/mL);V1为脱脂牛奶溶液体积/mL;t为凝乳时间/s;V2为加酶体积/mL;n为稀释倍数。
2 结果与分析
2.1 发酵培养基中葡萄糖质量浓度对酶活力的影响

图1 葡萄糖质量浓度对凝乳酶活力的影响Fig.1 Effect of glucose on the MCE activity
由图1可见,葡萄糖质量浓度对凝乳酶活力呈现出低促高抑的现象:葡萄糖质量浓度为0~40g/L时,凝乳酶活力随葡萄糖质量浓度的增加而缓慢升高,当葡萄糖添加量为40g/L时酶活力达最高值402SU/mL;葡萄糖质量浓度为40g/L以上时,凝乳酶活力随葡萄糖质量浓度的增加明显下降。

图2 装液量对凝乳酶活力的影响Fig.2 Effect of liquid volume on the MCE activity
2.2 发酵瓶装液量对凝乳酶活力的影响该枯草芽孢杆菌产凝乳酶的发酵过程对氧有着一定的需求量。由图2可见,装液量为60mL/500mL时获得最高酶活力568SU/mL,再增加装液量,酶活力会迅速下降,当装液量大于80mL/500mL时,酶活力下降速率减慢,溶氧的减少对产酶不利。
2.3 发酵接种量对凝乳酶活力的影响
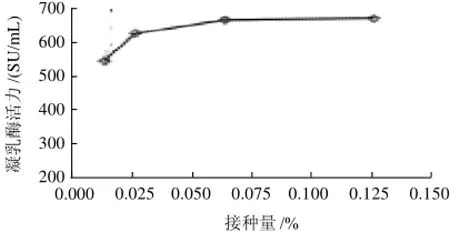
图3 接种量对凝乳酶活力的影响Fig.3 Effect of inoculums size on the MCE activity
由图3可见,随接种量的增加,酶活力不断增强;接种量在0.0125%~0.025%范围内,酶活力随接种量的增加迅速上升至673SU/mL;接种量在0.025%~0.0625%范围内,酶活力增加变缓,当接种量在0.0625%~0.125%范围内,尽管接种量翻倍,但酶活力基本不变。
2.4 发酵时间对酶活力的影响
由图4可见,当发酵时间在24~96h内,凝乳酶的活力随发酵时间的延长迅速增长,但增加速率逐渐变慢;当发酵进行到96h时,酶活力达到最大值633SU/mL;96h后,酶活力逐渐降低,随发酵时间的延长,降低速率逐渐变慢。

图4 发酵时间对凝乳酶活力的影响Fig.4 Effect of fermenting time on the MCE activity
2.5 发酵工艺优化
基于单因素试验,全因子中心组合试验考察的因子为发酵培养基中葡萄糖质量浓度、装液量、接种量和发酵时间对酶活力的影响,各因子的编码水平分别由A、B、C、D代表(表1),其中α=1.68。试验设计及结果见表2,响应值为发酵液中凝乳酶的活力。
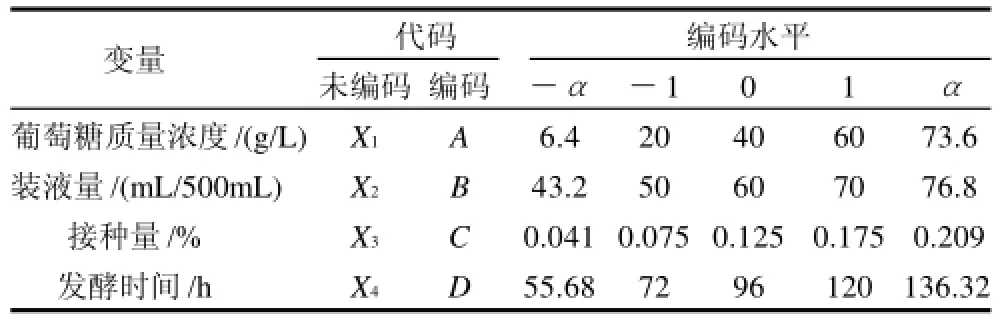
表1 全因子中心组合试验因素水平及编码表Table 1 Experimental level and code of variables chosen for Fullfactorial CCD
表1中各因素的编码值与真实值的关系分别为:A= (X1-40)/2、B=(X2-60)/10、C=(X3-0.125)/0.05、D= (X4-96)/24。
对全因子中心组合设计的试验结果进行二次多项式拟合得到响应值与各因子的多元回归方程为:Y=958.83-97.58A-11.89B+20.90C+147.94D-66.09A2-46.989B2-58.4589C2-88.1305D2+46.29AB-3.04AC-28.23AD+ 14.51BC+2.75BD-3.20CD。

表3 回归方程方差分析Table 3 ANOVA for response surface quadratic polynomial model

表2 全因子中心组合试验设计及结果Table 2 CCD matrix of the four variables with the experimental and predicted MCE activity
通过分析回归系数可知影响发酵产凝乳酶活力的各因素的主次顺序为发酵时间>葡萄糖质量浓度>接种量>装液量。对上述方程的方差分析见表3,用F检验判定回归方程的显著性,该模型P<0.0001,表明该方程极显著,其校正决定系数(R2Adj)为0.9996,说明此模型拟合度较高。根据模型方程绘制的响应曲面图及其等高线图见图5~10。
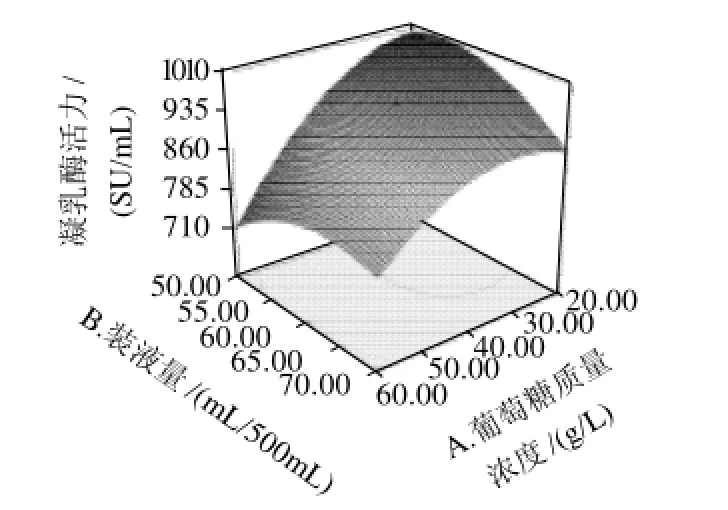

图5 葡萄糖质量浓度和装液量交互影响发酵产凝乳酶活力的响应曲面图及其等高线Fig.5 Response surface and their contour plots of MCE activity versus glucose and liquid volume

图6 葡萄糖质量浓度和接种量交互影响发酵产凝乳酶活力的响应曲面图及其等高线Fig.6 Response surface and their contour plots of MCE activity versus glucose and inoculum size

图7 葡萄糖质量浓度和发酵时间交互影响发酵产凝乳酶活力的响应曲面图及其等高线Fig.7 Response surface and their contour plots of MCE activity versus glucose and fermenting time
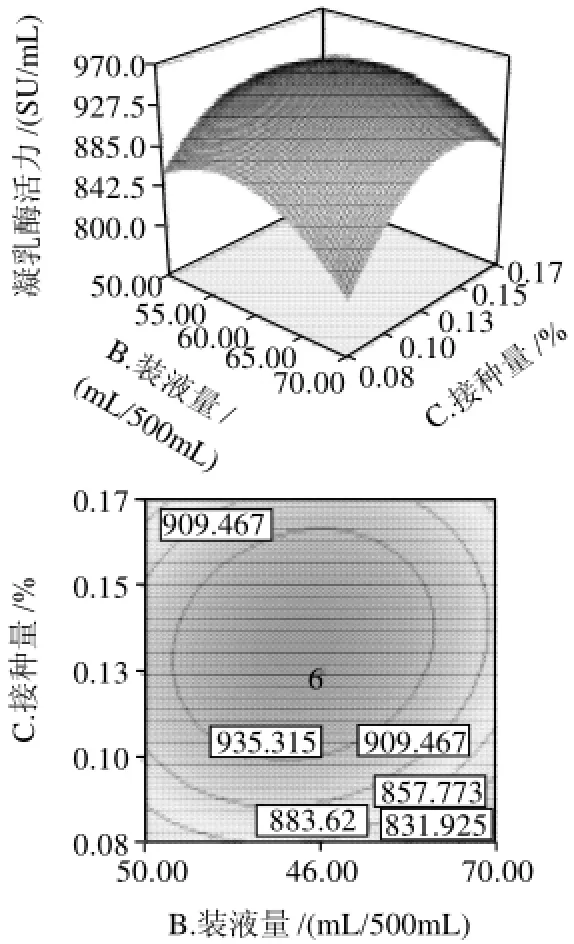
图8 装液量和接种量交互影响发酵产凝乳酶活力的响应曲面图及其等高线Fig.8 Response surface and their contour plots of MCE activity versus liquid volume and inoculum size

图9 装液量和发酵时间交互影响发酵产凝乳酶活力的响应曲面图及其等高线Fig.9 Response surface and their contour plots of MCE activity versus liquid volume and fermenting time
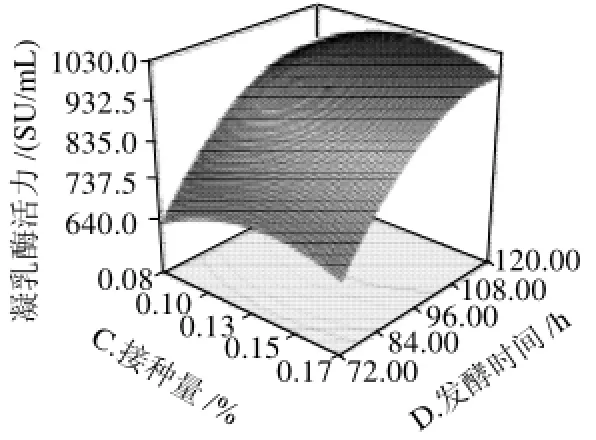

图10 接种量和发酵时间交互影响发酵产凝乳酶活力的响应曲面图及其等高线Fig.10 Response surface and their contour plots of MCE activity versus inoculum size and fermenting time
由图5~10可知,葡萄糖质量浓度、装液量、接种量及发酵时间对发酵产凝乳酶活力的影响均较为显著,表现为曲面较陡。通过对模型方程及响应面的分析,优化得到该菌株发酵产凝乳酶的最适条件为:葡萄糖质量浓度16.2g/L,500mL三角瓶中装发酵液53.3mL,接种量0.130%,发酵时间120.43h,预测在此条件下酶活力为1097.30SU/mL。经实验验证在此条件下发酵产凝乳酶活力为(1129.05±74.55)SU/mL,与模型预测值相符。
3 讨 论
细菌具有体积小、繁殖快、发酵产物易于提取分离等特点,能在人工控制的条件下进行生产,如能筛选得到高产凝乳酶的细菌,则应用于工业化生产将有很大的潜力[8]。枯草芽孢杆菌发酵产凝乳酶可以葡萄糖、果糖[9]、蔗糖[10]为碳源,也有研究指出葡萄糖对于拟诺卡氏属细菌(Nocardiopsis sp.)发酵产凝乳酶几乎没有影响[11]。本菌种在前期实验中,向培养基中分别添加葡萄糖和蔗糖,发酵结束后添加葡萄糖获得的最高酶活力比蔗糖的高100SU/mL。单因素试验中葡萄糖质量浓度对凝乳酶活力呈现出低促高抑的现象,高质量浓度的葡萄糖可能产生钝化作用或影响到培养基的营养平衡。装液量直接影响到发酵过程中发酵液中溶解氧的浓度。对于好氧发酵,菌体处于不同的生长阶段其需氧量也不同,溶解氧浓度是提高生产能力的关键因素之一[12]。菌体对装液量的要求反映出发酵过程中菌体对氧气的依赖程度,此株枯草芽孢杆菌对溶氧有一定的需求;文献[12]报道摇瓶中料液体积增加时,体积吸氧速率降低,当装液量超过10%时,料液体积进一步增加对于体积吸氧速率无大影响[13],这与装液量80~100mL/500mL区间内凝乳酶活力下降速率减慢一致。一般认为,接种量过低将延长菌体的迟滞期,导致菌体的生长减慢,发酵时间延长,而本实验中发现接种量极低的情况下利于产酶,是一个值得关注的现象,目前其具体机理尚不清楚,需要进一步深入研究。有报道表明,发酵产凝乳酶的最适发酵时间为3~8d,因不同菌种而异[10],本株细菌产凝乳酶随发酵时间先升后降,变化的情况与淀粉丝菌(Amylomyces rouxii)在米汤培养基中发酵产凝乳酶[14]的情况相似。
鲜有研究将响应曲面优化应用于凝乳酶液态发酵生产中,本实验对一株产凝乳酶能力较强的枯草芽孢杆菌的发酵条件进行优化,分析发现3个单因素变量都是影响凝乳酶活力的关键因素,所得回归方程极显著,模型拟合程度较高,预测酶活力为1097.30SU/mL,实验验证得到(1129.05±74.55)SU/mL,与预测值相符,酶活力较优化前有显著提高。
[1]LOPES A, TEIXEIRA G, LIBERATO M C, et a1. New vegeta1sources for milk-clotting enzymes[J]. Journal of Molecular Catalysis B: Enzymatic, 1998, 5(1): 63-68.
[2]WHITAKER J R. Properties of milk clotting activity of ficin[J]. Food Technology, 1959, 13: 86-91.
[3]张富新, 杨宝进. 植物凝乳酶凝乳特性的研究[J]. 黄牛杂志, 1997 (1): 27-29.
[4]郭光远, 姜成林, 马俊. 微生物凝乳酶的研究I: 菌株的筛选、发酵、制备及毒性[J]. 微生物学通报, 1988, 15(5): 207-210.
[5]周俊清, 林亲录, 赵谋明. 微生物源凝乳酶的研究进展[J]. 中国食品添加剂, 2004(2): 6-9.
[6]丁重阳, 张笑然, 张梁, 等. 姬松茸胞内多糖碱提取工艺[J]. 生物加工过程, 2008, 6(5): 21-26.
[7]ARIMA K, SHINITER I, GAKUZO T. Milk-clotting enzymes from microorganism. part I: Screening test and identification of potent fungus [J]. Agricultural and Biological Chemistry, 1967, 31(5): 540-545.
[8]宋曦, 甘伯中, 贺晓玲, 等. 天祝放牧牦牛生活环境土壤中一株产凝乳酶细菌的分离与鉴定[J]. 食品科学, 2009, 30(11): 158-162.
[9]DUTT K, UPYA P, SARAN S, et al. Production of milk-clotting protease from Bacillus subtillis[J]. Applied Biochemistry and Biotechnology, 2009, 158(3): 761-772.
[10]SHIEH C, THI L P, SHIH I. Milk-clotting enzymes produced by culture of Bacillus subtilis natto[J]. Biochemical Engineering Journal, 2009, 43 (1): 85-91.
[11]CAVALCANTI M T H, MARTINEZ C R, FURTADO V C, et al. Milk-clotting protease production by Nocardiopsis sp. in an inexpensive medium[J]. World Journal of Microbiology and Biotechnology, 2005, 21(2): 151-154.
[12]何建勇, 夏焕章, 倪孟祥. 发酵工艺学[M]. 2版. 北京: 中国医药科技出版社, 2009: 8.
[13]钱铭镛. 发酵工程最优化控制[M]. 南京: 江苏科学技术出版社, 1998: 3.
[14]YU Peijing, CHOU Chengchun. Factors affecting the growth and production of milk-clotting enzyme by Amylomyces rouxii in rice liquid medium [J]. Food Technology and Biotechnology, 2005, 43(3): 283-288.
Optimizing the Fermentation Process for Milk-clotting Enzyme Production by Bacillus subtilis
DING Ming-liang,OUYANG An-ran,WANG Wang-fei,GU Zheng-hua,DING Zhong-yang*,
ZHANG Liang,SHI Gui-yang
(Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, China)
In order to improve the yield of milk-clotting enzyme (MCE), response surface methodology (RSM) was used to optimize the fermentation process for the production of milk-clotting enzyme from Bacillus subtilis under liquid fermentation. The results showed that the optimal parameters for the fermenting process were as follows: glucose 16.2 g/L, 53.3 mL medium in a 500 mL Erlenmeyer flask, inoculums size 0.130%, fermenting time 120.43 h, and the predicted MCE yield was 1097.30 SU/mL. Under the optimal conditions the MCE activity was (1129.05 ± 74.55) SU/mL, indicating that the optimizing process is effective.
milk-clotting enzyme;Bacillus subtilis;submerged fermentation;response surface methodology;optimization
Q814.4
A
1002-6630(2011)03-0156-05
2010-04-12
丁明亮(1988—),男,本科生,研究方向为生物化工。E-mail:dingmingliang0918@163.com
*通信作者:丁重阳(1975—),男,副教授,博士,研究方向为发酵工程。E-mail:zyding@jiangnan.edu.cn

