黑曲霉H1-9b葡萄糖氧化酶的分离纯化及部分性质研究
苏 茉,高亚朋,梁建荣,黄 洁,唐云明
黑曲霉H1-9b葡萄糖氧化酶的分离纯化及部分性质研究
苏 茉,高亚朋,梁建荣,黄 洁,唐云明*
(西南大学生命科学学院,重庆市甘薯工程研究中心,三峡库区生态环境教育部重点实验室,重庆 400715)
采用研磨法破碎黑曲霉H1-9b菌丝体,经pH5.7磷酸缓冲液抽提获得粗酶液,粗酶液经DEAE-Sepharose离子交换层析和Superdex-200凝胶过滤层析,得到葡萄糖氧化酶纯品。该酶的比活力为30569.7U/mg,回收率为30.2%,提纯倍数为41.4倍,分子质量为94.1kD,为单亚基酶。该酶最适温度为37℃,最适pH值为5.7,在30~40℃温度范围内稳定性较好,在pH4.0~8.0范围内活性稳定。以不同浓度葡萄糖为底物在最适条件下测得该酶Km值为30.69mmol/L,Vmax为21.88μmol/L。Ag+、Cu2+、Zn2+对该酶活性有较大抑制作用。结果表明,该酶稳定性较好,有一定的应用价值。
黑曲霉;葡萄糖氧化酶;分离;纯化;性质
葡萄糖氧化酶(glucose oxidase EC 1.1.3.4,GOD)能够在有氧的情况下催化氧化葡萄糖生成葡萄糖酸[1]。这种酶在自然界中有广泛分布,在工业生产中多以黑曲霉、青霉等微生物为主要来源[2]。葡萄糖氧化酶在食品加工、酿酒[3]及医药卫生行业均有广泛应用[4],故生产高活性且成本低廉的葡萄糖氧化酶有重要意义。目前用黑曲霉为原材料分离纯化葡萄糖氧化酶已有报道,王志新[5]提纯黑曲霉A9的GOD比活力为349.84U/mg,美国Sigma公司生产的商品GOD比活力为266.82U/mg,中国科学院武汉病毒研究所构建的重组酵母所产GOD比活力为426.25U/mg[6],但是酶活力和比活力均不理想。为此,本实验尝试用实验室葡萄糖氧化酶高产菌株黑曲霉H1-9b作为出发菌株,发酵生产并分离纯化葡萄糖氧化酶,同时对其部分性质进行研究。
1 材料与方法
1.1 菌种、培养基与试剂
黑曲霉(Aspergillius niger)H1-9b由西南大学生命科学学院酶工程实验室保存。
培养基参考文献[7]配制。发酵培养基(g/L):蔗糖80、蛋白胨3、KH2PO42、MgSO4·7H2O 0.7、 KCl 0.5、NaNO34, pH5.5;斜面培养基(g/L):蔗糖 30、NaNO32、K2HPO41、KCl 0.5、MgSO40.5、FeSO40.01、琼脂 20,pH5.5。
DEAE-Sephrose(DEAE-琼脂糖)、Superdex-200(葡聚糖凝胶)、三羟甲基氨基甲烷(Tris) 香港Farco公司;牛血清白蛋白(bovine seyum albumin)、卵清蛋白(ovalbumin chicken)、胰蛋白酶抑制剂(trypsin inhibtor)、溶菌酶(lysozyme)、蓝色葡聚糖-2000、蛋白质SDSPAGE标准品 美国Promega公司;载体两性电解质 美国Bio-Rad公司;丙烯酰胺、甲叉-双丙烯酰胺 瑞士Fluka公司;其余试剂均为国产分析纯。
1.2 仪器与设备
MC4L冷冻干燥机 德国Uniequip公司;DYY-Ⅱ型电泳仪 北京六一仪器厂;UV-2550 PC型分光光度计日本岛津公司;BSZ-2型自动双蒸馏水仪 上海博通化学科技有限公司;高速冷冻离心机 日本玖保田公司;PHS-32W微电路pH计 上海理达仪器厂;Powerlook 2100XL凝胶扫描仪 台湾Umax公司;AKTA prime plus蛋白质纯化系统 美国GE公司。
1.3 葡萄糖氧化酶的发酵
1.3.1 种子液培养
在斜面培养基上接种黑曲霉H1-9b孢子,28℃培养4~5d。
1.3.2 摇瓶发酵
250mL锥形瓶中分装50mL发酵培养基,121℃灭菌20min,接种黑曲霉H1-9a孢子浓度为104个/mL,28℃、200r/min摇床培养80h即达产酶高峰。
1.3.3 菌丝体的制备
摇瓶发酵培养完成后,用纱布过滤发酵液,收集球状菌丝体,用双蒸水将其反复冲洗,直至把发酵液冲干净;再用0.2mol/L pH5.7的磷酸缓冲液冲洗菌丝体,压干水分,称质量后收集备用。
1.4 酶的分离纯化
1.4.1 粗酶液的制备
本实验采用研磨法破碎菌丝体。将菌丝体置于研钵中,加入适量石英砂,对菌体进行研磨;充分研磨后按1:1(m/V)加入预冷的0.2mol/L pH5.7磷酸缓冲液浸提粗酶,4℃抽提2h。抽提完成后4℃、12000r/min离心20min,取上清液,即为粗酶液,透析1d后收集备用。
1.4.2 DEAE-Sepharose离子交换层析
用300mL 0.05mol/L pH7.1的Tris-HCl缓冲溶液平衡DEAE-Sepharose离子交换层析柱,取5mL粗酶液上样,用0~1mol/L NaCl(用0.05mol/L,pH7.1的 Tris-HCl缓冲溶液配制)进行梯度洗脱,流速0.5mL/min,每管收集5mL,层析完成后收集GOD活性管,透析脱盐,冷冻干燥后备用。
1.4.3 Superdex-200凝胶过滤层析
用0.05mol/L pH7.1的Tris-HCl缓冲溶液平衡Superdex-200凝胶过滤层析柱过夜,将冷冻干燥后的样品加水稀释至2mL上样,用0.05mol/L pH7.1的Tris-HCl缓冲溶液进行洗脱,流速0.3mL/min,每管收集3mL,层析完成后收集GOD活性管,透析脱盐,冷冻干燥得到GOD纯品。
1.5 酶活力的测定
参照文献[8-9]报道的方法并加以改进。取适当稀释后酶液50μL,加入2.0mL 0.1mol/L pH5.7磷酸缓冲溶液,0.3mL 质量分数10%葡萄糖溶液,50μL 16mmol/L 4-氨基安替吡啉,50μL 7.5mmol/L苯酚,50μL过氧化物酶(1000U/mL),在37℃准确反应4min,再置于沸水浴中快速灭活4min,冷却至室温,在波长500nm处测定其吸光度;空白对照除酶液预先灭活,其他处理相同。将每分钟消耗1μmol葡萄糖所需要的酶量定义为一个活力单位(U)。
1.6 蛋白质含量的测定
用Bradford等[10]方法测定蛋白质含量,以牛血清白蛋白为标准品。
1.7 GOD分子质量测定
用凝胶过滤法[11]测定GOD全分子质量,SDS-PAGE法[12]测定GOD亚基分子质量。8% SDS-PAGE分离胶,5%浓缩胶,电泳后用考马斯亮蓝R-250染色。
1.8 酶的性质测定
1.8.1 最适pH值及pH值稳定性
37℃条件下,测定GOD在不同pH值(4.0~8.0)缓冲溶液中的酶活力;将GOD置于不同pH值(4.0~8.0)缓冲溶液中,测定25℃保存7d后的酶活力。以最大酶活力为100%,其他条件下酶活力与之相比,计算相对酶活力。
1.8.2 最适温度及热稳定性
分别测定GOD在不同温度(20~80℃) 条件下的酶活力,及在30~70℃条件下分别保温1、2、3、4、5h后的酶活力。以最大酶活力为100%,其他条件下酶活力与之相比,计算相对酶活力。
1.8.3 GOD的Km值及Vmax测定
在最适条件下,以不同浓度(25~75mmol/L)的葡萄糖为底物,测定其酶活力,并按双倒数法(Lineweaver-Burk法[13])作图,求出其Km值及Vmax。
1.8.4 金属离子对酶活性的影响
将GOD与不同的金属离子溶液混合,使金属离子的终浓度为1~7mmol/L或0.25~1.5mmol/L,4℃放置30min后,在最适条件下测定其酶活力,以不加金属离子的酶活力为100%(作为标准管),添加金属离子后的残酶活力与标准管酶活力之比即为相对酶活力。金属离子分别为:Li+、K+、Ag+、Mn2+、Mg2+、Zn2+、Ca2+、Ba2+、Co2+、Cu2+、Pb2+。
2 结果与分析
2.1 葡萄糖氧化酶的分离纯化
粗酶液经D E A E-S e p h a r o s e离子交换层析和Superdex-200凝胶过滤层析洗脱曲线如图1、2所示,酶的分离纯化结果见表1。从整个分离纯化过程看,纯化效果较好,纯化倍数较高。

图1 黑曲霉H1-9b所产GOD的DEAE-Sepharose离子交换层析曲线Fig.1 DEAE-Sepharose ion-exchange chromatography of GOD from A. niger H1-9b

图2 黑曲霉H1-9b所产GOD的Superdex-200凝胶过滤层析曲线Fig.2 Superdex-200 gel filtration chromatography of GOD from A. Niger H1-9b

表1 黑曲霉H1-9b所产GOD纯化结果Table 1 Purification of GOD from A. niger H1-9b
2.2 酶的纯度鉴定
由Superdex-200凝胶过滤层析纯化的酶液经SDSPAGE分析,用考马斯亮蓝R-250染色,呈现单一条带,说明该酶已经达到电泳纯(图3)。

图3 黑曲霉H1-9b所产GOD的SDS-PAGE电泳图谱Fig.3 SDS-PAGE of GOD from A. niger H1-9b
2.3 酶的分子质量
经Superdex-200凝胶过滤层析测得酶的分子质量约为94.1kD,经SDS-PAGE测得酶的亚基分子质量约为94.0kD,可见黑曲霉H1-9b所产GOD是单亚基酶。
2.4 酶的性质鉴定
2.4.1 最适pH值及pH值稳定性

图4 pH值对黑曲霉H1-9b所产GOD酶活力的影响Fig.4 Effect of pH on the activity of GOD from A. niger H1-9b
由图4可见,在37℃时,黑曲霉H1-9b 所产GOD在pH5.7左右活性最强,在pH5.0~7.0范围内酶活力较高,超出此范围酶活力显著下降。

图5 黑曲霉H1-9b所产GOD的pH值稳定性Fig.5 pH stability of GOD from A. niger H1-9b
由图5可见,将酶与不同pH值的缓冲溶液混合,25℃放置7d后,保存在各个pH值下的GOD相对酶活力均保持在80%以上,说明该酶在pH4.0~8.0范围内稳定性良好。
2.4.2 最适温度及热稳定性

图6 温度对黑曲霉H1-9b所产GOD酶活力的影响Fig.6 Effect of temperature on the activity of GOD from A. nger H1-9b

图7 黑曲霉H1-9b所产GOD的热稳定性Fig.7 Thermostability of GOD from A. niger H1-9b
由图6可见,黑曲霉H1-9b 所产GOD最适温度为37℃。由图7可见,该酶在30~40℃具有较好的热稳定性,保温5h后相对酶活力在50%左右,超过50℃后活力损失较大,在70℃保温5h后酶活力基本丧失。
2.4.3 酶的米氏常数
以不同浓度葡萄糖为底物,测得黑曲霉H1-9b所产GOD的Km值为30.69mmol/L,Vmax为21.88μmol/(L·s) (图8)。

图8 黑曲霉H1-9b所产GOD的Km值Fig.8 Km of GOD from A. niger H1-9b
2.4.4 金属离子对黑曲霉H1-9b所产GOD酶活性的影响

表2 金属离子对黑曲霉H1-9b所产GOD酶活力的影响Table 2 Effects of Li+, K+, Mn2+, Mg2+, Ca2+, Ba2+and Pb2+on the activity of GOD from A. niger H1-9b
如表2所示,金属离子Li+、K+、Mn2+、Mg2+、Ca2+、Ba2+、Pb2+在1~7mmol/L浓度范围内对黑曲霉H1-9b GOD的活性影响不大,活力均保持在80%以上。而Zn2+、Cu2+、Ag+对其活性影响较大,抑制作用明显,见图9。尤其是Ag+,当其浓度达到1mmol/L时,GOD活性已经完全丧失。Co2+在低浓度下对GOD有双重作用,当浓度小于1mol/L时,对该酶有抑制作用,但随着浓度的升高,这种抑制作用逐渐减弱。
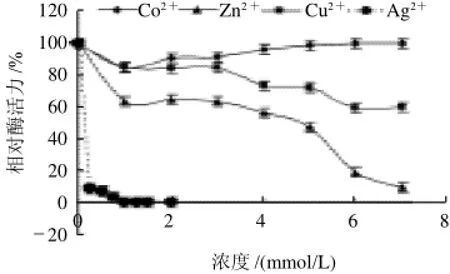
图9 Co2+、Zn2+、Cu2+、Ag+对黑曲霉H1-9b所产GOD酶活力的影响Fig.9 Effects of Co2+, Zn2+, Cu2+and Ag+on the activity of GOD from A. nger H1-9b
3 讨论与结论
本实验从黑曲霉H1-9b中分离得到GOD纯品,该酶的比活为30569.7U/mg,回收率为30.2%,纯化倍数为41.4倍。尤其是在离子交换层析后,酶比活力呈大幅度上升,分离效果较好。张婷[14]、Simpson等[15]纯化的GOD均由两个亚基组成,酶蛋白分子质量分别为160、148kD,而本实验测得黑曲霉H1-9b所产GOD的分子质量为94kD,且为单亚基酶。这与普遍报道有所不同,说明GOD分子结构在不同来源的材料中具有特异性。
黑曲霉H1-9b 所产GOD的热稳定性一般,在30~40℃的温度范围内保温5h后相对酶活力在50%以上,在工业生产中可以在常温下使用。该酶的pH值(pH4.0~8.0)稳定性较高,说明该酶的酸碱耐受力好,可在较宽广的pH值范围内发挥作用,有较高的应用价值。不同来源的GOD的Km值差异较大,张茜[16]纯化的尼崎青霉菌葡萄糖氧化酶Km值为122.6mmol/L,Rando等[17]报道的GOD的Km值为6.2mmol/L,本实验中测得黑曲霉H1-9b所产GOD的Km值为30.69mmol/L,与王志新[5]的实验结果(Km值35.74mmol/L)较为接近,显示黑曲霉H1-9b所产GOD对葡萄糖的亲和力较好。
Zn2+、Cu2+、Ag+对黑曲霉H1-9b 所产GOD的活性有抑制作用,而在Kelley 等[18]的实验中当Cu2+达到10mmol/L时,GOD活性仍没有被抑制。Ag+对该酶的抑制作用很强,当其浓度增加到1mmol/L时,GOD活性已被完全抑制,故认为Zn2+、Cu2+、Ag+是该酶的金属离子抑制剂。Co2+对黑曲霉H1-9b 所产GOD的作用比较特殊,当Co2+浓度低于1mmol/L时,GOD的活性受到了抑制,降至85%,而随着Co2+浓度的逐渐增加,它对GOD活性的抑制作用减弱,直至其浓度达到6~7mmol/L时,GOD的相对酶活力又上升至100%。其原因可能是:GOD酶分子上对Co2+有不同的结合位点,类似于许强等[19]用紫外差分吸收光谱技术研究葡萄糖异构酶与金属离子作用时得出当金属离子和葡萄糖异构酶分子结合后,每个酶分子对金属离子至少存在强弱两种结合位点。据此推测GOD与Co2+结合后,也可能存在强弱结合位点,当Co2+浓度低时,Co2+与酶分子的强结合位点结合,改变了酶的分子结构,但又不足以达到稳定结构的作用,所以使得酶活力略微下降,当浓度升高以后,强弱结合位点均被占据,达到稳定酶分子结构的作用,酶活力回升。而在本实验中涉及的其他金属离子:Li+、K+、Mn2+、Mg2+、Ca2+、Ba2+、Pb2+则在1~7mmol/L浓度范围内对该酶活性的影响不大,且未发现对GOD活性有明显激活作用的金属离子。
[1]HATZIUIKOLAOU D G, MACRIS B J. Factors regulating production of glucose oxidase by Aspergillus niger[J]. Enzyme and Microbial Technology, 1995, 17(6): 530-534.
[2]FOGARTY W M. Microbial enzymes and biotechnology[M]. London: Applied Science Publishers, 1983: 111-123.
[3]PICKERING G J. Optimising glucose conversion in the production of reduced alcohol wine using glucose oxidase[J]. Food Research International, 1998, 31(10): 685-692.
[4]BANKAR B S, BULE M V, SINGHAL R S, et al. Glucose oxidase: an overview[J]. Biotechnology Advances, 2009, 27(4): 489-501.
[5]王志新. 黑曲霉A9葡萄糖氧化酶的提取纯化及其酶学性质研究[D].保定: 河北农业大学, 2006.
[6]RETAMA J R, LOPEZ M S P. Biosensors based on acrylic microgels: A comparative study of immobilized glucose oxidase and tyrosinase[J]. Biosensors and Bioelectronics, 2005, 20(11): 2268-2275.
[7]刘峰, 黄鹭强, 林颖, 等. 从土壤中快速筛选葡萄糖氧化酶产生菌及发酵工艺的优化[J]. 生物技术, 2007, 17(3): 64-68.
[8]张茜, 傅婉辉, 康劲翮, 等. 青霉葡萄糖氧化酶的分离纯化及性质研究[J]. 厦门大学学报: 自然科学版, 2009, 48(1): 99-102.
[9]GROMADA A, FIEDUREK J. Selective isolation of Aspergillus niger mutants with enhanced glucose oxidase production[J]. Journal of Applied Microbiology, 1997, 82(5): 648-652.
[10]BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254.
[11]陈石根, 周瑞琪. 酶学[M]. 上海: 复旦大学出版社, 2001: 174-175.
[12]张龙翔, 张庭芳, 李令媛. 生化实验方法和技术[M]. 2版. 北京: 高等教育出版, 1997: 100-106.
[13]沈同, 王敬岩. 生物化学: 下册[M]. 2版. 北京: 高等教育出版社, 2000: 250-251.
[14]张婷. Aspergillius niger Z-25产葡萄糖氧化酶发酵条件优化及酶的分离纯化研究[D]. 南京: 南京农业大学, 2008.
[15]SIMPSON C, JORDAAN J, GARDINER N S, et al. Isolation, purification and characterization of a novel glucose oxidase from Penicillium sp. CBS 120262 optimally active at neutral pH[J]. Protein Expression and Purification, 2007, 51(2): 260-266.
[16]张茜. 尼崎青霉菌葡萄糖氧化酶的分离纯化及性质研究[D]. 厦门: 厦门大学, 2009.
[17]RANDO D, KOHRING G W, GIFFHORN F. Production, purification and characterization of glucose oxidase from a newly isolated strain of Penicillium pinophilum[J]. Applied Microbiology and Biotechnology, 1997, 48(1): 34-40.
[18]KELLEY R L, REDDY C A. Purification and characterization of glucose oxidase from ligninolytic cultures of phanerochaete chrysosporium[J]. Journal of Bacteriol, 1986, 166(1): 269-274.
[19]许强, 黄友梅. 应用光谱技术研究葡萄糖异构酶与金属离子的作用[J]. 内蒙古石油化工, 1997, 23(3): 26-32.
Isolation, Purification and Some Properties of Glucose Oxidase from Aspergillius niger H1-9b
SU Mo,GAO Ya-peng,LIANG Jian-rong,HUANG Jie,TANG Yun-ming*
(Key Laboratory of Eco-environments in Three Gorges Reservoir Region, Ministry of Education, Chongqing Sweetpotato Engineering Research Center, School of Life Science, Southwest University, Chongqing 400715, China)
Glucose oxidase (GOD), an H2O2-producing enzyme, was isolated and purified from Aspergillius niger H1-9b through electrophoretic homogeneity, ion-exchange chromatography on DEAE-Sepharose column and Superdex-200 gel filtration chromatography. The purified GOD had a molecular weight of 94.1 kD as a monomer. The specific activity of GOD was 30569.7 U/mg with recovery rate of 30.2% and purification fold of 41.4. The optimal reaction pH and temperature of GOD were 5.7 and 37 ℃, respectively. The GOD displayed an excellent stability under the conditions of 30-40 ℃ and pH 4.0-8.0. The kinetic parameters such as Km and Vmax were 30.69 mmol/L and 21.88μmol/L while using glucose as the substrate. Obvious inhibitory effects of Ag+, Cu2+and Zn2+on the activity of GOD were observed. Therefore, glucose oxidase from Aspergillius niger H1-9b will have wide applications due to its excellent thermostability and stability in wide pH range.
Aspergillius niger H1-9b;glucose oxidase;isolation;purification;property
Q946.5
A
1002-6630(2011)03-0181-05
2010-04-21
重庆市科学技术委员会科技攻关项目(CSCT2004AC1012)
苏茉(1986—),女,硕士研究生,主要从事蛋白质与酶工程研究。E-mail:chaos421@163.com
*通信作者:唐云明(1960—),男,教授,博士,主要从事蛋白质与酶工程研究。E-mail:tbright2008@126.com

