运动、免疫应答与骨代谢研究进展
马涛 李世昌 孙朋 郑庆云
1 浙江工业大学体育军训部(杭州 310014) 2 华东师范大学体育与健康学院(上海 200241)
近年来的研究发现,骨骼系统和免疫系统联系密切,骨细胞和免疫细胞共同处于骨髓腔微环境中,它们共享许多调节分子,包括细胞因子及其受体、信号分子和转录因子等。破骨细胞和巨噬细胞均具有组织降解的功能,之后偶联的修复过程是通过由基质干细胞起源的成骨细胞或成纤维细胞而实现的。骨骼系统和免疫系统不仅在功能上存在很多相似性,而且他们受类似的细胞因子的调控。已有研究表明,骨组织重建的动态平衡受免疫系统的调控,尤其是在免疫系统被激活或处于病理状态时,如在自身免疫性疾病如类风湿关节炎(rheumatoid arthritis,RA) 观察到由于免疫系统激活,浸润的淋巴细胞和单核细胞产生若干重要的细胞因子,如肿瘤坏死因子α(TNF-α)和γ干扰素(IFN-γ)等,这些细胞因子通过改变成骨细胞(osteoblast,OB)和破骨细胞(osteoclast,OC)之间的平衡从而影响骨代谢。尽管骨和免疫系统之间相互作用的分子机制还不十分清楚,但免疫系统和骨代谢之间确实存在相互调节作用,目前已经产生了一个新的交叉学科——骨骼免疫学(osteoimmunology)[1]。运动对于免疫系统和骨骼系统均有影响,然而目前国内关于运动—免疫系统—骨代谢三者之间关系的研究尚未见报道,国外在这方面的研究也刚刚起步,因此有必要引起相关研究者的重视,为进一步揭示运动影响骨代谢的机制提供研究思路。
1 免疫系统对骨代谢的调节作用
1.1 概述
破骨细胞与巨噬细胞均起源于造血干细胞的单核细胞前体,分化过程中都受到基质干细胞/成骨细胞前体分泌的多种细胞因子的调控,基质细胞主要分布在骨髓骨内膜表面和骨小梁表面,与四周的破骨细胞前体及早期的B细胞前体紧密接触,这是实现共同调控的基础。骨髓基质细胞、成骨细胞和活化的T细胞产生的巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF) 和核因子κB 受体活化因子配体( receptor activator of NF-κB ligand,RANKL)是破骨细胞分化过程中两个必需的细胞因子[2]。 RANKL既可以与破骨细胞及其前体细胞的膜受体核因子κB 受体活化因子( receptor activator of NF-κB,RANK)结合,也可以同骨髓基质细胞、成骨细胞产生的可溶性受体护骨素( osteop rotegerin,OPG) 结合。RANKL与其受体RANK结合后,在M-CSF存在的情况下,可促进造血前体细胞向破骨细胞分化,并增强成熟破骨细胞的活性,抑制破骨细胞凋亡,促进骨吸收。OPG的作用是与RANK竞争性结合RANKL,阻碍RANKL与RANK的结合,抑制破骨细胞的分化和激活[3],从而减缓骨吸收。成骨细胞前体和激活的T细胞均可合成RANKL,而RANK在破骨细胞前体、成熟破骨细胞和T细胞、B细胞、树突状细胞表面均有表达,由此可产生交叉调节作用。免疫系统还可以通过产生相关细胞因子如TNF-α、INF-γ、转化生长因子β(TGF-β)、白细胞介素(IL)-1、IL-6、IL-7 、IL-12和IL-18等,直接或间接调节OPG-RANKL-RANK 系统来影响骨代谢[4]。
雌激素对于骨骼的生长发育和骨重建过程的动态平衡具有重要作用。成骨细胞、骨细胞、破骨细胞及骨髓基质细胞都表达雌激素受体(estrogen receptor,ER)。雌激素与其受体结合后,雌激素受体构象发生改变,与雌激素反应元件结合形成复合物,从而促进靶基因的表达。此外,雌激素还可以对破骨细胞形成因子的表达产生抑制,如M-CSF、IL-6和TNF-α等,通过抑制细胞内c-Jun N端激酶/ c-fos/ c-jun( JNK)通路的活性,促进破骨细胞凋亡,抑制成骨细胞凋亡[5]。在雌激素缺乏的情况下,T细胞增多并活化,使得TNF-α、IL-6、IL-7等促进破骨细胞形成的细胞因子表达增加,而TGF-β、IL-18、IL-12等破骨细胞形成的抑制因子产生减少,从而造成破骨细胞形成增多,骨吸收增强而发生骨质疏松症。绝经后骨质疏松症在一定程度上可以被认为是一种以器官特异性免疫紊乱为特征,由雌激素缺乏而造成的免疫系统参与的炎症性疾病,是由于T细胞TGF-β作用受到抑制而导致的免疫反应增强的结果。因此抑制T细胞的活化和刺激TGF-β的产生有可能成为防治骨吸收的有效方法。
1.2 免疫细胞与骨代谢
破骨细胞形成增多与多种细胞因子的产生密切相关,活化的T细胞可造成有关细胞因子的产生增加,从而刺激破骨细胞的形成。在T细胞分泌的各种因子中,TNF-α、TNF-β、IL-6和IL-17具有促进骨吸收的作用;而TGF-β、IL-4、IL-10、IL-12、IL-18和INF-γ则可抑制破骨细胞的功能,粒细胞——巨噬细胞集落刺激因子(GM-CSF)因破骨细胞所处阶段的不同,可表现为正反两方面的作用。微生物抗原以及变形的胶原成分可激活T细胞促进其表达黏附分子及多种炎性因子,并通过RANKL-RANK途径激活破骨细胞,引起炎性骨溶解,该机制可能是类风湿关节炎、牙周病和慢病毒感染患者骨破坏的根本原因。实验表明,类风湿关节炎动物模型中,关节表面骨和软骨的破坏与T细胞的激活密切相关。从关节滑膜分离的T细胞可表达RANKL分子。应用OPG后,虽然炎症表现及免疫反应无明显改变,但骨丢失可得到完全抑制,局部破骨细胞的数量也明显减少[6,7]。T细胞还表达雌激素受体,雌激素可直接作用于T细胞雌激素受体,调节T细胞的功能并使之产生有关细胞因子。已发现绝经后骨质疏松妇女的T细胞发生改变。表现为CD4+和CD8+T细胞减少,两者的比值上升,CD3+和CD56+T细胞增加[8]。胸腺缺如的小鼠与正常小鼠相比,去卵巢术后(ovariectomy,OVX)没有造成破骨细胞的增加,这表明胸腺缺如对OVX诱导的骨质舒松具有保护作用。TNF-α-/-的去卵巢小鼠不发生骨量减少,而将野生型小鼠的T细胞移植给胸腺缺如的小鼠就可以造成去卵巢诱导的骨量减少,但自TNF-α-/-小鼠移植的T细胞则不能恢复去卵巢诱导的骨量减少。这说明T细胞介导了雌激素缺乏造成的破骨细胞增殖活化以及对骨重建的影响。目前认为在雌激素缺乏诱导骨量减少的病理过程中,T细胞直接作用于破骨细胞前体细胞或通过与细胞因子的相互作用而发挥效应[9]。T细胞可分泌多种促进或抑制破骨细胞形成的细胞因子,其中RANKL和TNF在破骨细胞形成中发挥关键作用,活化的T细胞还可以产生INF-α和INF-γ,通过抑制NF-κB和JNK信号通路,部分抑制RANKL诱导的骨量减少。在雌激素缺乏的情况下,促进破骨细胞形成的细胞因子产生增加,破骨细胞增殖和活化,骨吸收增加。
实验表明B细胞有调节骨代谢的作用,如在绝经后骨质疏松患者或卵巢切除术后骨质疏松的动物中,B细胞的数量增加,而在敲除IL-7受体基因后,因B细胞形成和成熟障碍,动物可出现骨密度升高。Onoe[10]和 Kanematsu[11]等研究发现,在B细胞调节骨代谢的过程中,IL-1、IL-6、TNF-α和RANKL的作用非常重要。当雌激素水平降低时,可通过IL-1和TNF-α促进成骨细胞/基质细胞产生前列腺素E2(PGE2),进而刺激前B细胞和基质细胞表达RANKL,通过RANKL /RANK/OPG系统增加破骨细胞形成和分化。由于B细胞和破骨细胞具有共同的前体,并受雌激素所调节,因此前B细胞直接向破骨细胞分化也是引起绝经后骨质疏松的重要原因。所以B细胞可以通过以下两种途径参与骨代谢的调节:(1)促进OB/基质细胞产生RANKL,通过RANKL /RANK/OPG系统增加破骨细胞形成和分化;(2)本身作为破骨细胞前体细胞参与骨代谢。也有研究发现B 细胞可促进骨形成,观察到关节炎时皮质骨屏障破坏,骨髓暴露于滑膜组织。临近关节炎损害部位的骨髓呈现B淋巴细胞富集浸润,从而使BMPs表达增加并刺激骨内膜骨形成。由于B细胞表达的BMP-6和BMP-7是新骨生成的重要刺激因子,所以骨髓通过损害部位BMP-6和BMP-7表达的增加诱导骨内膜骨形成,积极参与关节炎病程[12]。
1.3 免疫相关细胞因子与骨代谢
多种免疫相关细胞因子通过OPG-RANKLRANK依赖途径或非依赖途径改变成骨细胞和破骨细胞之间的平衡代谢,从而影响骨代谢,如肿瘤坏死因子(TNF)-α、白介素-6(IL-6)和干扰素(IFN-γ)等,这些细胞因子和骨代谢的关系如图1所示。
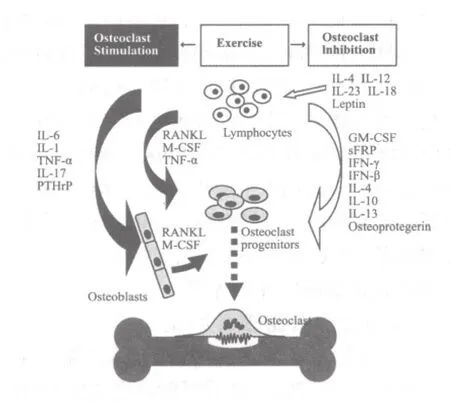
图1 免疫相关细胞因子与骨代谢关系图[13]
动物实验表明,TNF在雌激素缺乏造成的破骨细胞形成增加的过程中发挥重要作用,卵巢切除不能诱发TNF基因敲除的小鼠和缺乏TNF受体的小鼠骨量减少[14],对TNF不敏感的小鼠以及应用TNF 结合蛋白处理的小鼠对去卵巢诱发的骨量减少有抵抗作用。去卵巢小鼠和绝经后妇女T细胞增多,从而分泌TNF增多,血TNF水平升高[15]。TNF-α是促进破骨细胞增殖的细胞因子,由活化的T细胞产生,TNF-α可与TNF-α受体p55结合增强RANKL和GM-CSF的促破骨细胞形成作用。雌激素缺乏时,在抗原的刺激下,由抗原递呈细胞(antigen presenting cell,APC)把外来抗原递呈给T细胞,使得T细胞活化,造成T细胞分化增殖,生存期延长。APC的活化受主要组织相容性抗原(major histocompability complex,MHC)的调节,MHC与抗原在细胞表面形成复合物,与T细胞受体( T cell receptor,TCR)结合,将抗原递呈给T细胞[15,16]。雌激素缺乏可刺激II类转录活化因子( class II transactivator,CIITA)基因的表达,其转录产物为MHC II的转录活化因子,可以上调MHC II的表达。APC活性明显增加,使得T细胞增殖、分化,TNF-α分泌增多。去卵巢还可以通过抑制活化诱导的细胞死亡( activationinduced cell death,AICD)延长 T 细胞的生存期[15],减少T细胞凋亡,增加活化T细胞的数量,造成TNF-α分泌增多,破骨细胞数量增加,骨量减少。
INF-γ可调控CIITA 基因的表达,INF-γ由辅助T细胞产生。去卵巢小鼠由于雌激素缺乏而导致T细胞INF-γ产生增多,使CIITA对INF-γ反应增强,CIITA表达增加[15]。INF-γ既可直接作用于成熟破骨细胞而阻断破骨细胞的形成,也可以通过诱导APC,活化T细胞,促进破骨细胞形成。当T细胞活化发生在固有免疫反应中时,INF-γ起抑制RANKL的作用,它能促进RANK尾部TRAF6的降解,进而阻断RANKL对核因子κB和c-jun N端激酶的激活作用,从而抑制骨吸收;但是当发生在适应性免疫反应中,如雌激素缺乏的情况下,INF-γ起促进骨吸收作用[17]。
TGF-β是一个强有力的骨吸收抑制因子,通过抑制T细胞的活化增殖和其他细胞因子,如INF-γ的产生发挥强有力的破骨细胞抑制作用。TGF-β可刺激RANK在前OCs中表达,并增加OCs 对RANKL 的敏感性。TGF-β2 在骨膜中能提高骨形成同时又不影响其他系统。在注射点局部注射TGF-β1 和 -β2 可预防骨量丢失[18]。雌激素与其受体结合形成复合物整合到TGF-β的启动子上,可以直接促进其合成。TGF-β对参与骨代谢的多种细胞因子均有调节作用,它不仅可以抑制T细胞的增殖和分化,减少INF-γ的产生,而且TGF-β还可以降低CIITA基因对INF-γ的反应,通过调节CIITA基因的表达以及对T细胞增殖与分化的直接作用而阻止TNF-α的产生。在转基因大鼠模型中,当特异性表达于T细胞的TGF-β受体以非活性形式为主时,出现T细胞活性增强,TNF产生增多,骨吸收增强伴有明显的骨量减少。而过度表达TGF-β可防止去卵巢诱导的骨量减少和骨丢失[19]。
雌激素调节INF-γ和TNF的产生机制部分是通过抑制IL-7实现的。IL-7是一种可导致骨破坏的淋巴细胞因子,由CD40+的T细胞分泌,作用于成骨细胞,可促进前列腺素E2(PGE2)和RANKL的表达。IL-7基因敲除小鼠表现出骨量增加、骨密度增加,而IL-7转基因小鼠的骨髓腔增大,皮质骨和骨表面出现坏死灶。IL-7可诱导T细胞产生RANKL,给小鼠注射IL-7可导致T细胞产生的TNF、RANKL 增加,导致骨破坏[20]。在雌激素缺乏时IL-7的水平明显增加,应用抗体阻断IL-7对去卵巢诱导的骨量减少有保护作用[21]。IL-6在骨吸收过程中也具有十分关键的作用。雌激素可以降低IL-6的表达水平,绝经后雌激素水平降低,造成IL-6 水平增加,这与骨质疏松的发病密切相关。位于IL-6基因启动子区域的-572和-174 G→C多态性分布与绝经后女性血CRP、骨吸收指标I型胶原羧基末端肽(CTX)水平显著相关,而保护性等位基因-572G和-174C减少伴有血CRP和CTX水平的明显升高[22]。IL-18 和 IL-12 是破骨细胞的抑制因子,两者有协同作用。IL-18和IL-12可上调Fasl表达,Fas和其配体Fasl的相互作用可以抑制TNF-α介导的破骨细胞形成[23]。在雌激素缺乏的情况下,T细胞活化,TNF-α产生增多,而IL-18 和IL-12 可以抑制由TNF-α介导的破骨细胞形成,抑制骨吸收。IL-18由成骨细胞/基质细胞合成,IL-18是通过刺激T细胞合成并分泌GMCSF和INF-γ来实现对破骨细胞的抑制作用的[24]。GM-CSF能抑制破骨细胞前体细胞表达整合素β5,从而抑制破骨细胞成熟,在PGE2、M-CSF和RANKL刺激破骨细胞形成的过程中,均可见到GM-CSF的表达减少,而抗GM-CSF抗体能促进维生素D3诱导的破骨细胞形成。IL-12的功能类似于IL-18,但它们都不能直接抑制RANKL诱导的破骨细胞形成。然而若在培养体系中加入CD4+或CD8+的T细胞,IL-12和IL-18对于破骨细胞的抑制作用又将重新出现,提示T细胞在此过程中起重要作用。但IL-12对于破骨细胞的抑制作用不必依赖于GM-CSF和INF-γ,这与IL-18有所不同[25]。
2 运动、免疫应答与骨代谢
2.1 运动对免疫细胞的影响
研究表明短时间高强度运动能造成暂时性免疫机能抑制,主要表现在淋巴细胞数量和功能的降低,这种变化可持续数小时,而且在运动员和未受过系统训练的个体中均可发生[26]。如此周而复始地抑制免疫机能导致T淋巴细胞反应和免疫球蛋白产生降低,机体对病毒的识别和抵抗能力下降,容易发生感染。不同强度运动引起的免疫功能的改变主要体现在T细胞数量和功能的改变,以及T细胞亚群的分化。中小强度运动能引起淋巴细胞数目的增多,而大强度运动则可引起淋巴细胞数目下降。在Edwards的研究中[27],短时间小强度运动(5 min上下楼梯跑)和中等强度(功率自行车运动,心率达150次/min) 运动引起Tn、Ts 增多。有研究[28]报告,极限强度运动可导致运动员体内免疫机能出现暂时性抑制,淋巴细胞的数目及功能显著下降。在极限运动后,辅助性T淋巴细胞减少而抑制性淋巴细胞数增加,使得CD4+/CD8+细胞比值显著降低,而强度越大、持续时间越长的运动使CD4+细胞减少的程度越大。周丽丽等人研究发现,6周递增负荷游泳运动可造成大鼠T细胞亚群中CD4+细胞数量及CD4+/CD8+比值下降;大鼠外周血活化的T细胞数量下降[29]。蔡国梁等人的研究发现,适度运动明显提高了CD3+T 和CD4+T细胞数量,可以证明适度运动具有显著促进免疫功能的作用。短时间低强度运动可以使T淋巴细胞水平显著上升;力竭运动也能提高T淋巴细胞的转化率,但是大大降低了NK细胞和IL-l、IL-2的活性,使机体的免疫功能受到抑制[30]。
运动对于B细胞的影响同样具有运动强度依赖性。运动强度过低就不会引起抗体水平的显著变化,B淋巴细胞的功能也不会有显著的变化。研究者观察运动员以75%VO2max 强度进行8~12 km跑步后,血中抗体也没有显著变化;实验证实,随着运动时间的延长,强度的增加,B淋巴细胞的变化才有显著性。长时间剧烈运动可引起血浆皮质醇升高,而升高的程度和持续时间取决于运动强度和时间。皮质类固醇激素作为一种免疫抑制剂,可抑制B 细胞功能,使抗体生成减少,NK细胞活性下降。有资料显示,sIgA 的水平变化与运动具有十分密切的关系。连续的高强度运动或超长时间运动会降低运动员安静sIgA 水平,在大强度运动训练后唾液sIgA 含量比训练前显著升高[31]。
巨噬细胞能分泌多种细胞因子,主要包括IL-1、TGF-β、TNF和IFN-γ等,并且能产生氧自由基和NO自由基,这些分子能促进或抑制炎症,影响淋巴细胞的功能和组织的修复更新。运动可以提高人体组织中巨噬细胞的趋化性和吞噬功能。急性运动能使外周血液中的单核细胞数目发生短时间增加(50%~100%)[32]。单核细胞数目变化与运动强度和持续时间密切相关,随着运动持续时间的延长,成熟的单核细胞就会移出脉管系统。不同的运动强度对腹膜巨噬细胞抗原表达的影响也不同[33],中等强度运动对腹膜巨噬细胞的抗原表达影响不明显,力竭运动后腹膜巨噬细胞抗原表达则受到抑制。有人研究了老年妇女的身体锻炼与免疫功能,对12名67~85岁的老年妇女进行为期12周的锻炼,锻炼方式为60%的储备心率进行步行,每天30~40 min,每周5 d。结果NK细胞和T细胞功能较对照组显著增强[34]。这表明长期适量运动能使免疫系统机能得到增强。
2.2 运动对免疫相关细胞因子的影响
细胞因子主要是由活化的淋巴细胞和单核巨噬细胞等产生的具有高活性、多功能的小分子蛋白质,主要包括干扰素(INF)、白细胞介素(IL)、集落刺激因子(CSF)和肿瘤坏死因子(TNF)四类。Th1 细胞能产生大量IL-2 和IFN-γ,激活T细胞,与典型的细胞免疫功能有关; Th2 细胞产生IL-4、IL-5、IL-10 和IL-13 等细胞因子,能够活化B 细胞,激活体液免疫。作为细胞间的信息传递分子,细胞因子主要介导和调节免疫应答和炎症反应,刺激造血功能,并参与组织修复。研究显示,长时间耐力运动可引起血浆IL-1 水平提高;同时血浆IL-2 水平则会下降。进一步研究发现,长时间耐力运动后,血清中很多细胞因子均增加,如:IL-6、IL-8、IL-10、粒细胞 CSF 以及单核细胞 CSF[35]。Chan 等[36]研究发现,运动明显增加了IL-6和IL-8 的mRNA水平,运动后IL-8 表达升高,其原因可能是由于细胞因子的重新分配、肌肉炎症反应刺激细胞因子的产生以及其基因表达上调等原因。有研究发现,长时间耐力运动引起血浆IL-l 水平的升高可能与肌肉损伤有关;而血浆IL-2 水平的降低可能是对IL-2 受体P70~75 表达增加的强烈反应和靶细胞分配变化的反应。另有研究显示自行车运动员进行功率自行车运动(20 min,强度为VO2max 强度)后即刻,淋巴细胞分泌的IL-2 是安静值的27%,运动后2h 为安静值的40%。
在崔建华等[37]的研究中,对从平原进驻高原的官兵进行IL-2 测定,结果显示高原低氧环境下IL-2 活性明显低于平原,且随海拔的升高而降低,但随着居住时间的延长会导致IL-2 升高。这表明急性低氧可导致机体免疫功能下降,随高原居住时间的延长,可逐步获得对高原低氧环境的免疫适应。在朱海宏等[38]的研究中对比了不同海拔高度生活的高原居住者外周血IL-1β、IL-6水平,表明在4050m 生活的正常人IL-1β、IL-6 的水平明显高于对照组;在3010m 生活的正常人IL-1β、IL-6的水平也有升高趋势。有研究显示,高原暴露后,有丝分裂原诱导IL-1β、IL-4、IFN-γ水平增加以及IL-2 水平下降,认为在中等高度的高原训练能够使免疫参数发生变化,且高原暴露引起的免疫变化比训练引起的变化更为明显[39]。有研究[40]观察了5 周的HiHiLo 和LoHi过程对机体免疫功能的影响发现,采用HiHiLo与LoHi两种不同方式的低氧训练,细胞因子产生变化的总体趋向一致,但HiHiLo 组比LoHi 组的变化更为明显。低氧训练后期,HiHiLo 组IFN-γ mRNA 的表达比低氧训练早期明显上调,IL-4 mRNA、PFR mRNA 的表达则比低氧训练前明显下调。而LoHi 组仅表现为IL-4 mRNA 明显下调。这说明低氧训练对不同细胞因子产生的影响不同。长期低氧训练可以使机体细胞免疫功能产生一定程度的适应。
2.3 运动引起的免疫应答对骨代谢的调节
运动对于骨代谢影响的原因是多方面的,包括运动时的直接应力和间接应力使骨发生适应性改变或病变,运动促进激素和局部生长因子的释放以及运动对钙等营养元素吸收的影响等。除了上述途径外,运动诱导的免疫细胞及相关细胞因子在骨代谢的调节中发挥重要作用。青少年时期适当的体育运动可以促进骨发育,有利于提高峰值骨量;成年时期合适的体育运动可以保持骨量,减缓骨量流失,有利于防止骨质疏松的发生。在这些过程中,适量的运动产生的免疫系统的良性适应起到了不容忽视的作用;而超强度运动训练可以对骨代谢造成不利影响,引起骨质疏松,增加骨折风险,这和大强度运动引起的免疫系统功能紊乱和炎症反应密切相关。如张京鲁等人的研究[42]发现,长期参与足球运动的年轻女性运动员与无运动训练女性相比可获得更高的骨密度。在罗冬林等人的研究[43]中,排球运动可显著提高骨矿总量和全身骨密度(BMD),可显著提高腰椎和骨盆部位的BMD,可显著提高下肢骨矿含量(BMC)和BMD以及上肢优势侧的BMC和BMD,这种骨骼的适应性变化体现了一种专项特征。高丽等人研究[44]表明,与对照组相比,10周大强度跑台运动导致运动性动情周期抑制雌性大鼠骨形成指标显著性降低,骨吸收指标显著性升高,胫骨的骨密度显著性降低,股骨、胫骨的最大载荷、弹性载荷均显著低于对照组。Jeanne等的研究[45]发现,参加大负荷周期性运动项目造成运动性闭经的运动员的BMD比正常运动员低。
免疫系统可以被看作是一种感觉器官,就好像一个流动脑。免疫细胞不仅是免疫系统的效应细胞,而且能识别不同的非感觉性刺激,从而分泌不同的免疫递质(细胞因子),这些免疫递质除了可作用于免疫系统本身外,还可作用于神经系统和内分泌系统,进而使机体稳态更好的维持。运动作为一种应激,刺激机体免疫系统产生免疫应答,可使免疫细胞活性发生相应改变并产生多种生物活性分子,如 IL-1、IL-6、IL-7 、IL-12、IL-18、TNF-α、INF-γ、TGF-β等,这些免疫相关的细胞因子可作用于骨髓基质细胞、成骨细胞、破骨细胞及其前体细胞,通过影响OPG-RANKL-RANK系统来调节骨代谢。如一次性力竭运动后,血浆中骨代谢相关细胞因子水平均发生显著变化,特别是IL-6 、IL-10 、粒细胞集落刺激因子( G-CSF)[46,47]。一次性大强度运动还可以提高运动员血清TGF-β的水平[48]。对未经专业训练受试者的研究结果显示,以60~65%VO2max 强度蹬车或跑步3h 后,血浆TNF-α、IL-1β、IL-6 水平显著升高,运动结束后逐渐降低,但24h 后仍高于正常水平[49]。Gokhale等[50]发现,运动员和普通受试者在一次大强度运动后均表现为IL-6 上升、TNF-α下降,两者的区别在于运动员细胞因子的变化幅度较非运动员受试者小。在Ziegler等人的研究[51]中,31名参加长跑者分为两组,分别参加15 km和42.195 km距离的长跑,于跑前和跑后即刻对血清OPG和sRANKL进行测试,结果显示两组的血清sRANKL水平在长跑后即刻都显著降低,并且与长跑的距离相关;同时血清OPG水平仅在42.195 km距离组有显著升高。作者推测长跑对于骨量的积极影响是通过OPG-RANKL-RANK系统介导的。Kerschan-Schindl等人研究[52]了246 km的超长距离马拉松对18名运动员(16男2女)骨代谢的影响,结果显示:在长跑完即刻和3天后,血清CTX、RANKL和OPG显著增加,这说明超长距离的长跑改变了OPG-RANKL-RANK系统的作用,使骨代谢暂时解偶联,导致骨吸收增加,而骨形成被抑制。Kobayashi等人[53]的实验表明,应力导致骨吸收向骨形成转换,使前破骨细胞发生程序性死亡,同时发现在应力末端的骨表面,OPG的mRNA表达增加。
3 小结
破骨细胞在功能上和形态上都和巨噬细胞有很多相似之处,在正常的生理条件下,破骨细胞的作用是溶解损伤或多余的骨组织,其吸收骨的过程和巨噬细胞吞噬病毒的过程极其相似。对于破骨细胞来说,损伤的骨组织或多余的骨组织相当于一种抗原刺激。而成骨细胞的骨修复功能则与成纤维细胞功能非常相似。所以,从某种意义上来说,破骨细胞和成骨细胞可以看作免疫系统的一部分。正常条件下,由破骨细胞介导的骨吸收和成骨细胞介导的骨形成完美相偶联,保证骨组织的不断更新。然而在免疫系统发生改变时,在免疫相关细胞因子的调节下,破骨细胞的功能也随之发生改变。运动可以对免疫系统和骨骼系统发生作用,其作用结果和运动负荷的大小密切相关。深入研究运动—免疫系统—骨代谢三者的相互关系将有利于进一步揭示运动影响骨代谢的机制。
[1]Sato K,Takayanagi H. Osteoclasts,rheumatoid,arthritis and osteoimmunology. Curr Opin Rheumatol,2006,18(1):419-426.
[2]Khosla SC. Minireview:the OPG/RANKL /RANK system. Endocrinology,2001,142(12):5050-5055.
[3]Kim N. Osteoclast differentiation independent of the TRANCE-RANKL-TRAF6 axis. J Exp Med,2005,202(5):589-595.
[4]邓文红,刘耀中.骨生物学前言.北京:高等教育出版社,2006. 42-50.
[5]Kousteni S. Kinase mediated regulation of common transcription factors account for the bone-protective effects of sex steroid. J Clin Invest,2003,111(11):1651-1664.
[6]Mori H,Kitazawa R,Mizuki S,et al. RANK ligand,RANK and OPG expression in type Ⅱ collagen-induced arthritis mouse. Histochem Cell Biol,2002,117(3):283-292.
[7]Romas E,Sims NA,Hards DK,et al. Osteoprotegerin reduces osteoclast numbers and prevents bone erosion in collagen-induced arthritis. Am J Pathol,2002,161(4):1419-1427.
[8]Hofbauer LC,Schoppet M. Osteoprotegerin deficiency and juvenile Paget’ s disease. N Engl J Med,2002,347(20):1622-1623.
[9]Cenci S,Weitzmann MN,Roggia C,et al. Estrogen deficiency induces bone loss by enhanceing T cell production of TNF-α. J Clin Invest,2000,106(10):1229-37.
[10]Onoe Y,Miyaura C,Ito M,et al. Comparative effects of estrogen and raloxifene on B lymphopoiesis and bone loss induced by sex steroid deficiency in mice. J Bone Miner Res,2000,15(3):541-549.
[11]Kauematsu M,Sato T,Takai H,et al. Prostaglandin E2 induces expression of receptor activator of nuclear factor-kappa B ligand/osteoclastogenesis in estrogen deficiency. J Bone Miner Res,2000,15(7):1321-1329.
[12]Gortz B,Hayer S,Redlich K,et al. Arthritis induces lymphocytic bone marrow inflammation and endosteal bone formation. J Bone Miner Res,2004,19(6):990-998.
[13]Roggia C. Up-regulation of TNF-producing T cell in the bone marrow:a key mechanism by which estrogen deficiency induce bone loss in vivo. Proc Natl Acad Sci USA,2001,98(24):13960-13965.
[14]Cenei S. Estrogen deficiency induces bone loss by enhancing T cell production of TNF-α. J Bone Min Res,2000,106(10):1229-1237.
[15]Cenci S. Estrogen deficiency induces bone loss by increase T cell proliferation and lifespan through INF-gamma-induced class II transactivator. Proc Natl Acad Sci USA,2003,100(18):10405-10410.
[16]Grassi F,Pacidic R. Ovariectomy increases the formation of T cell niches at the resportion surfaces. J Bone Miner Res,2005,20(8):Abs F395.
[17]HuangW,O’ Keefe RL,Schwarz EM,et al. Exposure to receptor-activator of NF kappaB ligand renders preosteoclasts resistant to INF-gamma by inducing terminal differentiation. Artbritis Res Ther,2003,5(1):R49-R59.
[18]Fournier PG,Chirgwin JM,Guise TA. Newinsights into the role of T cells in the vicious cycle of bone metastases.Curr Opin Rheumatol,2006,18(4):396-404
[19]Gao Y,Qian WP,Dark K,et al. Estrogen prevent bone loss through transformation growth factor β signaling in T cells. Pro Natl Acad Sci USA,2004,100(4):10405-10410.
[20]Toraldo G,Roggia C,Qian WP,et al. IL-7 induce bone loss in vivo byinduction of receptor activator of nuclear factor kappa B ligand and tumor necrosis factor alpha from T cells. Pro Natl Acad Sci USA,2003,100(1):125-130.
[21]Weitamann MN,Roggia C,Toraldo G,et al. Increased production of IL-7 uncouples bone formation from bone resorp tion during estrogen deficiency. J Clin Invest,2002,110(11):1643-1650.
[22]Ferrari SL,Ahn-LuongL,Garnero P,et al. Two promoter polymorphisms regulating interleukin-6 gene expression are associated with circulating levels of C-reactive protein and markers of bone resorp tion in postmenopausal women. J Clin Endocrinol Metab,2003,88(1):255-9.
[23]Kitaura H,Tatamiya M,Nagata N,et al. IL-18 induces apop tosis of adherent bone marrow cells in TNF-alpha mediated osteoclast formation in synergy with IL-12. Immunol Lett,2006,107(1):22-31.
[24]Takayanagi H,Ogasswara K,Hida S,et al. T-cellmediated regulation of osteoclastogenesis by signaling cross-talk between RANKL and INF-γ. Nature,2000,408(6812):600-605.
[25]Horwood NJ,Elliott J,Martin TJ,et al. IL-12 alone and in synergy with IL-18 inhibits osteoclast formation in vitro. J Immunol,2001,166(8):4915-4921.
[26]杨锡让,傅浩坚.运动生理学进展—置疑与思考.北京:北京体育大学出版社,2000. 247.
[27]Edwards AJ,Bacon TH,Elms CA,et al. Changes in the populations of lymphoid cells in human peripheral blood following physical exercise. Clin Exp Immunol.1984,58(2):420-4207.
[28]Goronzy JJ,Weyand CM. T cell development and receptor diversity during aging .Curr Opin Immunol,2005,17(5):468-475.
[29]周丽丽,王启荣,伊木清,等. 中药多糖对耐力训练大鼠外周血T淋巴细胞亚群及活化T细胞数量的影响.西安体育学院学报,2006,23(4):63-67.
[30]蔡国梁,张芃,张化玉. 不同负荷运动对雄性大鼠T淋巴细胞活性及其有关因素影响的实验研究.山东体育学院学报,2007,23(4):60-62.
[31]陈扬,艾冬生.急性运动与特异性免疫.中国临床康复,2003,7(9):1466-1467.
[32]Woods JA,Davis JM,Smith JA,et al. Exercise and cellular innate immune function. Med Sci Sports Exerc,1999,31(1):57-66.
[33]Ceddia MA,Woods JA. Exercise suppresses macrophage antigen presentation. J Appl Physiol,1999,87(6):2253-2258.
[34]矫玮. 剧烈运动对机体免疫功能的影响以及检测与调节方法的研究. 北京:北京体育大学出版,2003. 67-81.
[35]Suzuki K,Nakaji S,Yamada M,et al. Impact of a competitive marathon race on systemic cytokine and neutrophil responses.Med Sci Sports Exere,2003,35(2):347-355.
[36]Chan MH,Carey AL,Watt MJ,et a1. cytokine gene expression in human skeletal muscle during concentric contraction:evidence that IL-8,like IL-6,is influenced by glycogen availability. Am J Physiol Regul Integr Comp Physiol,2004,287(2):322-7.
[37]崔建华,张西洲,何富文,等. 进驻高原健康青年血清白细胞介素- 2 的活性变化. 西藏医药杂志,2000,21(3):5-6.
[38]朱海宏,吴洪福,耿排力. 高原低氧下IL-1β,IL-6含量变化及其意义初探. 青海医学院学报,2004,25(2):94-95.
[39]Pyne DV,McDonald WA,Morton DS . Inhibition of interferon,cytokine,and lymphocyte proliferative responses in elite swimmers with altitude exposure. J Interferon Cytokine Res,2000,20(4):411-418.
[40]王恬,陈佩杰,高炳宏. 低氧训练对女子赛艇运动员外周血白细胞γ- 干扰素、白细胞介素- 4、穿孔素基因表达的影响. 中国运动医学杂志,2006,25(2):196-199.
[41]Quinn JM,Saleh H. Modulation of osteoclast function in bone by the immune system. Mol Cell Endocrinol,2009,310(1-2):40-51.
[42]张京鲁,盖凌,刘淑敏,等. 女子足球运动员与无运动训练女大学生腰椎、股骨颈骨密度比较. 中国运动医学杂志,2010,29(2):167-169.
[43]罗冬林,邹亮畴,范毅方,等. 排球运动对男性青年骨量与身体成分的影响. 广州体育学院学报,2009,29(6):72-74.
[44]高丽,郑陆,李晓霞,等. 运动性动情周期抑制雌性大鼠骨变化的实验研究. 武汉体育学院学报,2005,39(11):58-62.
[45]Nichols JF,Rauh MJ,Barrack MT,et al. Bone mineral density in female high school athletes:Interactions of menstrual function and type of mechanical loading.Bone,2007,(41):371-377.
[46]Suzuki K,Peake J,Nosaka K,et al. Changes in markers of muscle damage,inflammation and HSP70 after an Ironman Triathlon race. Eur J Appl Physiol,2006,98(6):525-534.
[47]Paulsen G,Benestad HB,Strøm-Gundersen I,et al.Delayed leukocytosis and cytokine response to high-force eccentric exercise. Med Sci Sports Exerc,2005,37(11):1877-1883.
[48]Czarkowska-Paczek B,Bartlomiejczyk I,Przybylski J.The serum levels of growth factors:PDGF,TGF-beta and VEGF are increased after strenuous physical exercise.J Physiol Pharmacol,2006,57(2):189-197.
[49]Moldoveanu AI,Shephard RJ,Shek PN. Exercise elevates plasma levels but not gene expression of IL-1beta,IL-6,and TNF-alpha in blood mononuclear cells. J Appl Physiol,2000,89(4):1499-1504.
[50]Gokhale R,Chandrashekara S and Vasanthakumar KC.Cytokine response to strenuous exercise in athletes and non-athletes-an adaptive response. Cytokine,2007,40(2):123-127.
[51]Ziegler S,Niessner A,Richter B,et al. Endurance running acutely raises plasma osteoprotegerin and lowers plasma receptor activator of nuclear factor κB ligand.Metabolism,2005,54(7):935-938.
[52]Kerschan-Schindl K,Thalmann M,Sodeck GH. A 246-km continuous running race causes significant changes in bone metabolism. Bone,2009,45(6):1079-1083.
[53]KobayashiY,Hashimoto F,Miyamoto H,et al. Forceinduced osteoclast apoptosis in vivo is accompanied by elevation in transforming growth factor beta and osteoprotegerin expression. Bone Miner Res,2000,15(10):1924-1934.

