依达拉奉对硝普钠诱导PC12细胞氧化应激的保护作用
吉海杰,周 蕾,陈乃宏
(1.中国医学科学院·北京协和医学院药物研究所,北京 100050;2.山西省中医药研究院,山西 太原 030012;3.中国药科大学,江苏南京 210009)
卒中(stroke)是一种突发性的以脑血液循环障碍为特征的中枢神经系统疾病,严重危害到人类的健康。由于缺血大脑组织氧/能量代谢不足,最终导致神经元死亡引起行为功能的丧失或认知缺陷。1970年Paniker等[1]提出氧化应激的概念,指生物体内自由基的产生与清除失衡,导致其蓄积而引起的氧化损伤过程。生物体内自由基包括氧自由基如超氧阴离子、羟自由基、单线态氧、过氧化氢和氮自由基如一氧化氮(NO)和亚硝基阴离子。正常情况下,自由基产生和清除保持平衡,但在缺血等病理条件下过量NO与超氧阴离子生成亚硝基阴离子,攻击DNA、RNA和蛋白质,引起基因突变、酶活性丧失以及细胞代谢紊乱,最终导致细胞死亡和解体[2],产生氧化应激损伤。
依达拉奉(edaravone,EDA,化学结构见Fig 1)是由日本开发并于2001年在日本上市,实验室和和临床研究表明EDA在急性脑梗死的治疗中具有良好的神经保护作用[3-5]。依达拉奉作为一种新型自由基清除剂对氧自由基[6-7]和氮自由基[8]均具有清除作用,本研究以硝普钠(sodium nitroprusside,SNP)在水溶液中产生NO从而诱导PC12细胞氧化应激损伤,观察依达拉奉对PC12细胞的保护作用并对其机制进行初步研究。
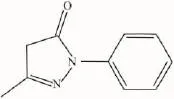
Fig 1 Chemical structure of edaravone
1 材料与方法
1.1药物与试剂依达拉奉,购自中国食品药品检定研究院,二甲基亚砜(DMSO)溶解配制成0.1 mol·L-1的储备液,实验时用培养基稀释至相应浓度。硝普钠、MTT购于Sigma公司;Annexin V-FITC/PI试剂盒,购于碧云天生物技术有限公司;DMEM培养基、马血清及胎牛血清均购自美国Invitrogen公司;β-actin、Bax、Bcl-2 多克隆抗体为 Santa Cruz公司产品;其余试剂为国产分析纯。
1.2细胞株PC12细胞由中国医学科学院基础所细胞中心提供,培养于含5%胎牛血清和5%马血清的DMEM培养基中,常规传代培养。
1.3实验仪器倒置显微镜(Nikon,日本),流式细胞仪(BD,美国),凝胶成像仪(Fuji,日本)。
1.4细胞模型建立及药物处理待PC12细胞在培养瓶中培养至铺满单层后,轻轻吹打形成单细胞悬液,倒置显微镜下计数,用培养液调整细胞密度为108·L-1。将细胞接种在96孔板中,每孔100 μl。24 h后加入含不同浓度硝普钠培养基,终浓度在300~800 μmol·L-1之间,共设6个浓度组。对照组加入DMEM完全培养液。37℃,5%CO2条件下培养24 h后MTT法测定细胞活力。
选择细胞活力降低为正常值的50%~60%的硝普钠浓度为后续造模条件。将细胞接种24 h后,造模同时加入25~125 μmol·L-1浓度的依达拉奉,共设5个浓度组。对照组加入DMEM完全培养液。
1.5MTT法检测细胞存活率药物处理24 h后,每孔加入5 g·L-1MTT 溶液10 μl,37℃孵育4 h 充分反应生成甲臜,然后每孔加入三联液100 μl,37℃孵育过夜充分溶解甲臜。测定570 nm吸光度(A),根据公式计算细胞存活率(%):

1.6流式细胞术测定细胞凋亡细胞处理同前。去除细胞培养液,胰酶消化、收集细胞,PBS洗细胞3次,用PBS重悬细胞并调节细胞密度为109·L-1,按Annexin V-FITC/PI试剂盒说明书操作,然后在流式细胞仪上检测。每组3个样本,计数10 000个细胞,检测结果使用Win MDI 2.8软件分析。
1.7Western blot测定Bax与Bcl-2蛋白变化细胞处理同前。刮取细胞于3 000 r·min-1离心5 min,去上清,加入 100 μl细胞裂解液(50 mmol·L-1Tris-HCl,150 mmol·L-1NaCl,1%NP-40,1 mmol·L-1PMSF,50 mg·L-1Leupeptin,1 mg·L-1pepstatin A,20 mg·L-1aprotinin,1 mmol·L-1EDTA,1 mmol·L-1NaVO3,50 mmol·L-1NaF,20 mmol·L-1pH 8.0),提取总蛋白,BCA法测定样品总蛋白含量。每组取总蛋白20 μg上样,于15%SDS-PAGE电泳分离,电泳完毕转移至PVDF膜上,3%BSA室温封闭2 h,加入Bax(1∶1 000)或Bcl-2(1∶500)或 β-actin(1∶1 000)于4℃孵育过夜,TBST洗5 min,3次,加HRP标记羊抗兔或抗小鼠IgG(1∶5 000)室温孵育2 h,TBST洗5 min,3次,ECL显色,LAS-3000型化学发光成像系统采集图像。
1.8数据统计数据以±s表示,用SPSS11.0统计软件包进行统计,组间均数比较采用单因素方差分析。
2 结果
2.1依达拉奉对硝普钠诱导PC12细胞存活率的影响本实验采用梯度浓度硝普钠与PC12细胞共孵育24 h,Fig 2A所示细胞活力随着硝普钠浓度的递增而降低,本实验选定硝普钠500 μmol·L-1为造模条件进行后续研究。
细胞接种24 h后除空白组外其余均加入500 μmol·L-1硝普钠,同时除模型组外其余加入不同浓度(25~125 μmol·L-1)依达拉奉,如 Fig 2B 所示依达拉奉能浓度依赖性增加PC12细胞的存活率,在浓度 75 μmol·L-1时达到峰值。
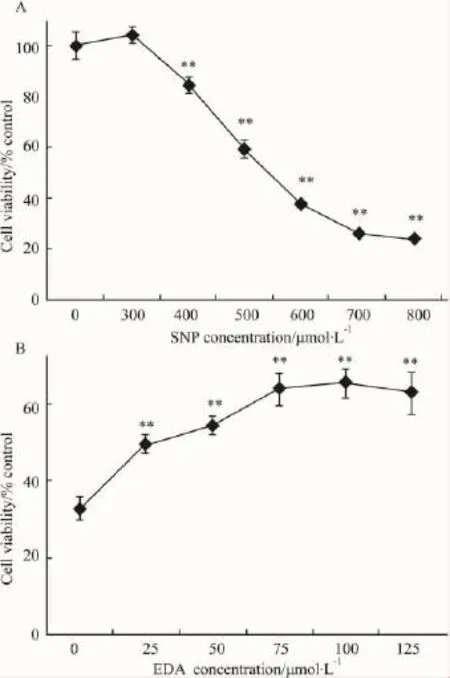
Fig 2 (A)Concentration-effect curve of sodium nitroprusside(SNP)on PC12 cells for 24 h(n=6).**P<0.01 vs normal(SNP=0).(B)Effects of edaravone(EDA)on PC12 cells viability injured by SNP(500 μmol·L -1)exposured for 24 h(n=6). **P<0.01 vs model(EDA=0).
2.2细胞形态学的观察如Fig 3所示,倒置显微镜下观察正常PC12细胞贴壁、饱满并呈多角形;而硝普钠损伤后细胞变圆,细胞碎片增多。依达拉奉25 μmol·L-1和 75 μmol·L-1能明显增加存活细胞数目,形态学表明依达拉奉对硝普钠诱导的PC12细胞损伤具有保护作用。
2.3依达拉奉对氧化应激PC12细胞凋亡的影响
流式直方图中左下方表示正常活细胞(Annexin V-和PI-),右下方表示早期凋亡细胞(Annexin V+和PI-),右上方表示坏死和凋亡晚期细胞(Annexin V+和PI+)。如Fig 4所示,硝普钠处理PC12细胞24 h后早期凋亡是细胞损伤的主要形式,由空白组的4.7%升高到模型组的57.2%,依达拉奉25 μmol·L-1和75 μmol·L-1给药组分别减少至42.4%和26.4%,表明依达拉奉对硝普钠诱导的PC12细胞凋亡有保护作用。
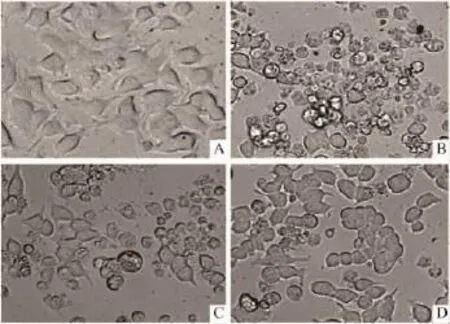
Fig 3 Morphological analysis of PC12 cells by phase-contrast microscopy.

Fig 4 Protective effects of edaravone on PC12 cells apoptosis induced by sodium nitroprusside(500 μmol·L -1,24 h).
2.4依达拉奉对Bax与Bcl-2表达变化的影响如Fig 5所示,细胞经500 μmol·L-1硝普钠处理后与空白对照组比较,胞质Bax表达明显升高,Bcl-2表达明显减少,从而使Bax/Bcl-2比值升高,表明细胞凋亡水平上升。与模型组相比,依达拉奉25 μmol·L-1给药组Bax表达无明显变化,Bcl-2表达略有升高,而75 μmol·L-1给药组Bax表达明显下降,Bcl-2表达明显升高,表明细胞凋亡水平下降。

Fig 5 Effects of edaravone(EDA)on Bax and Bcl-2 expression in PC12 cells exposured to sodium nitroprusside(SNP,500 μmol·L -1)for 24 h.
3 讨论
研究发现氧化应激在神经损伤机制研究中占有重要地位[9]。生理水平的NO是胞内信使分子,其产生和消除处于平衡状态,而在脑缺血情况下,NO在脑部堆积对神经细胞产生毒性损伤[10-11]。研究表明依达拉奉通过清除羟自由基及过氧亚硝酸盐等自由基达到抑制脂质过氧化的作用[12],同时依达拉奉能降低诱导型NOS的表达从而减少氧化应激反应[13]。硝普钠作为NO供体广泛用于模拟脑缺血NO对神经细胞损伤的体外研究,本实验以硝普钠诱导PC12细胞氧化应激损伤,观察依达拉奉的神经保护作用。
本实验利用MTT法测定线粒体酶的活力间接反映细胞活力。结果表明浓度超过400 μmol·L-1的硝普钠与PC12细胞孵育24 h能明显抑制MTT代谢率,说明硝普钠释放NO对细胞线粒体功能造成障碍;依达拉奉能浓度依赖性改善MTT代谢率,在75 μmol·L-1达到峰值,表明依达拉奉对硝普钠释放NO造成的线粒体损伤具有保护作用。形态学观察表明500 μmol·L-1硝普钠与PC12细胞孵育24h细胞变圆、碎片增多,表明细胞发生损伤;依达拉奉 25 μmol·L-1和 75 μmol·L-1组细胞碎片明显减少,表明依达拉奉能增加存活细胞数目。在细胞凋亡研究中,Annexin V/PI双染法检测细胞凋亡是较为常用、公认的凋亡检测方法,可区分早期凋亡和晚期凋亡。硝普钠处理PC12细胞24 h后早期凋亡是细胞损伤的主要形式,依达拉奉75 μmol·L-1组能减少早期凋亡细胞数目。
细胞的凋亡与抗凋亡之间存在一种精细的平衡,一旦这种平衡被打破,则可启动细胞的凋亡程序,任何外界因素只要能激活凋亡启动分子或降低凋亡启动阈值均可促使细胞凋亡的发生[14]。自由基可通过线粒体依赖途径导致细胞凋亡。Bcl-2为抗凋亡蛋白,定位于线粒体上,其功能是维持线粒体膜的完整性,控制着线粒体通透性转换孔,其与凋亡蛋白Bax形成Bcl-2/Bax异二聚体使细胞免于凋亡,而Bax/Bax同二聚体则使细胞易于凋亡,因此Bcl-2/Bax的比值决定细胞对诱导凋亡信号的敏感性。实验结果表明,硝普钠诱导PC12细胞Bcl-2表达下降,Bax表达上升,从而降低Bcl-2/Bax的比值;依达拉奉75 μmol·L-1给药组与模型组比较Bcl-2表达上调,Bax表达下调,从而升高Bcl-2/Bax的比值,表明依达拉奉能抑制硝普钠引起的细胞凋亡。
本实验从细胞水平研究依达拉奉对硝普钠诱导的氧化应激损伤的保护作用,结果表明依达拉奉能明显增加硝普钠处理PC12细胞活力,改善细胞形态,减少凋亡细胞比例,这可能与依达拉奉清除硝普钠释放NO,从而减少氧化应激有关。
[1]Paniker N V,Srivastava S K,Beutler E.Glutathuone metabolism of the cells:Effect of glutathione reductase deficiency on the stimulation of hexose monophosphate shunt under oxidative stress[J].Biochem Biophys Acta,1970,215(3):456-60.
[2]Halliwell B.Oxidants and human disease:some new concepts[J].AFSEB J,1987,1:358-64.
[3]Abe K,Yuki S,Kogure K.Strong attenuation of ischemic and postischemic brain edema in rats by a novel free radical scavenger[J].Stroke,1988,19:480-5.
[4]Eiichi O.Effect of a novel free radical scavenger edaravone(MCI-186)on acute brain infarction[J].Cerebrovasc Dis,2003,15(3):222.
[5]Chen XW,Ashfaq S.Neuroprotective effects of free radical scavengers in stroke[J].Drugs Aging,2007,24(7):537-46.
[6]Watanabe T,Yuki S,Egawa M,et al.Protective effects of MCI-186 on cerebral ischemia:Possible involvement of free radical scavenging and antioxidant actions[J].J Pharmacol Exp Ther,1994,268:1597-604.
[7]Yamamoto T,Yuki S,Watanabe T,et al.Delayed neuronal death prevented by inhibition of increased hydroxyl radical formation in a transient cerebral ischemia[J].Brain Res,1997,762:240-2.
[8]Kozue S,Yukio I,Seiji S,et al.Edaravone scavenges nitric oxide[J].Redox Report,2002,7(4):219.
[9]Moro M A,Almeida A,Bolaños J P,et al.Mitochondrial respiratory chain and free radical generation in stroke[J].Free Radic Biol Med,2005,39(10):1291-304.
[10]Rodrigo J,Fernández A P,Serrano J,et al.The role of free radicals in cerebral hypoxia and ischemia[J].Free Radic Biol Med,2005,39(1):26-50
[11]Lim W B,Kim J H,Gook E B,et al.Inhibition of mitochondriadependent apoptosis by 635nm irradiation in sodium nitroprussidetreated SH-SY5Y cells[J].Free Radic Biol Med,2009,47(6):850-7.
[12]Kawasaki T,Ishihara K,Ago Y,et al.Edaravone(3-methyl-1-phenyl-2-pyrazolin-5-one),a radical scavenger,prevents 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine-induced neurotoxicity in the substantia nigra but not the striatum[J].J Pharmacol Exp Ther,2007,322(1):274-81.
[13]Yoshida H,Kwon AH,Kaibori M,et al.Edaravone prevents iNOS expression by inhibiting its promoter transactivation and mRNA stability in cytokine-stimulated hepatocytes[J].Nitric Oxide,2008,18:105-12.
[14]Wan J,Wang J,Cheng H,et al.Proteomic analysis of apoptosis initiation induced by all transretinoic acid in human acute promyelocytic leukemia cells[J].Electrophoresis,2001,22(14):3026-37

