丹参酮ⅡA对低分化鼻咽癌细胞氯通道的激活作用
李 媛,刘善文,李华荣,马文波,潘廷才,朱林燕,叶文才,王立伟,陈丽新
(暨南大学1.医学院药理学系、2.医学院生理学系、3.药学院,广东广州 510632)
丹参是临床常用中药,广泛应用于治疗心血管疾病,具有扩张血管、降压、抗血栓的功能,对治疗冠心病、心绞痛、心律过速有明显疗效[1]。丹参酮ⅡA(TanⅡA)是丹参的主要提取物之一。近年来,人们发现丹参酮ⅡA对多种肿瘤细胞具有抑制增殖,促进凋亡,诱导分化的作用[2]。我们前期的研究表明[3-4],氯通道在细胞增殖、细胞周期中发挥重要作用,与顺铂诱导的低分化鼻咽癌细胞凋亡相关。本实验拟采用全细胞膜片钳技术直接观察丹参酮ⅡA对低分化鼻咽癌细胞氯离子通道的激活作用,并分析丹参酮ⅡA诱导的电流特征,为进一步阐明丹参酮ⅡA诱导细胞凋亡的机制奠定基础。
1 材料与方法
1.1细胞培养低分化鼻咽癌细胞CNE-2Z用含10% 新生牛血清(Gibco,美国)、1 × 105U·L-1青霉素和100 mg·L-1链霉素的 RPMI 1640培养液(Gibco,美国)在 37℃、饱和湿度、5%CO2培养箱中,按常规方法传代。实验前消化细胞,将细胞悬液接种在直径22 mm的圆形玻片上,放入培养箱,待细胞贴壁1 h后进行实验。
1.2主要试剂及来源丹参酮ⅡA购自深圳美荷生物科技有限公司,用二甲基亚砜(DMSO)配制成10 mmol·L-1储存液,使用前用细胞灌流液稀释至1 nmol·L-1;氯通道阻断剂 5-nitro-2-(3-henylpropylamino)benzoic acid(NPPB),用 DMSO配制成100 mmol·L-1储存液,使用前稀释至 100 μmol·L-1。除特殊说明外,所有的试剂和药品均购于美国Sigma公司。
1.3细胞外灌流液等张灌流液渗透压为300 mOsm·L-1,含(mmol·L-1):70 NaCl、0.5 MgCl2、2 CaCl2、10 HEPES和140 D-甘露醇。高张灌流液渗透压为440 mOsm·L-1,除增加140 mmol·L-1D-甘露醇外,其它成份和浓度与等张灌流液相同。灌流液用Tris-base液调pH值至7.40,用冰点渗透压计(Osmomat030;Gonotec,Germany)检测渗透压。
1.4电极内液电极内液含(mmol·L-1):70N-methyl-D-glucamine chloride(NMDG-Cl)、1.2 MgCl2、10 HEPES、1 EGTA、140 D-甘露醇和 2 ATP,用 Trisbase调pH值至7.25,用孔径0.22 μm的无菌过滤器过滤。渗透压为300 mOsm·L-1。
1.5全细胞膜片钳记录用EPC-7膜片钳放大器(List Electronic,Germany)记录单个细胞的全细胞电流。电流和电压信号用 CED1401(Cambrige,UK)数字化(采样频率 3 kHz),实验数据用 EPC(CED,Cambridge,UK)软件分析。在电压钳制模式下,细胞被钳制在0、±40、±80 mV,每个钳制脉冲波间隔4 s,持续200 ms,不断反复循环。实验在室温(20℃ ~24℃)下进行。
贴有细胞的玻片安放在灌流槽中,全细胞记录形成后,记录稳定的背景电流,随后用丹参酮ⅡA激活氯电流,记录激活电流的潜伏期、达峰时间、电流密度等。电流达到峰值并平稳后,加入 NPPB,待电流达到最小值并平稳后终止记录。计算NPPB对丹参酮ⅡA激活电流的抑制率。抑制率的计算公式为:抑制率/% =〔(CTan-CIso)-(CBlockers-CIso)〕/(CTan-CIso)×100%,其中CIso是等张条件下的电流值,CTan是丹参酮ⅡA激活的电流最大值,CBlockers是加入阻断剂后的最大效应时的电流值。
在观察丹参酮ⅡA激活氯通道的容积敏感性实验中,当丹参酮ⅡA激活细胞电流达到峰值并稳定后,换为含相同浓度丹参酮 ⅡA的高渗灌流液,观察渗透性细胞容积缩小对丹参酮ⅡA激活氯电流的影响。
1.6统计学处理所有数据经SPSS 13.0软件进行统计分析,用方差分析(Anova)进行显著性检验,数据用±s表示,每次实验均重复3次以上。
2 结果
2.1丹参酮ⅡA激活CNE-2Z细胞氯通道如Fig 1A所示,细胞背景电流较小而且稳定。在-80 mV电压钳制下,氯离子从细胞内流向细胞外,形成内向电流,平均电流密度为(-5.6±0.9)pA/pF;在+80 mV电压钳制下,氯离子从细胞外流向细胞内,形成外向电流,平均电流密度为(4.8±0.6)pA/pF。随后用含有1 nmol·L-1丹参酮ⅡA的等张灌流液连续灌流时,可激活一个电流,激活潜伏期为(67.9±18.2)s,随药物作用时间延长,电流逐渐增大,约(1051.5±215.3)s达到峰值进入平稳期。如Fig 1B所示,在±120 mV电压持续 300 ms钳制条件下,该电流没有明显电压依从性失活和时间依从性失活。Fig 1C显示了丹参酮ⅡA激活电流的全程图。在 -80 mV电压钳制下,内向电流峰值的电流密度为(-54.2±13.7)pA/pF,+80 mV电压钳制下外向电流的电流密度为(71.0±16.1)pA/pF,外向电流较之内向电流大,表现了较明显外向优势(n=8,P=0.010),该电流的翻转电位为(-5.9±0.2)mV(n=8),见 Fig 1D。
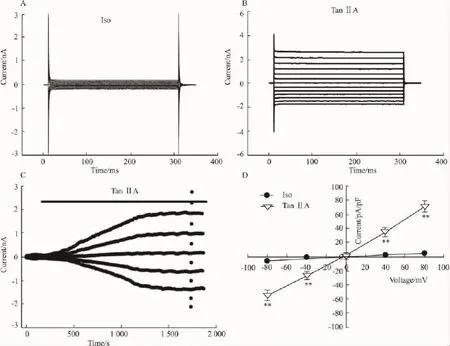
Fig 1 TanshinoneⅡA-induced whole-cell currents in CNE-2Z cells
2.2高张液对丹参酮ⅡA激活氯电流的抑制作用在细胞外灌流含1 nmol·L-1丹参酮ⅡA的等张灌流液,激活电流并达到峰值稳定3min后,换用含相同浓度的丹参酮ⅡA的高张液(Hyper)灌流,如Fig 2所示,440 mOsm·L-1高张灌流液可以迅速完全抑制丹参酮ⅡA激活的氯电流。Fig 2A和2B分别显示了丹参酮ⅡA激活的氯电流和高张液的抑制作用的瞬时图,Fig 2C显示了高张液抑制作用的全过程。在-80 mV电压钳制下,高张液使丹参酮ⅡA激活的内向电流从(-54.2±13.7)pA/pF下降到(-7.1±2.3)pA/pF,抑制率为(97.0±3.2)%(n=5,P=0.005),+80 mV 电压钳制下,外向电流从(71.0±16.1)pA/pF下降到(7.2±3.5)pA/pF,抑制率为(96.5±4.2)%(P=0.004)。高张液对内外向电流的抑制率差异没有显著性(P=0.618),见Fig 2D。丹参酮ⅡA激活的氯电流被高张液抑制,表明该电流具有容积敏感性。
2.3氯通道阻断剂对丹参酮ⅡA激活氯电流的抑制作用NPPB是常用的氯通道阻断剂,本实验观察了NPPB对丹参酮ⅡA激活氯电流的影响。Fig 3A和3B分别 显示了100 μmol·L-1NPPB抑制丹参酮ⅡA激活的电流的瞬时图和全过程。电压钳制在 ±80 mV时,等张灌流液组(Iso)、丹参酮ⅡA组(TanⅡA)、丹参酮ⅡA+氯通道阻断剂组(TanⅡA+NPPB)组的电流密度见Fig 3C。结果表明,NPPB可抑制丹参酮ⅡA激活的氯电流,-80 mV电压钳制下,内向电流从(-54.2±13.7)pA/pF下降到(-14.1±4.3)pA/pF,抑制率为(75.8±11.3)%(n=5,P=0.031),+80 mV电压钳制下,外向电流从(71.0±16.1)pA/pF下降到(21.1±7.9)pA/pF,抑制率为(76.8±10.3)%(P=0.017),NPPB对内外向电流的抑制率差异没有显著性(P=0.668)。

Fig 2 Inhibition of tanshinoneⅡA-induced chloride currents by hypertonic solutions
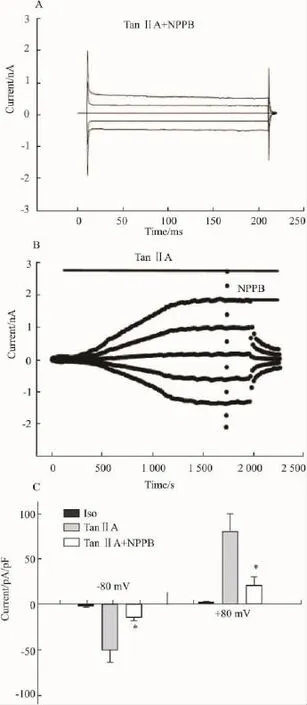
Fig 3 Inhibition of tanshinoneⅡA-induced chloride currents by chloride channel blocker NPPB
3 讨论
近年研究发现丹参酮ⅡA可通过降低VEGF[5]、突变型 p53 蛋白和 Bcl-2 蛋白的表达[6],上调 Fas、Caspase-3 mRNA[7],抑制原癌基因 cmyc[8]和 BCRP/ABCG2 基因[9]的表达等发挥抗癌作用。
研究表明,氯通道与细胞容积调节[10-11]、细胞增殖和周期[3]、细胞迁移[12]及细胞凋亡[3,13-14]密切相关。我们前期的研究表明,氯通道参与凋亡性细胞容积减小,凋亡诱导剂顺铂和过氧化氢在短时间内激活氯通道,引起细胞内氯离子和钾离子的外流,同时伴随水的外流而导致细胞容积减小,诱导鼻咽癌细胞凋亡,NPPB抑制顺铂和过氧化氢诱导的凋亡,提示氯通道参与了凋亡的发生[4,13]。丹参酮ⅡA诱导凋亡的作用是否与氯通道相关,鲜见文献报道。
本研究用膜片钳方法,直接观察丹参酮ⅡA对氯离子通道的激活作用,实验结果表明,细胞外灌流低浓度丹参酮ⅡA可激活一个具有明显外向优势的电流,该电流在不同钳制电压下其电流方向和 Cl-运动方向一致,电流的翻转电位接近于 Cl-的平衡电位(-0.9 mV),推测该电流为氯电流。进一步实验证实,氯通道阻断剂NPPB可抑制该电流,因此这是一个由氯通道介导的氯电流,本结果为丹参酮ⅡA激活氯通道提供了直接的实验证据,提示丹参酮ⅡA可能通过某些信号转导途径,激活细胞膜氯离子通道,诱发细胞凋亡性容积减小,诱导细胞凋亡而发挥其抗癌作用。
丹参酮ⅡA激活的氯电流具有明显的外向优势,无明显的时间依从性失活和电压依从性失活,可以被高张灌流液完全抑制,被NPPB抑制,且对内外向电流抑制作用差异无显著性,这些特征与我们以前报道的鼻咽癌细胞容积敏感性氯通道[3]的特征相似,但容积敏感性氯通道是在细胞外低张环境或细胞内高张环境引起细胞肿胀时而激活,而本实验中,氯通道是在等张环境、非细胞肿胀条件下而被丹参酮ⅡA激活,即激活氯通道的条件不同,提示这两种通道的激活途径不一样。综上所述,丹参酮ⅡA可以激活低分化鼻咽癌细胞氯通道,但其具体的激活途径,以及激活氯通道后对细胞功能的影响等有待探讨。
[1]高 艳.丹参的药理作用[J].中国实用医药,2009,4(14):168-9.
[1]Gao Y.Pharmacological action of Salvia Miltiorrhiza[J].China Pract Med,2009,4(14):168-9.
[2]孙兆卿,王寿福.丹参酮ⅡA抗肿瘤作用研究进展[J].云南中医中药杂志,2010,31(7):70-2.
[2]Sun Z Q,Wang S F.Research advance in anti-tumor function of tanshioneⅡA[J].Yunnan J Tradit Chin Med Mat Med,2010,31(7):70-2.
[3]Chen L X,Zhu L Y,Tacob T J,et al.Roles of volume-activated Cl-currents and regulatory volume decrease in the cell cycle and proliferation in nasopharyngeal carcinoma cells[J].Cell Proliferation,2007,40(2):253-67.
[4]范爱辉,王立伟,毛建文,等.氯通道在顺铂诱导的鼻咽癌细胞凋亡性容积减小中的作用[J].山东医药,2007,47(19):40-2.
[4]Fan A H,Wang L W,Mao J W,et al.Role of chloride channels in apoptotic volume decrease of nasopharyngeal carcinoma cells induced by cDDP[J].Shandong Med J,2007,47(19):40-2.
[5]文道林,田 峰,吴少卿.丹参酮ⅡA对缺氧诱导下鼻咽癌CNE-2细胞增殖、VEGF表达及NO分泌水平的影响[J].中国现代医药杂志,2010,7(12):749-52.
[5]Wen D L,Tian F,Wu S Q.Influence of tanshioneⅡAon proliferation and expression of VEGF and secretion of NO of CNE-2 cells under hypoxia[J].Mod Med J Chin,2010,7(12):749-52.
[6]张 欣,张蒲蓉,陈 洁,等.丹参酮ⅡA对乳腺癌抑制作用的体内实验研究[J].四川大学学报(医学版),2010,41(1):62-7.
[6]Zhang X,Zhang P R,Chen J,et al.A study on the effect of tanshinoneⅡA against human breast cancerin vivo[J].J Sichuan Univ(Med Sci Ed),2010,41(1):62-7.
[7]王 炎,李 琦,范忠泽,等.丹参酮ⅡA介导p38MAPK信号转导诱导人肝癌细胞凋亡[J].世界华人消化杂志,2009,17(2):124-9.
[7]Wang Y,Li Q,Fan Z Z,et al.TanshinoneⅡA induces apoptosis of liver cancer cells via p38MAPK signal transduction[J].World Chin J Digestol,2009 ,17(2):124-9.
[8]邓 惠,罗焕敏,黄 丰,等.丹参酮ⅡA对C6胶质瘤细胞的增殖抑制和诱导凋亡作用[J].中国病理生理杂志,2005,21(9):1791-4.
[8]Deng H,Luo H M,Huang F,et al.Inhibition of proliferation and induction of apoptosis by tanshinoneⅡA in C6 cells[J].Chin J Pathophysiol,2005,21(91):1791-4.
[9]敬 静,郑 鸿,王 静,等.丹参酮ⅡA对人ER阴性乳腺癌细胞的生长抑制和多耐药逆转作用[J].四川大学学报(医学版),2007,38(3):391-5.
[9]Jing J,Zheng H,Wang J,et al.Growth inhibition and multidrug resistance-reversing effect of tanshinoneⅡA on human breast cancer cell with estrogen receptor negative[J].J Sichuan Univ(Med Sci Ed),2007,38(3):391-5.
[10]Okada Y,Maeno E,Shimizu T,et al.Receptor-mediated control of regulatory volume decrease(RVD)and apoptotic volume decrease(AVD)[J].J Physiol,2001,532(1):3-16.
[11]陈丽新,王立伟,朱林燕,等.Cl-在鼻咽癌细胞调节性容积回缩中的作用[J].中国病理生理杂志,2002,18(5):490-3.
[11]Chen L X,Wang L W,Zhu L Y,et al.Role of Cl-in regulatory volume decrease of nasopharyngeal carcinoma cells[J].Chin J Pathophysiol,2002,18(5):490-3.
[12]Mao J M,Wang L W,Fan A H,et al.Blockage of volume-activated chloride channels inhibits migration of nasopharyngeal carcinoma cells[J].Cell Physiol Biochem,2007,19(5-6):249-58.
[13]Zuo W H,Zhu L Y,Bai Z Q,et al.Chloride channels involve in hydrogen peroxide-induced apoptosis of PC12 cells[J].Biochem Biophys Res Commun,2009,387(4):666-70.
[14]常全忠,张淑玲,尹金宝,等.氯通道阻断剂对NO诱导离体大鼠海马神经元凋亡的保护作用[J].中国药理学通报,2009,25(9):1197-200.
[14]Chang Q Z,Zhang S L,Yin J B,et al.The protective effects of chloride channel blockers on the cultured hippocampal neuronal apoptosis induced by NO in rats[J].Chin Pharmacol Bull,2009,25(9):1197-200.

