舒尼替尼对EGFR TKI抵抗的A549细胞株增殖抑制作用及机制研究
潘 峰,田 静,张旭超,潘跃银
(1.安徽医科大学第一附属医院肿瘤科,安徽合肥 230022;2.安徽医科大学公共卫生学院流行病与卫生统计学系,安徽 合肥 230032;3.广东省肺癌研究所,广东广州 510080)
肺癌是肿瘤患者死亡的主要原因,每年大约118万人死于肺癌[1],其中非小细胞肺癌大约占总数的80%[2],大多数患者(80%)在就诊时已属中晚期,5年生存率仅约15%。目前药物治疗是晚期非小细胞肺癌治疗的重要手段之一,但总的治疗效果并不令人满意[3]。
肺癌的靶向治疗是当前研究的热点,EGFR TKI如吉非替尼和厄洛替尼已经被批准用于肺癌的二线治疗。对EGFR激活突变患者能够从治疗中明显获益[4-5],然而非小细胞肺癌中EGFR突变的发生率仅为10% ~30%[6],同时 K-ras突变和 EGFR突变相互排斥,含有K-ras突变和EGFR野生型患者对EGFR TKI表现耐药,几乎不能从治疗中获益。Schneider等[7]研究发现 K-ras突变和生存减少有关。因此探讨如何改善EGFR TKI耐药患者的生存,寻找新的治疗药物及方案是非常必要的。
舒尼替尼(sunitinib)是一种小分子多靶点的酪氨酸酶抑制剂,当前被FDA批准作为肾癌和对伊马替尼抵抗的胃肠道间质瘤的治疗[8]。已有研究[9-11]发现sunitinib在神经内分泌肿瘤、乳腺癌等其他实体肿瘤中显示出明显的抗肿瘤效应。本研究旨在初步探讨sunitinib在EGFR TKI耐药的非小细胞肺癌A549细胞株的增殖抑制作用及其机制。
1 材料与方法
1.1实验材料人非小细胞肺癌细胞A549细胞株由广东省医学科学院(广东省肺癌研究所)提供。Sunitinib购自Pfizer公司,胎牛血清和RPIM1640购自HyClone公司,二甲基亚砜(DMSO)购自Sigma公司,噻唑蓝(MTT)购自Sigma公司,Annexin V-EGFP购自 Millipore,4',6-二脒基-2-苯基吲哚(DAPI)购自罗氏公司,Bcl-2、β-actin抗体购自CST(Cell Signal Technology)公司,酶标仪购自 BioTek Instruments(BioTek Instruments公司,美国),流式细胞仪购自BeckMan(BeckMan Coulter公司,美国)
1.2实验方法
1.2.1细胞培养A549细胞培养于含10%胎牛血清的RPIM 1640培养液(内含青霉素100 U·L-1、链霉素100 mg·L-1)、5%CO2孵箱、37℃恒温培养。用0.25%胰酶消化传代,每1~2天传代1次,取对数生长期细胞进行实验。
1.2.2细胞形态的观察取对数生长期细胞,胰酶消化后制成单细胞悬液,每孔100 μl,细胞密度为3.5 ×107个·L-1,种于 96 孔板中,恒温培养箱中培养24 h后加药分组,分别作用24、48、72 h后显微镜下观察药物作用后细胞形态等变化。
1.2.3MTT法检测sunitinib对A549细胞的增殖抑制作用取对数生长期细胞,以3.5×107个·L-1种于96孔板中,每孔100 μl。次日贴壁后,分为细胞对照组(仅含细胞和培养基而不含药物的孔)、空白对照组(仅含培养基而不含细胞的孔),和6个以2倍浓度稀释的药物组,每组6个复孔,实验中止前4 h 每孔加20 μl的5 g·L-1MTT,培养4 h 后,每孔加入150 μl DMSO,轻轻摇晃10 min,以空白对照调零,在570 nm波长用自动酶标仪测定每孔的吸光度(A)值。①细胞抑制率=1-(加药组A值-空白对照组A值)/(细胞对照组A值-空白对照组A值)×100%。②CompuSyn软件计算单药处理组在24、48、72 h的半数抑制浓度(IC50)。实验重复3次。
1.2.4Annexin V-EGFP荧光染色观察细胞凋亡取对数生长期细胞,以1×108个·L-1浓度接种于6孔板,次日细胞贴壁后加入 3.5 μmol·L-1和 7.0 μmol·L-1的sunitinib浓度作用24 h诱导细胞发生凋亡,并设立对照,作用时间结束时用PBS洗涤细胞两次,加入混匀好的试剂〔Binding Buffer、Annexin V-EGFP、碘化丙啶(PI);比例为100 ∶1 ∶1〕,均匀覆盖6孔板底面,避光、室温反应5 min。于荧光显微镜下观察,拍照,Annexin V-EGFP荧光信号为绿色,PI荧光信号为红色。
1.2.5流式细胞术检测sunitinib对A549细胞株细胞周期的影响取对数生长期的细胞,以1×108个·L-1浓度接种于6孔板中,次日贴壁后,加入3.5 μmol·L-1的sunitinib,同时设立对照组,培养细胞72 h后,吸除培养基,PBS冲洗3次,胰酶消化,悬浮液转移至离心管,离心后,去上清,加入DAPI染液,避光反应10 min后,流式细胞仪上机检测,用WM-cycle软件分析细胞周期分布。实验重复3次。
1.2.6Western blot检测Bcl-2蛋白的表达水平取对数生长期的细胞,经胰酶消化后以3×108个·L-1浓度接种入细胞培养瓶内。次日贴壁后,分别加入 1.75、3.5 和 7.0 μmol·L-1浓度的 sunitinib 作用72 h后,提取各处理组及对照组蛋白,BCA法测定蛋白浓度,将蛋白样品(50 μg/孔)加入10%浓度的SDS-聚丙烯凝胶,经电泳、转膜、5%脱脂奶粉封闭,4℃一抗(1∶1 000)孵育过夜,常温下二抗孵育1 h,然后转入暗室加ECL发光液,胶片曝光。
1.3统计学分析采用SPSS13.0软件进行统计学分析,实验数据用±s表示,代表至少3次实验,两组均数间比较采用t检验,各组的组间均数比较用方差分析。
2 结果
2.1sunitinib对A549细胞体外增殖的影响sunitinib作用A549细胞24、48、72 h后,显微镜下观察发现死亡细胞和碎片增多、细胞密度下降、细胞固缩融合。不同浓度不同时间sunitinib对A549细胞增殖抑制率的影响如(Fig 1)所示,sunitinib能够明显抑制细胞的生长,并且随着时间的延长和剂量增加,抑制作用逐渐增强,具有时间和剂量依赖性,且72 h的抑制率>90%。sunitinib对A549细胞在24 h、48 h、72 h 的 IC50分别为(7.34 ± 0.76)、(5.54± 0.62)、(3.68 ± 0.53)μmol·L-1。

Fig 1 Antiproliferative effects of sunitinib 24 h,48 h,72 h on A549 cells by MTT(±s)

Fig 2 The changes of apoptosis on A549 exposed to sunitinib by fluorescence microscope
2.2荧光显微镜观察sunitinib诱导A549细胞株凋亡sunitinib作用A549细胞24 h后,同对照组相比,处理组凋亡细胞明显增多,细胞出现核固缩、体积缩小,细胞核或细胞质内可见致密浓染的红色荧光。且随着药物浓度的增加,处于凋亡晚期细胞明显增多,结果见Fig 2。
2.3sunitinib单药对A549细胞周期的影响sunitinib作用于A549细胞72 h后,正常状态下的A549细胞大多数处于G1和S期,G2/M期最少。经sunitinib处理后,G0/G1期比例增加(P=0.012),S期细胞的比例减少(P=0.01)。结果如Fig 3A,3B所示。

Fig 3A Cell cycle analysis on A549 cells treated with sunitinib for 72 h by flow cytometry(±s)

Fig 3B The proportion of cell cycle on A549 cells treated with sunitinib for 72 h by flow cytometry
2.4不同浓度sunitinib对A549细胞Bcl-2蛋白表达的影响使用不同浓度sunitinib作用A549细胞后,如Fig 4A,B所示,同对照组相比,各个剂量组sunitinib均能够降低Bcl-2蛋白的表达水平(P<0.05),且随着药物浓度的增大,Bcl-2蛋白表达水平逐渐降低(P<0.05)。

Fig 4A Effects on the expression of Bcl-2 on A549 cells in different concentrations of sunitinib
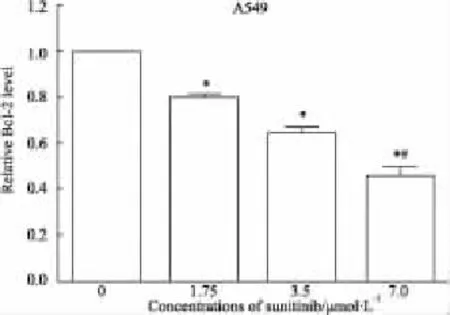
Fig 4B Relative Bcl-2 levels to control
3 讨论
吉非替尼和厄洛替尼是当前被批准用于肺癌治疗的靶向药物,但其在复发的晚期非小细胞肺癌中的有效率仅为10% ~19%[12-13]。EGFR野生型和K-ras突变的非小细胞肺癌并不能从EGFR TKI治疗中受益。肺癌发病机制复杂,肿瘤血管生成和多种信号通路的激活在其恶性进展中起着关键作用,其中血管生成影响绝大多数肿瘤的生长和转移。当抑制血管内皮生长因子(VEGF)旁路时,能够使绝大多数肿瘤临床症状明显改善[14-15]。因此多靶点治疗可能比单靶点治疗非小细胞肺癌更有效。
sunitinib是一种小分子多靶点的酪氨酸酶抑制剂,它能够抑制血管内皮生长因子受体-1/2(VEGFR-1/2),血小板源性生长因子受体(PDGFR)、集落刺激因子受体-1(CSF-1R)、干细胞生长因子受体(c-KIT)、FMS样的酪氨酸激酶3(FLT3)和胶质细胞源性神经营养因子受体(RET)[8]。临床前及临床研究均显示出sunitinib具有明显的抗肿瘤效应。Ⅰ期和Ⅱ期临床试验发现sunitinib在乳腺癌、神经内分泌肿瘤、非小细胞肺癌等肿瘤中的具有抗肿瘤效应[16-18],临床前研究也发现sunitinib能够明显抑制非小细胞肺癌移植瘤模型[19]。
本实验通过研究sunitinib作用于耐EGFR TKI非小细胞肺癌A549细胞株,发现其对细胞有增殖抑制作用,且具有时间和剂量的依赖性,同时72 h的抑制率>90%。提示sunitinib可能成为对EGFR TKI耐药的非小细胞肺癌的新的靶向治疗药物,体外实验的药物浓度可以为今后的体内研究及临床用药提供实验室依据。
同时发现sunitinib处理后的A549细胞出现细胞核固缩、细胞核染色质聚集、碎裂或溶解等细胞凋亡形态学的改变,且随着药物浓度的增大,处于晚期凋亡细胞的比例增多。表明sunitinib诱导凋亡可能是其抗增殖作用的机制之一。
通过流式细胞周期分析发现,sunitinib为细胞周期特异性阻滞药物,能够诱导细胞阻滞在G0/G1期,这一结果和Hui等[20]研究结果相一致,sunitinib可能通过阻止细胞进入细胞周期的下个时段S期,抑制细胞的生长增殖进而诱发凋亡。Bcl-2家族是当前研究最多的与细胞凋亡相关的原癌基因,它在正常和肿瘤细胞的生长过程中均起着重要作用,其表达产物Bcl-2蛋白是一种能够抑制细胞凋亡的抗凋亡蛋白,该蛋白表达上调与不良预后有着直接关联,表达下调能够增强肿瘤对凋亡的敏感性。在非小细胞肺癌中的研究发现,抑制磷酸化AKT蛋白表达,可以下调 Bcl-2 的表达[21]。Yang 等[22]研究显示sunitinib可以通过抑制STAT和PI3K/AKT等信号通路而提高凋亡,这些研究结果提示STAT、PI3K/AKT等信号通路可能参与了Bcl-2表达的调控。本实验通过Western blot分析发现,sunitinib能够下调Bcl-2的表达水平,且随着药物浓度的增加Bcl-2蛋白的表达逐渐降低,提示sunitinib诱导A549凋亡可能是通过抑制PI3K/AKT等信号通路而下调Bcl-2蛋白表达有关。
sunitinib对A549细胞具有抗增殖和诱导凋亡作用,其机制可能与诱导细胞周期阻滞和下调Bcl-2的表达有关。该项研究可以为sunitinib对耐EGFR TKI的非小细胞肺癌的治疗提供一定的理论基础。但是,sunitinib是多靶点的靶向药物,抗肿瘤机制较为复杂,仍需深入研究探讨。
(致谢:感谢吴一龙教授给本实验提供实验平台。)
[1]Jemal A,Bray F,Center M M,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2]Jemal A,Thun M J,Ries L A,et al.Annual report to the nation on the status of cancer,1975-2005,featuring trends in lung cancer,tobacco use,and tobacco control[J].Natl Cancer Inst,2008,100(23):1672-94.
[3]Curran W J,Scott C B,Langer C J,et al.Long-term benefit is observed in a phaseⅢcomparison of sequential vs concurrent chemo-radiation for patients with unresected stageⅢNSCLC:RTOG 9410[J].Proc Am Soc Clin Oncol,2003,22:621a.
[4]Pham D,Kris M G,Riely G J,et al.Use of cigarette-smoking history to estimate the likelihood of mutations in epidermal growth factor receptor gene exons 19 and 21 in lung adenocarcinomas[J].J Clin Oncol,2006,24(11):1700-4.
[5]Lynch T J,Adjei A A,Bunn P A Jr,et al.Summary statement:novel agents in the treatment of lung cancer:advances in epidermal growth factor receptor-targeted agents[J].Clin Cancer Res,2006,12(14 Pt 2):4365s-71s.
[6]Tanaka T,Matsuoka M,Sutani A,et al.Frequency of and variables associated with the EGFR mutation and its subtypes[J].Int J Cancer,2010,126(3):651-5.
[7]Schneider C P,Heigener D,Schott-von-Römer K,et al.Epidermal growth factor receptor-related tumor markers and clinical outcomes with erlotinib in non-small cell lung cancer:an analysis of patients from german centers in the TRUST study[J].J Thorac Oncol,2008,3(12):1446-53.
[8]Chow L Q,Eckhardt S G.Sunitinib:from rational design to clinical efficacy[J].J Clin Oncol,2007,25(7):884-96.
[9]Kulke M H,Lenz H J,Meropol N J,et al.Activity of Sunitinib in patients with advanced neuroendocrine tumors[J].J Clin Oncol,2008,26(20):3403-10.
[10]Burstein H J,Elias A D,Rugo H S,et al.Phase Ⅱ study of sunitinib malate,an oral multitargeted tyrosine kinase inhibitor,in patients with metastatic breast cancer previously treated with an anthracycline and a taxane[J].J Clin Oncol,2008,26(11):1810-6.
[11]Faivre S,Delbaldo C,Vera K,et al.Safety,pharmacokinetic,and antitumor activity of SU11248,a novel oral multitarget tyrosine ki-nase inhibitor,in patients with cancer[J].J Clin Oncol,2006,24(1):25-35.
[12]Kris M G,Natale R B,Herbst R S,et al.Efficacy of gefitinib,an inhibitor of the epidermal growth factor receptor tyrosine kinase,in symptomatic patients with non-small cell lung cancer:a randomized trial[J].JAMA,2003,290(16):2149-58.
[13]Fukuoka M,Yano S,Giaccone G,et al.Multi-institutional randomized phaseⅡtrial of gefitinib for previously treated patients with advanced non-small-cell lung cancer(The IDEAL 1 Trial)[corrected][J].J Clin Oncol,2003,21(12):2237-46.
[14]Hasumi Y,Klosowska-Wardega A,Furuhashi M,et al.Identification of a subset of pericytes that respond to combination therapy targeting PDGF and VEGF signaling[J].Int J Cancer,2007,121(12):2606-14.
[15]Shikada Y,Yonemitsu Y,Koga T,et al.Platelet-derived growth factor-AA is an essential and autocrine regulator of vascular endothelial growth factor expression in non-small cell lungcarcinomas[J].Cancer Res,2005,65(16):7241-8.
[16]Bajetta E,Guadalupi V,Procopio G.Activity of sunitinib in patients with advanced neuroendocrine tumors[J].J Clin Oncol,2009,27(2):319-20.
[17]Socinski M A,Novello S,Brahmer J R,et al.Multicenter,phase Ⅱtrial of sunitinib in previously treated,advanced non-small-cell lung cancer[J].J Clin Oncol,2008,26(4):650-6.
[18]Robert F,Sandler A,Schiller J H,et al.Junitinib in combination with docetaxel in patients with advanced solid tumors:a phaseⅠdose-escalation study[J].Cancer Chemother Pharmacol,2010,66(4):669-80.
[19]Mendel D B,Laird A D,Xin X,et al.In vivoantitumor activity of SU11248,a novel tyrosine kinase inhibitor targeting vascular endothelial growth factor and platelet-derived growth factor receptors:Determination of a pharmacokinetic/pharmacodynamic relationship[J].Clin Cancer Res,2003,9(1):327-37.
[20]Hui E P,Lui V W,Wong C S,et al.Preclinical evaluation of sunitinib as single agent or in combination with chemotherapy in nasopharyngeal carcinoma[J].Invest New Drugs,2010 May 15.[Epub ahead of Print].
[21]熊 飞,詹 瑧,唐于平,等.PI3K/Akt信号转导通路在非小细胞肺癌中的作用[J].中国药理学通报,2010,26(10):1264-7.
[21]Xiong F,Zhan Z,Tang Y P,et al.The effect of PI3K/Akt signal transduction pathway in non-small cell lung cancer[J].Chin Pharmacol Bull,2010,26(10):1264-7.
[22]Yang F,Jove V,Xin H,et al.Sunitinib induces apoptosis and growth arrest of medulloblastoma tumor cells by inhibiting STAT3 and AKT signaling pathways[J].Mol Cancer Res,2010,8(1):35-45.

