艾叶挥发油明胶微球的制备及其性能表征
詹国平,郝丽
(中南大学 化学化工学院,湖南 长沙,410083)
艾叶(Folium Artemisiae Argyi)为菊科植物艾(Artemisia Argyi Levl. et Vant)的干燥叶,具有散寒止痛、温经止血、抗菌抗病毒、平喘、镇咳、祛痰、消炎、抗凝血、抗过敏和护肝利胆之功效[1]。由其干燥叶片提取的挥发油即艾叶油,是其主要的药用成分之一,已鉴定出50多种有效成分[2]。临床上应用艾叶油治疗支气管哮喘、过敏性皮炎、过敏性药疹及麻风反应等有一定疗效,其中气雾给药平喘有效率为67%~90%,口服平喘有效率为75%[3]。由于艾叶油易挥发,且容易受到外界影响而改变成分,在一般制剂中性质不稳定,目前在药物研制上的常用新剂型是将艾叶油制成包合物,但会出现未包合现象,影响该药物的疗效。近年来,随着化学成分及药理研究的深入,其应用范围不断扩大[4]。因此,研究艾叶油制剂新技术,提高其稳定性有实际意义。微球制剂具有缓释、提高稳定性、掩味和靶向作用,作为抗肿瘤药物靶向制剂研究已有广泛报道[5-7]。其中明胶微球因具有生物可降解、低毒等优点,广泛应用于药物新剂型的研究[8-10]。目前,采用明胶将艾叶油制成微球制剂的研究较少。为此,本文作者采用乳化交联法将提取出的艾叶挥发油制成明胶微球制剂,通过正交试验法优化微球制备工艺,并考察其形态学及载药量、包封率等性质,以获得制备含药微球的优选工艺,更好地提高艾叶挥发油在制剂中的稳定性,从而增强药物疗效。
1 实验
1.1 试药与仪器
试药为:艾叶(药用品,山东产);明胶(分析纯,湖南湘中精细化学品厂生产);阿拉伯树胶粉(分析纯,湖南湘中精细化学品厂生产);液体石蜡(化学纯,长沙南方化学试剂厂生产);Span-80和Tween-80复合乳化剂,为药用级;甲醛、异丙醇、乙醇、乙醚、正己烷、硫酸、硫酸钠、氯化钠、香草醛等,均为分析纯。
仪器为:挥发油提取器(测定器适用于测密度小于1.0 g/cm3的挥发油,江苏省江都市红旗玻璃厂制造);RE-5210旋转蒸发仪(上海亚荣生化仪器厂制造);DF-101S集热式恒温加热磁力搅拌器(项义市英峪予华仪器厂制造);XS-18生物光学显微镜(南京江南光电仪器股份有限公司制造);756CRT紫外分光光度计(上海精密仪器科学有限公司制造);X-650扫描电镜(日本日立公司制造)。
1.2 实验方法
1.2.1 采用水蒸汽蒸馏法提取艾叶挥发油
将干燥的艾叶粉碎,称取粉末70 g置于1 L硬质圆底烧瓶中,加入700 g蒸馏水充分浸泡3 h。连接实验装置,在挥发油提取器中放入少量蒸馏水,为防止油水界面分离不清以减少损失再加入1 mL正己烷,缓缓加热至沸,并保持微沸 4~5 h,收集油层液体,读取艾叶油量。重复上述步骤,将收集的艾叶油混合,倒入分液漏斗,再加入适量乙醚,振摇静置分层,取上层液。重复萃取步骤1次,合并的乙醚层用无水硫酸钠干燥。在40~50 ℃水浴中使用旋转蒸发仪加热蒸去乙醚,得黏稠状的绿色油状液体即艾叶油,具有很强的芳香性气味,干燥后称质量,放置在阴冷处,避光密封保存,待用。
1.2.2 制备微球的影响因素
在考察单因素的基础上,固定固化时间、搅拌方式、连续相、水相体积、制备体系的pH、固化剂用量、脱水剂用量等因素,按正交试验设计法综合考察对微球的成形、外观、粒径、分布、载药量、包封率有影响的4个主要因素,如表1所示。

表1 正交试验因素水平设计Table 1 Factors and levels of orthogonal test
1.2.3 采用乳化交联法制备明胶微球
分别称取等量明胶和阿拉伯胶溶于适量水中,配成适宜浓度的明胶和阿拉伯胶溶液,在一定乳化温度下加入适量艾叶挥发油,在适宜的搅拌速度下,乳化一定时间,制得挥发油初乳。将含适量 Span-80和Tween-80复合乳化剂的液体石蜡加热到与挥发油初乳相同的温度,再把挥发油初乳缓缓倾入到液体石蜡中,在适宜的转速下乳化一定时间,制得复乳;然后,迅速放置在冰水浴中,在适宜转速下搅拌,加入适量质量分数为37%甲醛,交联固化一定时间,控温在5 ℃时加适量异丙醇,搅拌 5 min,进行脱水。将悬浮液静置1夜后,离心30 min,沉淀物用异丙醇洗涤2次,抽滤,于室温干燥,即得淡黄色粉末状艾叶挥发油明胶微球。
1.2.4 微球的表观形态学比较
用显微计数板在光学显微镜下考察制得的微球,观察形态及粘连程度并测其粒径,计算平均粒径及分布。粒径分布采用跨距表示,跨距越小,分布越窄,即粒径越均匀。
将试验所得微球均匀涂于载玻片上,在光学显微镜(物镜和目镜放大倍数均为10)下观测并统计500个微球的球径,按下式计算跨距(sP)[11]。
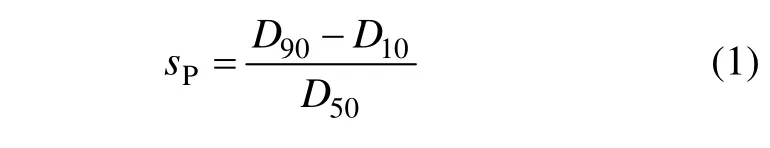
式中:D10,D50和 D90分别表示在粒径累积分布图中相应于累积频率10%,50%和90%处的粒径。对典型样品用0.9%(质量分数)生理盐水溶解,经超声分散,对制样镀金,使用扫描电镜进行观测微球形貌、粒径及分布状况。
1.2.5 微球的载药量与包封率的测定
(1) 测定波长的选择。称取艾叶油适量,用无水乙醇稀释至适当浓度,以无水乙醇为空白样,在波长200~400 nm内扫描,采用同样的方法处理空白明胶微球。配制相同药物浓度的艾叶油明胶微球溶液并进行测定。
(2) 标准曲线的建立。取干燥至恒质量的艾叶油对照品10 mL,精密称定,置于100 mL容量瓶中,加无水乙醇溶解,并稀释至刻度,摇匀作为标准储备液备用。分别精密量取储备液0.1,0.2,0.3,0.4,0.5 mL置于10 mL容量瓶中,加无水乙醇至刻度,静置10 min后加入硫酸香草醛显色剂,显色后在最大吸收波长处测定吸光度。以吸光度对浓度进行线性回归,得回归方程。
(3) 微球中药物的含量测定。采用紫外可见分光光度法,取各实验条件下制得的微球适量,精密称定,加质量分数为80%乙醇5 mL,超声20 min,经60 ℃水浴,保温3 h,取上清液于转速3 000 r/min下离心10 min。各样品精密吸取0.1 mL置于5 mL容量瓶中,硫酸香草醛显色剂定容,置温度为20~25 ℃处避光存放1 h,在最大吸收波长下测定吸光度,代入标准曲线计算微球中挥发油的含量,并按下式计算其载药量(w1)与包封率(w2)。
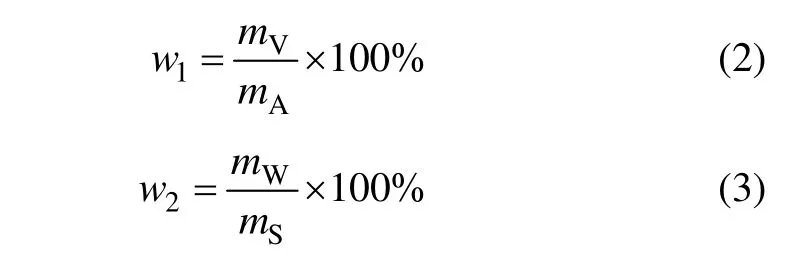
式中:mV为微球中所含挥发油质量;mA为微球总质量;mW为微球中包封的含药量;mS为微球中包封和未包封的总药量。
对微球工艺条件优劣进行考察,采用载药量(w1)、包封率(w2)、粒径分布(sP)等指标进行评价。每项采用10分制,载药量以10%作参照,越接近它,给分越高;包封率以50%作参照,越接近它,给分越高;粒径分布越窄,分值越大。根据各指标对实验结果的影响程度,确定其影响系数分别为0.5,0.3和0.2,并按下式计算综合评分Z。
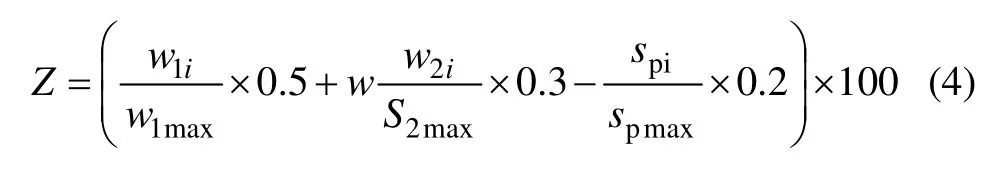
式中:w1i为各实验载药量;w2i为各实验包封率;sPi为各实验粒径跨度;w1max为最大载药量;w2max为最大包封率;sPmax为最大粒径跨度。
2 结果与讨论
2.1 正交试验优选工艺结果
以明胶和阿拉伯胶溶液为水相,使水相在油相石蜡中分散、乳化成小液滴,制备成油包水型乳液。调节 pH使明胶微球进行复凝聚,降温冷却后,加入固化剂甲醛使其交联,再加入脱水剂异丙醇把微球的水分脱去,通过离心、抽滤等方法将其分离出来。实验过程中发生的主要反应为交联反应。甲醛的作用机制是先与氨基反应形成羟甲氨基,再与另一个氨基(分子内的或另一个分子的)反应形成交联结构,使微球表面形成较高密度的交联键而固化[12-13]。阿拉伯胶为水溶性胶体,而且具有高度的可溶解性[14-15],在微球制备过程中可以使微胶囊化效率增加。正交试验结果及分析结果如表2所示。
由方差分析可知:C(明胶和阿拉伯胶质量与药油质量之比)对微球工艺显著性影响最大,其次为A(明胶和阿拉伯胶质量分数)、B(乳化温度),而D(搅拌速度)影响不显著。乳化时间对微球的影响不是很大,只是当乳化时间不够时,才会造成乳液分散不均匀,影响微球的粒径分布。
综合结果表明:4种因素中,因素A的K3最大,所以选择明胶和阿拉伯胶质量分数为30%;因素B的K1最大,所以,选择40 ℃为乳化温度;因素C的K1最大,所以选择质量比为3:1。若明胶和阿拉伯胶溶液与药油质量比太小,则挥发油转型不完全,若该质量比太大,则导致微球粘连。这可能是高浓度的明胶和阿拉伯胶溶液黏度大,在乳化过程中,不易被乳化形成小乳滴所致。因素D的K1最大,所以,选择搅拌速度为300 r/min。综上所述,艾叶挥发油明胶微球的最佳工艺条件为A3B1C1D1,即:明胶和阿拉伯胶溶液质量分数为30%,乳化温度为40 ℃,明胶和阿拉伯胶质量与药油质量之比为 3:1,搅拌速度为低速 300 r/min。微球的平均粒径与分布在很大程度上受乳化过程中搅拌速度的影响,在乳化过程中搅拌速度提高会导致微球粒径减小和粒径分布变窄,但是,当转速太高时会导致微球粘连现象加剧。艾叶挥发油明胶微球的球径与初乳乳滴的粒径有密切关系,故制备初乳时,宜采用高速乳化。制备复乳时,为防止初乳破裂,应低速乳化。在交联过程中,搅拌速度对微球的最后粒径几乎没有影响,其原因可能是:在乳化阶段增加搅拌速度,借助搅拌提供的能量有利于油相被分散成细小的乳滴,使微球的粒径变小;但转速太高时也会加剧已分散微球的碰撞凝聚,出现粘连;而在交联过程中,由于甲醛的加入,乳液中含有明胶的小液滴能立即交联固化,阻止它们的连接和聚合,从而与搅拌速度联系较小。

表2 正交试验结果及分析Table 2 Results and analysis of orthogonal test
2.2 微球的载药特性
艾叶油在波长272 nm处有最大紫外吸收,而在此波长下明胶与阿拉伯胶混合液无吸收,对测定结果无干扰。艾叶油明胶微球溶液,吸收光谱与纯药物吸收光谱一致,吸收强度相同,说明微球化后艾叶油的紫外吸收光谱无变化,故选择272 nm作为紫外检测波长。以艾叶油浓度(X)为横坐标,吸光度(Y)为纵坐标,绘制标准曲线,经回归处理,得到线性回归方程:
Y=51.185 89X+ 0.0482 79 (相关系数为0.999 9)
按照正交试验法筛选得到的最佳工艺,制备3批艾叶油明胶微球样品,其微球的平均收率为73.92%。采用紫外可见分光光度法测定微球中所含艾叶油的含量,并计算载药量和包封率,方法如前所述,结果见表 3,得其平均载药量为 8.52%,平均包封率为29.35%。该结果优于正交试验条件的实验结果,表明采用此工艺条件制备明胶微球是可行的。
明胶和阿拉伯胶溶液的浓度与载药量密切相关,浓度越大,载药量越大,但相应的包封率会下降。
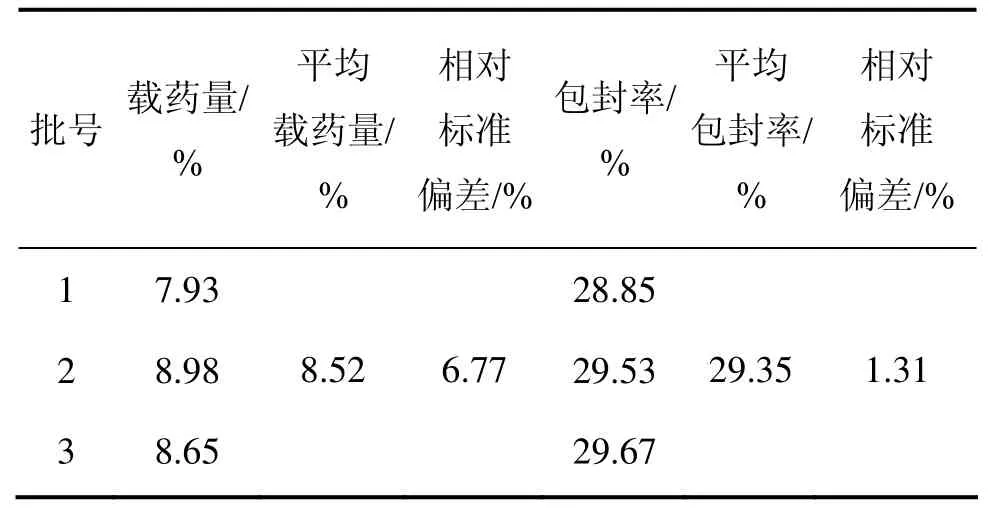
表3 样品的载药量与包封率Table 3 Drug-loading rate and entrapment rate of samples
2.3 微球的形态学性质
2.3.1 微球的外观形态观察
按最佳工艺制备,制得的微球为淡黄色粉末,经光学显微镜(物镜和目镜放大倍数均为10)观察,微球外观圆整,粒径较均匀,分散性良好,较少粘连。空白明胶微球与最佳制备工艺下艾叶油明胶微球样品的生物显微镜照片如图1~2所示。
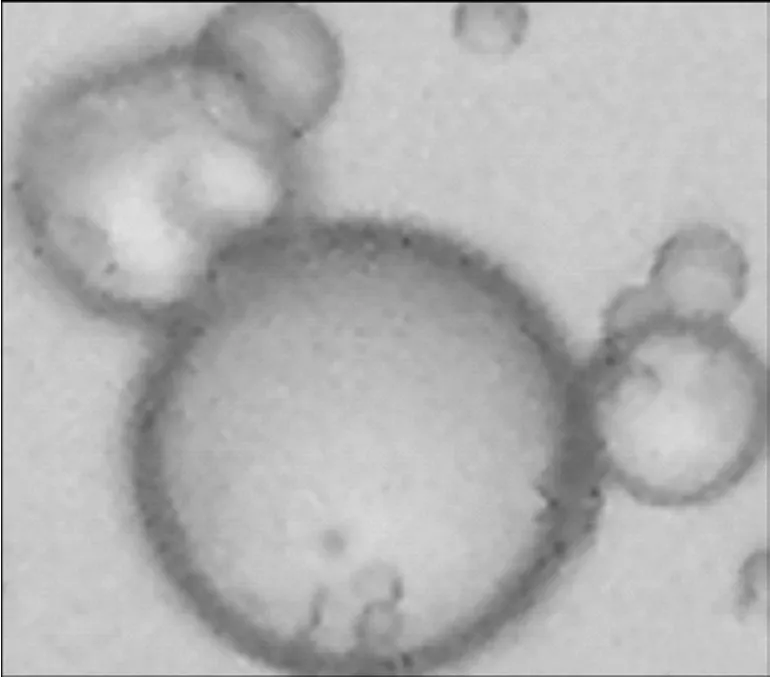
图1 空白明胶微球显微照片Fig.1 Microphotograph of blank gelatin microspheres

图2 艾叶油明胶微球最佳工艺显微照片Fig.2 Microphotograph of optimal technique gelatin microspheres of volatile oil of Folium Artemisiae Argyi
2.3.2 微球粒径的测定
将试验所得微球均匀涂于载玻片上,在光学显微镜下用测微尺目测微球直径,以每隔 5 μm球径为 1组,分为7组,按下式计算平均粒径(Dav):

式中:n为微球数量;d为每组微球直径的中间值。计算微球的平均粒径为22.31 μm,粒径范围为10~30 μm的微球质量分数为83.91%。
2.3.3 明胶微球的扫描电镜(SEM)观察与分析
对最佳工艺条件下所得微球的分散度、交联程度、具体粒径、球形度以及表面形态进行较准确分析,进行300倍和1000倍扫描电镜观察,其SEM图像如图3所示。
从图3可以看出:明胶微球实际上是一个多孔的球体,这些孔洞的存在有利于微球的吸附载药,表面上存在的白色物质为艾叶挥发油。微球形态及粘连程度并测其直径,得出平均粒径约为23.25 μm,比采用光学显微镜测定的结果偏大。这可能是微球在溶液中发生溶胀所致。

图3 不同扫描倍数下艾叶油明胶微球的扫描电镜照片Fig.3 SEM micrographs of gelatin microspheres of volatile oil of Folium Artemisiae Argyi
3 结论
(1) 采用乳化交联法,根据正交优化设计,制得微球外观圆整,粒径较均匀,分散性良好,较少粘连,平均粒径约为23.25 μm。筛选得到的最佳工艺如下:明胶和阿拉伯胶溶液的适宜质量分数为30%,适宜乳化温度为40 ℃,明胶和阿拉伯胶与药油质量比为3:1,搅拌速度为300 r/min。
(2) 乳化剂的种类和浓度对微球粒径有影响,浓度越高,制得微球的粒径越小;反之,制得的微球粒径越大。运用Span-80与Tween-80复合乳化剂比单一乳化剂效果好,取样容易,乳化剂之间产生了配伍协同作用。且因阿拉伯胶具有很好的水溶性和乳化性,配以明胶一起使用,在微球制备过程中可以使微胶囊化效率增加。
(3) 通过紫外分光光度法测定微球中的药物含量,计算得其平均载药量为 8.52%,平均包封率为29.35%。表明采用此工艺条件制备明胶微球切实可行,工艺简单,产品稳定。
[1] 梅全喜. 艾叶的药理作用研究概况[J]. 中草药, 1996, 27(5):311-314.MEI Quan-xi. Study of pharmacological effect on Artemisia Argyi[J]. Chinese Traditional and Herbal Drugs, 1996, 27(5):311-314.
[2] 姚发业, 邱琴, 刘廷礼, 等. 艾叶挥发油的化学成分[J]. 分析测试学报, 2001, 20(3): 42-45.YAO Fa-ye, QIU Qin, LIU Ting-li, et al. Chemical components of essential oils from Folium Artemisiae Argyi[J]. Journal of Instrumental Analysis, 2001, 20(3): 42-45.
[3] 黄学红, 谢元德, 朱婉萍, 等. 艾叶油治疗慢性支气管炎的实验研究[J]. 浙江中医杂志, 2006, 41(12): 734-735.HUANG Xue-hong, XIE Yuan-de, ZHU Wan-ping, et al. Study of the treatment of chronic bronchitis with volatile oils from Folium Artemisiae Argyi[J]. Zhejiang Journal of Traditional Chinese Medicine, 2006, 41(12): 734-735.
[4] 曾虹燕. 不同方法提取的艾叶挥发油指纹图谱分析[J]. 广西植物, 2005, 25(6): 587-590.ZENG Hong-yan. Fingerprint chromatogram of the volatile oils of the leaves from Artemisia Argyi with different methods[J].Guihaia, 2005, 25(6): 587-590.
[5] 杨永新, 李岩, 孙殿甲. 交联固化对明胶微球质量的影响[J].西北药学杂志, 2001, 16(1): 40-41.YANG Yong-xin, LI Yan, SUN Dian-jia. Effect of crosslinking on the quality of gelatin microspheres[J]. Northwest Pharmaceutical Journal, 2001, 16(1): 40-41.
[6] 曾凡彬, 杨红, 陆彬, 等. 盐酸川芎嗪肺靶向微球的研究[J].药学学报, 1996, 31(2): 132.ZENG Fan-bin, YANG Hong, LU Bin, et al. Study of ligustrazine hydrochloride microspheres[J]. Acta Pharmaceutica Sinica, 1996, 31(2): 132.
[7] di Silvio L, Gurav N, Kayser M V, et al. Biodegradable microspheres: A new delivery system for growth hormone[J].Biomaterials, 1994, 15(11): 931-936.
[8] Li L H, Okada H, Takemura G, et al. Sustained release of erythropoietin using biodegradable gelatin hydrogel microspheres persistently improves lower leg ischemia[J].Journal of the American College of Cardiology, 2009, 53(25):2378-2388.
[9] Illum L, Davis S S. The targeting of drugs parenterally by use of microspheres[J]. J Parenter Sci Technol, 1982, 36(6): 242.
[10] Habraken W J E M, Boerman O C, Wolke J G C, et al. In vitro growth factor release from injectable calcium phosphate cements containing gelatin microspheres[J]. Journal of Biomedical Materials Research: Part A, 2009, 91(2): 6114-615.
[11] 詹国平, 黄可龙, 谢恩伟. 肺靶向硫酸链霉素明胶微球的制备[J]. 中国医院药学杂志, 2005, 25(7): 625-628.ZHAN Guo-ping, HUANG Ke-long, XIE En-wei. The Preparation of streptomycin sulfate gelatin microspheres for lungtargeting[J]. Chin Hosp Pharm J, 2005, 25(7): 625-628.
[12] Wei H J, Yang H S, Chen C H, et al. Gelatin microspheres encapsulated with a nonpeptide angiogenic agent, ginsenoside Rgl, for intramyocardial injection in a rat model with infracted myocardium[J]. Journal of Controlled Release, 2007, 120(1/2):27-34.
[13] Morita T, Horikiri Y, Suzuki T, et al. Applicability of various amphiphilic polymers to the modification of protein release kinetics from biodegradable reservoir-type microspheres[J]. Eur J Pharm Biopharm, 2001, 51(1): 45.
[14] Bidone J, Melo A P P, Bazzo G C, et al. Preparation and characterization of ibuprofen-loaded microspheres consisting of poly(3-hydroxybutyrate) and methoxy poly (ethylene glycol)-b-poly (D,L-lactide) blends or poly(3-hydroxybutyrate)and gelatin composites for controlled drug release[J]. Materials Science & Engineering C: Biomimetic and Supramolecular Systems, 2009, 29(2): 588-589.
[15] Shutava T G, Bailundi S S, Lvov Y M, et al. Epigallocatechin gallate/gelatin layer-by-layer assembled films and microcapsules[J]. Journal of Colloid and Interface Science, 2009,330(2): 276-283.

