阪崎肠杆菌实时荧光双重TaqMan PCR快速检测体系的建立*
孟 双,李 娟,王 艳,白雪梅,叶长芸
阪崎肠杆菌实时荧光双重TaqMan PCR快速检测体系的建立*
孟 双,李 娟,王 艳,白雪梅,叶长芸
目的 建立针对阪崎肠杆菌的高灵敏、高特异的实时荧光双重TaqMan聚合酶链式反应(PCR)快速检测体系。方法 根据阪崎肠杆菌基因组16SrRNA~23SrRNA的内部转录间隔区(ITS)基因和外膜蛋白A(OmpA)基因的特异性序列设计引物及TaqMan探针,利用高通量实时荧光PCR检测平台探讨该检测体系的灵敏度;用50种其他肠道致病菌及院内感染中常见的致病菌评价该检测体系的特异性。结果 实时荧光双重TaqMan PCR快速检测体系对阪崎肠杆菌重组质粒的检测灵敏度为1×102拷贝/反应体系;对阪崎肠杆菌基因组的检测灵敏度为4×10-1pg/反应体系;该检测体系在检测50种其他肠道致病菌及院内感染中常见的致病菌时未出现特异性扩增,整个反应在2h内完成。结论 本研究建立的实时荧光双重TaqMan PCR检测体系可作为阪崎肠杆菌灵敏、特异、快速的检测方法,并同时检测阪崎肠杆菌的致病力。
阪崎肠杆菌;实时荧光TaqMan PCR;外膜蛋白A;内部转录间隔区
阪崎肠杆菌是一种革兰阴性、有周生鞭毛、能运动、兼性厌氧的无芽孢杆菌,起初被认为是阴沟肠杆菌的生物变型菌。后来Farmer[1]通过DNA杂交实验以及菌株的生化特性等特征将其重新命名为阪崎肠杆菌,并划分为克罗诺杆菌属(Cronobacterspp)。
作为一种重要的条件致病菌,阪崎肠杆菌感染的大多数病例都是婴儿,特别是早产儿、出生体重偏低等身体状况较差的新生儿。感染主要引起脑膜炎、菌血症和坏死性小肠结肠炎[2]。细菌表面的外膜蛋白A(ompA)在阪崎肠杆菌的致病过程中发挥了重要作用[3]。
由于传统的阪崎肠杆菌检测方法费事费力,不利于快速检测,近年来针对阪崎肠杆菌基因组的快速检测技术开始出现。为了既能有效的检测阪崎肠杆菌,又能同时判断阪崎肠杆菌表达OmpA及产生致病性的能力,在研究中我们选择了阪崎肠杆菌的16SrDNA与23SrDNA之间的内部转录间隔区(ITS)以及细菌的ompA基因作为检测的靶标,建立了阪崎肠杆菌高灵敏、高特异的实时荧光双重TaqMan PCR快速检测体系。
1 材料与方法
1.1 材料
1.1.1 菌株来源 阪崎肠杆菌标准株(ATCC51329)购自中国药品生物制品检定所。20株分离菌株为本室保存,经过德灵 WALKAWAY-40SI全自动微生物分析仪鉴定。用于特异性评价的菌株由中国疾病预防控制中心传染病预防控制所各科室提供,包括肠致病性大肠杆菌(EPEC)、肠产毒性大肠杆菌(ETEC)、肠侵袭性大肠杆菌(EIEC)、肠出血性大肠杆菌(EHEC)、肠集聚性大肠杆菌(EaggEC)、泌尿道致病性大肠杆菌(UPEC)、福氏志贺菌、宋内志贺菌、甲型副伤寒沙门氏菌、肺炎克雷伯菌、普通变形杆菌、摩根氏摩根菌、弗劳地枸橼酸杆菌、阴沟肠杆菌、粘质沙雷菌、副溶血弧菌、金黄色葡萄球菌、肺炎链球菌、酿脓链球菌、血链球菌、唾液链球菌、牛链球菌、粪肠球菌、小肠结肠炎耶尔森菌、铜绿假单胞菌、嗜水气单胞菌、单增李斯特菌。
1.1.2 试剂与仪器设备 Premix Ex TaqTM、EasyDilution、pMD18-T载体、JM109感受态细胞、Ex Taq DNA聚合酶以及小量质粒提取试剂盒均购自大连宝生物工程有限公司。细菌基因组DNA抽提试剂盒购自Promega公司。ABI 7900HT PCR仪为美国应用生物系统公司产品。
1.2 方法
1.2.1 引物和探针的合成 利用GenBank的Blast工具对阪崎肠杆菌的ITS基因和ompA基因序列进行分析,选择其稳定的保守区域作为检测靶标序列,并针对这两个序列设计引物和探针(见表1)。引物和探针均由上海基康生物公司合成。
1.2.2 细菌基因组DNA的抽提 细菌基因组DNA的抽提使用TAKARA公司的MiniBEST试剂盒,按照说明书进行操作。利用紫外分光光度计测定细菌基因组DNA的纯度和浓度,阪崎肠杆菌基因组DNA用EasyDilution缓冲液稀释至4×105~4×10-2pg/μL的浓度梯度,阴性对照用EasyDilution缓冲液稀释至4×104pg/μL,各种基因组DNA均少量分装,-20℃保存备用。
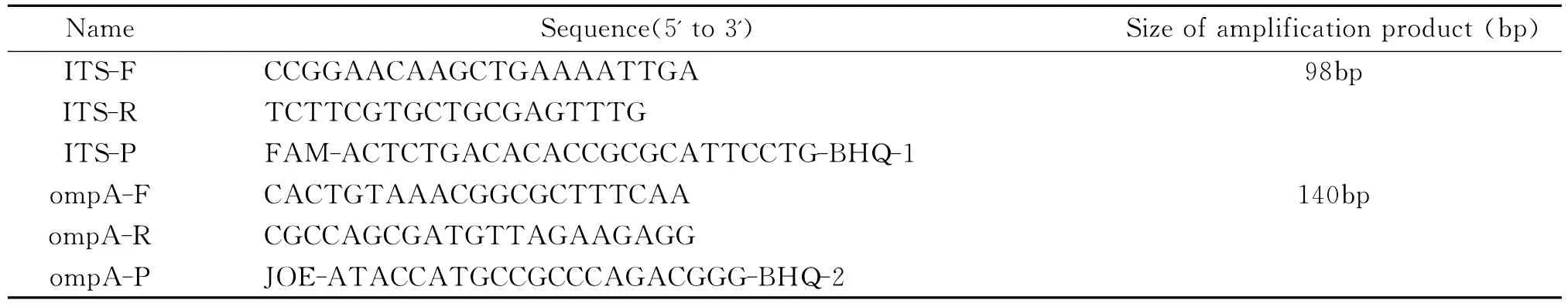
表1 引物及探针序列Table 1 Sequences primers and probes
1.2.3 质粒标准品的构建与制备 ①以ITS-F/ITS-R和ompA-F/ompA-R为引物,分别进行PCR扩增后得到目的片段98bp和140bp;②切胶回收,纯化PCR产物;③连接到T载体;④转化JM109感受态细胞;⑤筛选阳性克隆子,用PCR进行验证,最终测序确认;⑥提取质粒,根据质粒的分子量将质粒样品浓度换算为拷贝数浓度:每μL样品中检测基因的拷贝数=浓度(ng/μL)×阿佛加德罗常数×10-9/(660×重组质粒碱基数);⑦用 EasyDilution将上述质粒依次稀释成1.0×100拷贝/μL~1.0×1010拷贝/μL,共11个浓度梯度。
1.2.4 普通双重PCR反应体系的建立 普通双重PCR反应总体系为30μL,含10×PCR缓冲液3μL、2.5mmol/L dNTPs各2μL、10μmol/L引物各1μL、模板DNA 1μL、ExTaq DNA聚合酶2.5 U,补加灭菌水至30μL。PCR循环参数:94℃预变性5min;94℃变性30s,58℃退火30s,72℃延伸30s,共35个循环;72℃延伸5min。同时以去离子水代替模板DNA作为阴性对照。反应结束后,取5 μL PCR产物在1.5%的琼脂糖凝胶上进行电泳,并在凝胶成像系统上观察分析结果。
1.2.5 实时荧光双重TaqMan PCR反应体系的建立 实时荧光双重TaqMan PCR法反应总体系为20μL,含2×Premix(Takara)Ex TaqTM10μL、10μmol/L的引物探针各0.4μL、DNA模板1μL,补加去离子水至20μL。在ABI 7900HT PCR仪上扩增并测定结果,PCR循环参数:95℃预变性30s;95℃变性3s,60℃延伸30s,共40个循环。扩增结束后,扣除本底荧光信号后取同一阈值分析数据,确定各样本的Ct(cycle threshold)值。
1.2.6 普通双重PCR与实时荧光双重TaqMan PCR检测体系灵敏度的评价 取质粒标准品每反应体系100拷贝至1010拷贝,或者以4×10-2pg/μL至4×105pg/μL梯度浓度的阪崎肠杆菌基因组DNA为模板,评价普通双重PCR与实时荧光双重Taq-Man PCR检测体系的检测灵敏度。
1.2.7 检测特异性评价 以常见致病菌及条件致病菌DNA(EPEC、ETEC、EIEC、EHEC、EaggEC、UPEC、福氏志贺菌、宋内志贺菌、甲型副伤寒沙门氏菌、肺炎克雷伯菌、普通变形杆菌、摩根氏摩根菌、弗劳地枸橼酸杆菌、阴沟肠杆菌、粘质沙雷菌、副溶血弧菌、金黄色葡萄球菌、肺炎链球菌、酿脓链球菌、血链球菌、唾液链球菌、牛链球菌、粪肠球菌、小肠结肠炎耶尔森菌、铜绿假单胞菌、嗜水气单胞菌、单增李斯特菌)为模板评价了实时荧光双重TaqMan PCR体系的特异性。
2 结 果
2.1 目的基因片段的克隆 实验获得的扩增片段分子量大小与预期结果一致,ITS基因的扩增片段长度为98bp,ompA基因的扩增片段长度为140 bp。将所得片段分别插入T载体中,经测序验证,所获阳性克隆包含的目的片段序列完全正确。
2.2 普通双重PCR检测体系的灵敏度 双质粒梯度稀释进行普通双重PCR扩增后显示:当每反应体系中ITS基因重组质粒和ompA基因重组质粒的模板数降低至104拷贝以下时,普通PCR扩增后电泳图上未出现目的条带,阴性对照也未见扩增条带(图1)。
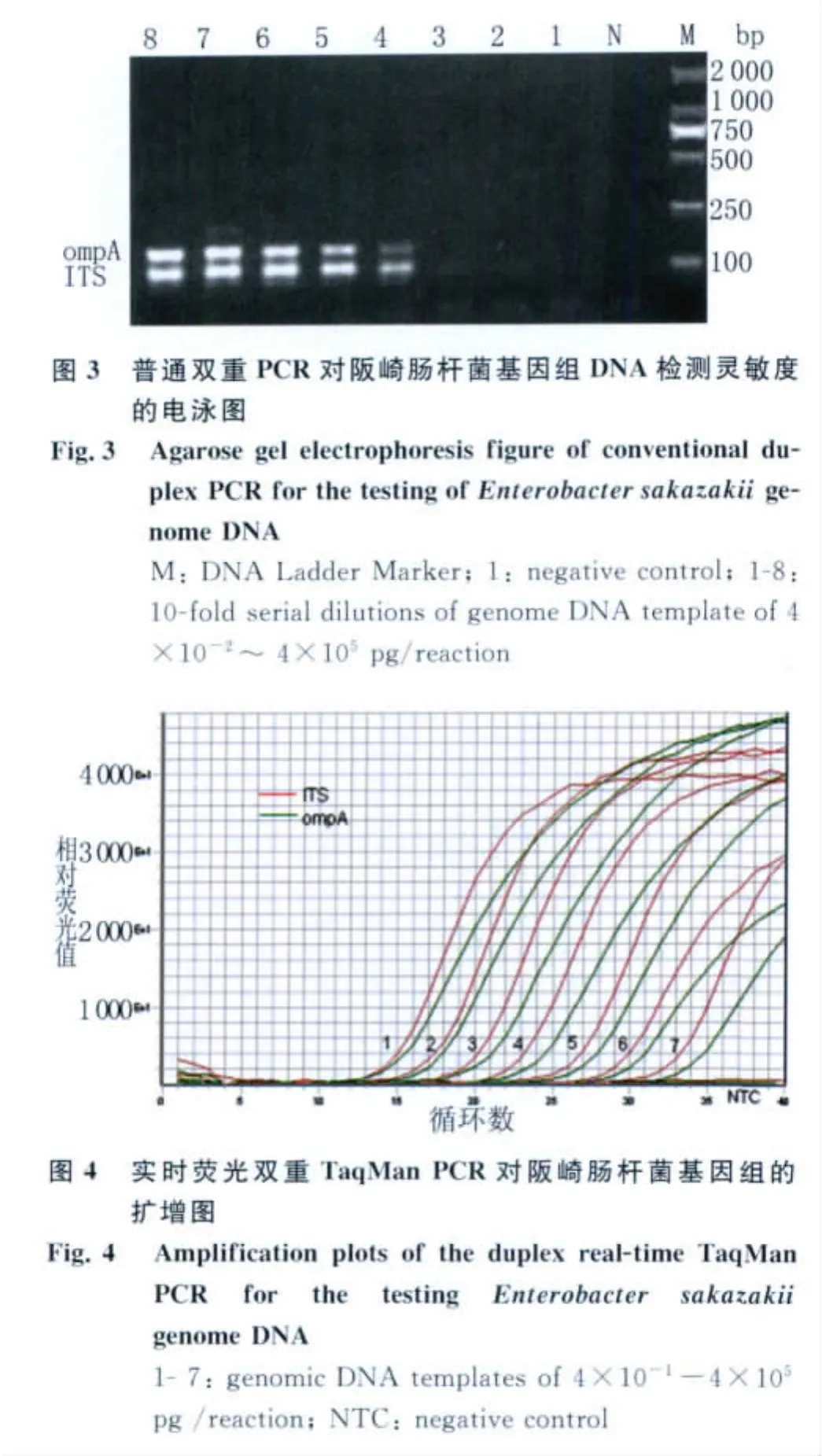
2.3 实时荧光双重TaqMan PCR检测体系的灵敏度 用与普通双重PCR检测体系相同的双质粒稀释梯度作为模板进行实时荧光双重PCR检测后显示:当ITS基因与ompA基因重组质粒浓度为1.0×102~1.0×1010拷贝/μL时,其荧光信号强度高于检测阈值,故其检测范围是1.0×102~1.0×1010拷贝每反应体系(图2)。在该双重PCR检测体系中,两个靶基因扩增反应的Ct值与模板浓度之间均存在良好的线性关系,ITS的相关性为0.991,ompA的相关性为0.994。
2.4 普通双重PCR与实时荧光双重TaqMan PCR体系对阪崎肠杆菌基因组的检测灵敏度 将阪崎肠杆菌基因组DNA稀释到4×10-2~4×105pg/μL进行普通双重PCR扩增后结果显示:当基因组DNA稀释至每反应体系4×101pg以下时普通双重PCR扩增后电泳图上未出现特异性扩增条带(图3);用相同稀释梯度的基因组DNA进行实时荧光双重PCR扩增显示:当基因组DNA浓度为4×10-1~4×105pg/μL时,其荧光信号强度高于检测阈值,提示实时荧光双重PCR检测体系对阪崎肠杆菌基因组DNA的检测灵敏度比普通双重PCR高100倍(图4)。

2.5 实时荧光双重TaqMan PCR体系的检测特异性 用该体系对EPEC、ETEC、EIEC、EHEC、EaggEC、UPEC、福氏志贺菌、宋内志贺菌、甲型副伤寒沙门氏菌、肺炎克雷伯菌、普通变形杆菌、摩根氏摩根菌、弗劳地枸橼酸杆菌、阴沟肠杆菌、粘质沙雷菌、副溶血弧菌、金黄色葡萄球菌、肺炎链球菌、酿脓链球菌、血链球菌、唾液链球菌、牛链球菌、粪肠球菌、小肠结肠炎耶尔森菌、铜绿假单胞菌、嗜水气单胞菌、单增李斯特菌等50种非阪崎肠杆菌的病原菌基因组DNA进行检测时均未产生特异性扩增曲线,说明该检测体系的特异性良好。
3 讨 论
阪崎肠杆菌是一种新兴的食源性病原菌,在新生儿特别是早产儿和免疫力低下的人群中可引起脑膜炎、败血症以及坏死性小肠结肠炎[2]。FDA推荐的分离鉴定阪崎肠杆菌的方法费时费力,不利于快速检测。使用这些方法鉴定阪崎肠杆菌主要依靠菌株的一些生化特性以及色素的产生,但是一些阪崎肠杆菌并不产生黄色色素,因此就无法在TSA平板上分离,就容易产生假阴性结果[4]。
与其他检测方法相比,本研究建立的实时荧光双重TaqMan PCR检测体系具有许多的优势。传统的培养方法需要两次增菌后用显色培养基分离培养,再进行生化鉴定,工作量大,耗时长。实时荧光双重TaqMan PCR检测体系在2h内就可以观察结果,满足了临床快速诊断的需要,且灵敏度远高于培养方法,能监测含菌量极低的食品以及临床、环境样本。普通PCR方法扩增完成后需制备琼脂糖凝胶、电泳、染色和成像观察,操作繁琐,肉眼判断条带敏感性受限,扩增后开盖容易引起产物污染[5],而实时荧光PCR体系无需开盖,扩增过程同步检测荧光变化,探针分子杂交确保检测更加特异,灵敏度提高2个数量级,可以实现定量检测。通常单个靶位点的实时荧光PCR只能检测一个基因,本研究建立的实时荧光双重TaqMan PCR体系可以同时检测ITS和ompA两个基因。16SrDNA与23SrDNA之间的ITS序列是在细菌分类学上用的最多的靶标[6]。不同细菌种属之间的ITS序列存在相应的变化,因此ITS序列可以用来作为鉴定细菌种、属的一个靶标基因[7]。细菌表面有多种外膜蛋白,其中ompA在阪崎肠杆菌的致病过程中发挥了重要作用。研究者发现不表达外膜蛋白A的突变株(ompA-)对宿主细胞的侵入力和黏附作用比正常菌株低7倍,并且不能在人脑微血管内皮细胞(HBMEC)中繁殖[3]。本研究采用实时荧光双重TaqMan PCR体系在对阪崎肠杆菌检测的同时还可以判断其是否携带致病相关基因,可对检测结果的判断提供可靠的依据。
我们利用质粒标准品和阪崎肠杆菌基因组DNA两类模板,较全面的探讨了普通双重PCR、实时荧光双重TaqMan PCR检测体系的灵敏度和特异度。实时荧光双重TaqMan PCR体系的灵敏度100倍高于普通双重PCR检测体系,并对50种肠道致病菌及院内感染中常见的致病菌进行了检测,未出现假阳性,特异性好。本研究建立的实时荧光双重TaqMan PCR法为应用于临床标本的检测提供了可靠的技术依据,可以作为阪崎肠杆菌一种常规的检测方法,在临床检验及检疫中推广使用。
[1]Kandhai MC,Reij MW,van Puyvelde K,et al.A new protocol for the detection ofEnterobactersakazakiiapplied to environmental samples[J].J Food Prot,2004,67(6):1267-1270.
[2]Healy B,Cooney S,O'Brien S,et al.Cronobacter(Enterobacter sakazakii):an opportunistic foodborne pathogen[J].Foodborne Pathog Dis,2010,7(4):339-350.
[3]Singamsetty VK,Wang Y,Shimada H,et al.Outer membrane protein A expression inEnterobactersakazakiiis required to induce microtubule condensation in human brain microvascular endothelial cells for invasion[J].Microb Pathog,2008,45(3):181-191.
[4]Restaino L,Frampton EW,Lionberg WC,et al.A chromogenic plating medium for the isolation and identification of Enterobacter sakazakii from foods,food ingredients,and environmental sources[J].J Food Prot,2006,69(2):315-322.
[5]Bischoff C,L thy J,Altwegg M,et al.Rapid detection of diarrheagenicE.coliby real-time PCR[J].J Microbiol Methods,2005,61(3):335-341.
[6]Liu Y,Cai X,Zhang X,et al.Real time PCR using TaqMan and SYBR Green for detection ofEnterobactersakazakiiin infant formula[J].J Microbiol Methods,2006,65:21-31.
[7]Welsh J,McClelland M.Genomic fingerprints produced by PCR with consensus tRNA gene primers[J].Nucleic Acids Res,1991,19(4):861-866.
Novel duplex real-time TaqMan PCR assay for the detection ofEnterobactersakazakii
MENG Shuang,LI Juan,WANG Yan,BAI Xue-mei,YE Chang-yun
(StateKeyLaboratoryforInfectiousDiseasePreventionandControl,NationalInstituteforCommunicableDisease ControlandPrevention,ChineseCenterforDiseaseControlandPrevention,Beijing102206,China)
To develop a sensitive and specific duplex real-time TaqMan polymerase chain reaction ( PCR)assay for the detection ofEnterobactersakazakii,2sets of primers and probes were designed based on the sequences of the internal transcribe spacer(ITS)and the outer member protein A (ompA).High throughput real-time PCR system was used to evaluate the sensitivity of the assay,and the specificity was evaluated by 50other common enteropathogenic bacteria and some isolates causing nosocomial infection.The sensitivity of the duplex real-time PCR assay for testing of recombinant plasmids was 1×102copies per reaction,and the sensitivity for testing of theEnterobactersakazakiigenome DNA was 4×10-1pg per reaction.No specific amplifications were presented when the 50other common enter pathogenic bacteria and some isolates causing nosocomial infection were tested.Furthermore,the assay could be finished within 2hours.The duplex real-time TaqMan PCR assay developed in our study was sensitive,specific and rapid.It not only could be used for the detection ofEnterobactersakazakii,but also for the detection of the pathogenicity simultaneously.
Enterobactersakazakii;real-time TaqMan PCR;out member protein A;internal transcribe spacer
R378.2
A
1002-2694(2011)10-0857-04
*国家科技重大专项资助(2008ZX10004-001,2009ZX10004-101)
叶长芸,Email:yechangyun@icdc.cn
中国疾病预防控制中心传染病预防控制所,传染病预防控制国家重点实验室,北京 102206
2011-04-11;
2011-06-18

