万寿菊杀菌素水乳剂对西瓜枯萎病反应的抗性
杨利霞,王金胜
(山西农业大学生命科学学院,山西太谷030801)
西瓜枯萎病又称萎蔫病或蔓割病,是一种世界性瓜类土传病害。自1894年Smith在美国南卡罗来纳州首次发现西瓜枯萎病以来,目前该病几乎发生于世界各个西瓜产区,严重影响着西瓜的生产[1]。现在人们主要通过使用化学农药来控制该病害,但化学农药的长期大量不科学的使用,已造成环境污染、生态系统破坏等,在这种情况下,人们转向寻找有效的植物源农药。
菊科植物万寿菊(Tagetes patula),作为观赏植物在世界上许多国家均有种植。由于万寿菊花富含可食用黄色素,可用作食品和饲料添加剂[2],现主要用作提取色素,在我国各地广泛种植。近年来,该提取物在生物科学研究方面引起了广泛的关注。国内外对万寿菊的化学成分如噻吩类、精油、黄酮等的抗线虫、昆虫活性有研究报道[3-4]。但对其抗菌性方面的报道[5]很少。
有研究表明,万寿菊粗提物的抑菌活性,已经验证了万寿菊根提取物具有广谱抑菌作用,且对枯萎病菌的抑菌作用效果良好,并能诱导西瓜苗保护酶活性的提高[6-7];通过不同溶剂提取、层析、色谱等手段对万寿菊根中抑菌活性成分进行了提取、分离、纯化,并对每一级成分进行生物活性追踪实验[8],分离出5类具有抑菌活性的生物碱和提取出7种对枯萎病菌有广谱抑制作用的黄酮类物质[9-10]。但从万寿菊中提取出的抑菌活性物质含量较少,不能以万寿菊根为原料直接提取抑菌活性物质而用于生产。通过对抑菌活性物质的化学分析,根据分析结果得到这些成分的结构,再用化学方法合成了这些抑菌活性物质的类似物,这些物质暂时被称为“万寿菊杀菌素”,并申请了专利。由于万寿菊杀菌素难溶于水,为了用于生产,对其进行了配方研究和技术处理,制成了万寿菊杀菌素水乳剂[11]。
本试验的目的是研究万寿菊杀菌素水乳剂对西瓜枯萎病菌菌丝生长的影响,及其处理西瓜幼苗后诱导西瓜幼苗叶部细胞保护酶活性的变化,以期为开发新的防治西瓜枯萎病的农药和工业化生产提供理论基础和科学依据。
1 材料和方法
1.1 试验材料
万寿菊杀菌素水乳剂,西瓜枯萎病菌(Fusarium oxysporum Schlecht.f.sp.niveum),西瓜种子。
1.2 试验方法
1.2.1 西瓜枯萎病菌粗毒素液及孢子悬浮液的制备 参照蒋细良等[12]的方法。用理查德液体培养基,在25℃、振荡和3 000 lx光照条件下培养西瓜枯萎病菌,20 d后用双层纱布过滤,滤液用5 000 r/min离心15 min,收集上清液,即为西瓜枯萎病菌的粗毒素液。
孢子悬浮液的制备:将西瓜枯萎病菌接种在PDA培养基上,在25℃恒温培养箱中培养10 d,刮取培养物放到无菌水中,用磁力搅拌器搅拌,过滤后配成每毫升106~107个孢子的悬浮液。
1.2.2 万寿菊杀菌素水乳剂药效试验 菌丝生长抑制率测定[13]:设4个浓度梯度处理,分别为:Ⅰ.0.1 μg/mL;Ⅱ.0.5 μg/mL;Ⅲ.1.0 μg/mL;Ⅳ.1.5 μg/mL,配制成含不同质量浓度万寿菊杀菌素水乳剂培养基。以不含万寿菊杀菌素水乳剂为对照。用打孔器从事先培养纯化好的菌种中采取菌斑,用接种针转入含药培养基中。28℃恒温培养,分别于24,48,72 h后观察菌斑的生长情况,记录菌斑生长直径,然后用十字交叉法测定菌落直径,计算抑制率,重复3次,用于选取万寿菊杀菌素水乳剂抵抗西瓜枯萎病菌的适合质量浓度。
相对抑制率=(对照菌斑生长直径-处理菌斑生长直径)/对照菌斑生长直径×100%。
1.2.3 西瓜枯萎病菌粗毒素液及孢子悬浮液与万寿菊杀菌素水乳剂对西瓜植株的处理 将西瓜种子浸入水中搅拌,漂洗剔除病、劣和杂粒,搓洗掉种子表面的污物,用75%的乙醇消毒,无菌水冲洗干净,湿纱布包好种子,在20~35℃黑暗下催芽。当种子露白后将被抑制而未发芽的病、劣种子剔除,将发芽较好的种子播种,在气温20~35℃,最大自然光强75 000 lx的室外条件下用Hogland营养液培养西瓜幼苗。在西瓜成苗期用西瓜枯萎病菌毒素粗提液和孢子悬浮液灌根,对照用等量自来水处理,24 h后植株再喷洒万寿菊杀菌素水乳剂为处理B,24 h后喷洒等量自来水的为处理A。
1.2.4 生理生化指标测定 喷药处理24 h后开始测定各处理生理生化指标的变化,然后每隔24 h测定1次,连续测定1周。
1.2.4.1 SOD酶活性测定方法 采用NBT光还原法[14]。测定样品在560 nm处的吸光度,以抑制光还原50%为1个酶单位,每个样品重复3次。
1.2.4.2 POD酶活性的测定方法 采用愈创木酚法测定[15]。在470nm波长下测定样品反应3 min的吸光度,每个样品重复3次。
1.2.4.3 CAT酶活性测定方法 采用紫外吸收法[16]。测定样品在240 nm波长的吸光度值的变化,以1 min内吸光度值降低0.1为1个酶活单位(U),每个样品重复3次。
1.2.5 过氧化物同工酶的分离和定位 参照文献[17]的方法,分离胶浓度为7.5%,浓缩胶浓度为2.5%,电极缓冲液Tris-甘氨酸缓冲液,pH值为8.3,用溴酚蓝作前沿指示剂,上样量为0.02 mL,0~4℃条件下稳压电泳,80 V恒压电泳0.5 h后改用120 V,用联苯胺法染色。相对迁移率:Rf=x/y(x为固定染色后酶蛋白区带的迁移距离,y为固定染色前凝胶的迁移距离)。
2 结果与分析
2.1 万寿菊杀菌素水乳剂对西瓜枯萎病菌的抑制情况
在含不同质量浓度万寿菊杀菌素水乳剂培养基上接种直径相同的菌斑,于28℃恒温培养箱内培养,在培养24,48,72 h后分别用十字交叉法测定菌落直径,计算相对抑制率(图1)。
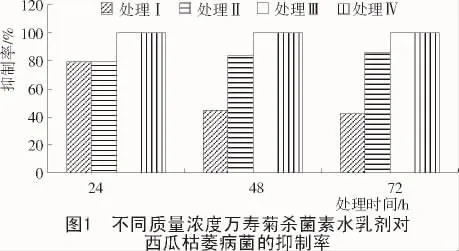
从图1可以看出,万寿菊杀菌素水乳剂对西瓜枯萎病菌的生长有抑制作用,当质量浓度为0.5 μg/mL(处理Ⅱ)时,抑制率均达到80%以上。当质量浓度为1.0 μg/mL(处理Ⅲ)时,杀菌素将病菌完全抑制。这种抑制作用持续时间较长,72 h依然有较高的抑制率。说明万寿菊杀菌素水乳剂对西瓜枯萎病菌有抑制作用,并随着质量浓度的升高,抑制作用随之增强。
2.2 万寿菊杀菌素水乳剂处理西瓜幼苗后叶内保护酶活性的变化
2.2.1 SOD酶活性的变化 用万寿菊杀菌素水乳剂和西瓜枯萎病菌粗毒素液及孢子悬浮液处理西瓜幼苗后,对SOD酶活性进行了测定(图2)。

图2表明,西瓜幼苗在西瓜枯萎病菌粗毒素液、孢子悬浮液和万寿菊杀菌素水乳剂处理后,与对照相比,其SOD酶活性显著升高,而仅用西瓜枯萎病菌粗毒素液及孢子悬浮液处理的幼苗,其SOD活性则在96 h后降低,144 h后低于对照,说明万寿菊杀菌素水乳剂可使植物保持较高的SOD酶活性,降低毒素对植物的伤害。
2.2.2 CAT酶活性的变化 万寿菊杀菌素水乳剂处理后对西瓜CAT酶活性进行测定(图3)。
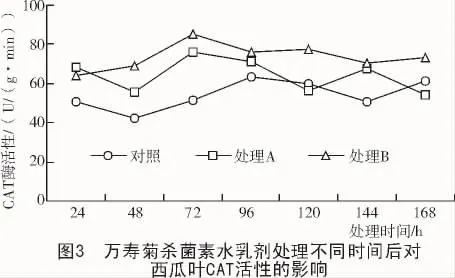
图3表明,在只有西瓜枯萎病菌粗毒素液及孢子悬浮液处理后的西瓜幼苗对外界不良条件作出反应,CAT酶活性出现忽高忽低的波动,而加万寿菊杀菌素水乳剂处理后叶片CAT酶活性先升高后逐渐降低,但仍高于对照。说明万寿菊杀菌素水乳剂能促使植株调节CAT酶活性,使其表现出在高酶活性水平稳定的变化。
2.2.3 POD酶活性的变化 用万寿菊杀菌素水乳剂对西瓜苗进行处理后,测定植物叶片POD酶活性(图4)。
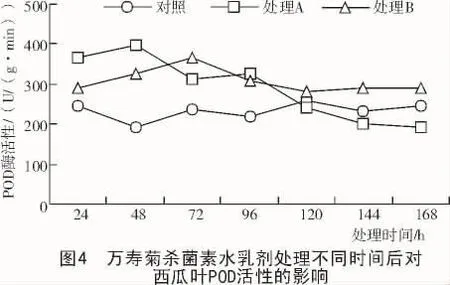
由图4可知,植株在感染西瓜枯萎病初期,由于植物的应激反应其叶片POD酶活性升高,但在120 h后出现降低,而喷洒万寿菊杀菌素水乳剂后植株POD酶活性先升高后又缓慢降低,但一直高于对照,说明万寿菊杀菌素水乳剂可使植株提高POD酶活性,并稳定在一定范围。
2.3 不同处理后西瓜幼苗体内过氧化物同工酶的变化
采用万寿菊杀菌素水乳剂和西瓜枯萎病菌粗毒素液根处理西瓜幼苗后,120 h测定过氧化物同工酶电泳(图5)。其中,1~3泳道为对照组,4~6泳道为A处理,7~9泳道为B处理。
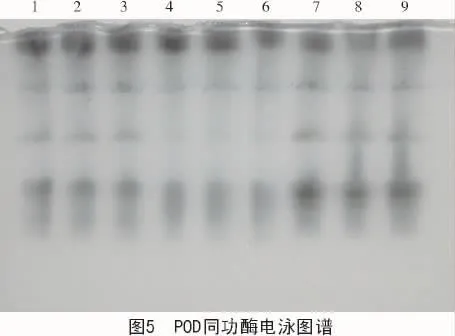
从图5可以看出,感染枯萎病植株(A处理)的酶谱条带整体染色较轻,说明其酶活性较低,且在 Rf=0.35 处的谱带缺失,Rf=0.52,0.57,0.61处的3条谱带染色都较轻,而喷洒万寿菊杀菌素水乳剂植株(B处理)的酶谱条带数与对照谱带条数一致,且在Rf=0.52处的谱带着色明显加深,说明万寿菊杀菌素水乳剂可使植株增强该种过氧化物同工酶的活性。
3 结论与讨论
植物中含有很多对植物病原菌有抑制作用的活性物质,从植物中寻找杀菌、抑菌活性物质是开发、研制无公害新型杀菌剂的热点之一[18]。植物源杀菌剂是利用有些植物里含有的某些抗菌物质(如大蒜中的大蒜素、蚕豆中的蚕豆酮等)杀死或有效抑制某些病原菌的生长发育。植物性杀菌剂多为复合抑菌有效成分,对病原真菌能从多方面加以抑制,从而延缓抗性的产生[19]。本试验结果表明,万寿菊杀菌素水乳剂对西瓜枯萎病菌菌丝生长有明显的抑制作用,与万寿菊根提取物有相同的抑菌效果[6],其中,当质量浓度为1 μg/mL时,杀菌素将病菌完全抑制,在72 h内抑菌率达100%。菌丝生长的抑制相应地降低了病害的程度,从而起到防治病害的作用。万寿菊杀菌素水乳剂可用于生产来防治西瓜枯萎病。
大量研究发现,植物在正常情况下,体内活性氧的产生和消除处于平衡状态,但在逆境胁迫下该平衡受到破坏,过剩的活性氧可导致蛋白质和其他细胞的损伤,严重时会导致植物细胞死亡[20]。活性氧在植物体内的消除则受细胞中包括SOD、POD及CAT在内的保护酶系统所控制,这些酶在清除自由基、H2O2和过氧化物,阻止或减少羟基自由基形成方面起着重要作用,且三者协同作用才可使自由基维持在一个较低水平[21]。在逆境中,植物能通过应激反应,激活抗氧化剂和诱导抗氧化酶的活性,但随着时间的延长,活性氧大量产生,SOD,POD和CAT活性下降,活性氧的产生和清除遭到破坏,植株不能正常生长。本试验结果表明,西瓜幼苗用毒素和孢子悬浮液处理后,植物通过应激反应使3种保护酶活性先迅速升高,但随着时间的延长又出现大幅下降,说明枯萎病菌可以通过破坏细胞保护酶类而伤害植株,但西瓜幼苗在经万寿菊杀菌素水乳剂处理后,SOD,POD,CAT这3种保护酶活性都比对照明显提高,且在96~120 h开始接近对照,同时在120 h的POD同工酶电泳图谱中只有西瓜枯萎病菌粗毒素液处理(A处理)检测到的谱带较对照少1条,且条带颜色偏浅,而B处理无明显不同。说明在万寿菊杀菌素水乳剂的作用下,植株提高了3种保护酶的活性,加强了对活性氧的清除,降低了病菌对植物体的伤害。
总之,万寿菊杀菌素水乳剂通过抑制枯萎病菌菌丝的生长和使植株提高过氧化物保护酶活性而降低病菌对植株的伤害程度,从而可起到防治病害的作用。关于在植物体内万寿菊杀菌素水乳剂如何抑制病菌,如何促进保护酶活性提高的机理还有待于进一步研究。
[1]于天祥,张明方.西瓜枯萎病研究进展 [J].中国西瓜甜瓜,2004(1):17-19.
[2]黄前晶.色素万寿菊主要病害种类及其防治[J].内蒙古农业科技,2010(6):103-104.
[3]王新国,徐汉虹,赵善欢.杀虫植物万寿菊的研究进展[J].西安联合大学学报,2002,5(2):5-10.
[4]Wells C,Mongin A.Astudyofphotosensitive insecticidal volatile compounds in marigold(Tagetes minum)[J].Journal of High Resolution Chromatography,1993,16(1):53-55.
[5]范志宏,郭春绒,王金胜.万寿菊杀菌素I抑菌作用及对西瓜幼苗的影响[J].山西农业科学,201l,39(1):61-63,66.
[6]李文英,刘贤谦,戴建青.万寿菊粗提物的抑菌作用初探[J].农药,2002,41(10):41-47.
[7]陈红兵,王金胜,张作刚,等.万寿菊根的提取物对西瓜枯萎病反应的抗性研究[J].植物病理学报,2003,33(5):439-443.
[8]宋炜.万寿菊根提取物对西瓜枯萎病的抑菌活性成分研究[D].太谷:山西农业大学,2005.
[9]刘佳斌,苏炜,王金胜.万寿菊根部生物碱类提取物抑菌活性成分的研究[J].安徽农业科学,2007,35(3):746-747.
[10]刘佳斌,苏炜,王金胜.万寿菊根部提取物黄酮对西瓜枯萎病菌抑制作用研究 [J].山西农业大学学报:自然科学版,2008,28(1):38-39.
[11]董晶剑,王金胜.万寿菊杀菌素水乳剂的研究[J].中国农业科学导报,2010,12(5):134-136.
[12]蒋细良,朱吕雄,谢德龄.农抗120防治西瓜枯萎病的机制[J].植物保护学报,1998,25(4):351-354.
[13]王金凌,许文旭.稻瘟病菌粗毒素制备及其对水稻毒性测定[J].福建农学院学报,1998,17(4):318-322.
[14]中国科学院上海植物生理研究所.现代植物生理学实验指南[M].北京:科学出版社,1999:314-315.
[15]王金胜.农业生物化学研究技术[M].北京:中国农业出版社,2001:234-235.
[16]高俊凤.植物生理学实验技术[M].北京:高等教育出版社,2006:214-215.
[17]中国科学院上海植物生理研究所.现代植物生理学实验指南[M].北京:科学出版社,1999:264-265.
[18]张兴.试论无公害农药 [J].西北农业大学学报,1995,23(6):90-95.
[19]范青山,肖小年,余世望.我国抗菌植物资源研究与开发利用[J].自然资源,1995(16):20-24.
[20]杜秀敏,殷文璇,赵彦修,等.植物中活性氧的产生和清除机制,2001,17(2):121-125.
[21]Baker CJ.Earlyresponses duringplant-bacteria interactions in tobaccocell suspensions[J].Phytopathol,1991,81:1504.

