高效分离纯化藻蓝蛋白新法
廖晓霞,张学武
(华南理工大学轻工与食品学院,广东广州510640)
高效分离纯化藻蓝蛋白新法
廖晓霞,张学武
(华南理工大学轻工与食品学院,广东广州510640)
采用壳聚糖亲和沉淀-活性炭吸附-DEAE Sephadex A-25柱层析三步法分离纯化藻蓝蛋白,与传统方法相比具有成本低、耗时短、操作便捷等优点。壳聚糖和活性炭结合使用,可使藻蓝蛋白纯度(A620/A280)由0.93提高至2.78。通过DEAE Sephadex A-25葡聚糖凝胶柱层析后,可得到高纯度藻蓝蛋白,纯度达4.3。纯化后的藻蓝蛋白经聚丙烯酰胺凝胶电泳(SDS-PAGE)鉴定,产生分子量分别为16.5ku和17.6ku的α,β亚基条带。吸收光谱和荧光发射光谱扫描表明所得蛋白在620、643nm分别具有藻蓝蛋白特征吸收峰和荧光发射峰。
藻蓝蛋白,壳聚糖,活性炭,纯化
藻蓝蛋白(PC)是一种普遍存在于蓝藻和螺旋藻细胞内的捕光色素蛋白,在螺旋藻中的含量高达7%~20%,在光合作用中能以近乎100%的高效率将光能优先传递给光系统[1]。藻蓝蛋白不仅在光合作用的原初反应机理的探索方面有重要意义,而且还可以作为荧光分子探针应用于生物医学研究,作为无毒副作用的天然色素蛋白,可取代合成染料应用于食品、化妆品以及医药中。有研究表明,藻蓝蛋白具有抗肿瘤活性,可提高免疫机能,其特性受到了国内外的重视,并已应用于老年痴呆症和帕金森症的治疗[2-4]。虽然藻蓝蛋白具有十分广阔的应用前景,但由于其分离纯化步骤繁琐,造成藻蓝蛋白商品价格昂贵,其应用受到了一定限制。藻蓝蛋白纯化过程的费用约占其成本的50%~90%[4],因此,解决问题的关键在于纯化方法的简化和高效性。传统的藻蓝蛋白纯化方法包括两大部分,首先进行细胞裂解以获取粗提物,常用超声、反复冻融、酶解和高压均质等方法。然后将硫酸铵沉淀法与多种色谱层析法(如羟基磷灰石柱、离子交换色谱、分子排阻色潽等)结合使用,达到分离纯化藻蓝蛋白的目的。传统方法的主要缺陷在于:a.采用超声或高压均质等机械法处理藻粉,能耗高;b.硫酸铵一步或多步沉淀蛋白法常需要1~2d的时间,而且容易造成蛋白变性,使目标蛋白损失率增大;c.传统方法常需要多步色谱纯化步骤,才能获取高纯度藻蓝蛋白,不仅耗时长,而且因色谱填料的昂贵造成纯化成本的骤增。近年来,涌现出一些取代传统方法的新工艺,比如双水相萃取技术。但双水相萃取法所用的聚乙二醇PEG与藻蓝蛋白可稳定结合,目前将藻蓝蛋白与PEG完全分离仍存在一定困难[5]。为了开发一种简单、高效的高纯度藻蓝蛋白分离方法,文中选取价格低廉、原料易得的壳聚糖及活性炭处理藻蓝蛋白粗提液,尝试用一步DEAE-Sephadex A-25柱层析法,制备高纯度的藻蓝蛋白。本方法为藻蓝蛋白的纯化技术提供了新思路,有助于促进我国藻蓝蛋白的规模化开发利用。
1 材料与方法
1.1 材料与仪器
螺旋藻粉 江门粤健生物工程有限公司;水溶性壳聚糖 浙江澳兴生物科技有限公司;活性炭
广州清宇活性炭公司;DEAE-Sephadex A-25 美国Pharmacia公司。
紫外可见分光光度计 日本岛津公司;自动分部收集器 上海沪西仪器厂;冷冻离心机 美国PE公司;荧光分光光度计 日本Hitachi公司;30ku超滤管 美国Millipore公司。
1.2 实验方法
1.2.1 藻蓝蛋白粗提液制备 称取1g螺旋藻粉,用去离子水洗涤3~5min,加入15mL 100mmol/L磷酸钾缓冲液(pH6.8),搅拌浸泡2h,浸提液以8000r/min冷冻离心8min,收集蓝色上清液。
1.2.2 藻蓝蛋白纯化 向藻蓝蛋白粗提液中加入一定量2%(w/v)的壳聚糖溶液,调节pH至6.9,搅拌5min,离心弃去沉淀,向清液中加入一定量活性炭搅拌5min,离心取上清液。上清液用30ku超滤管超滤浓缩,浓缩液用适量10mmol/L磷酸钾缓冲液(pH6.8,含0.1mol/L氯化钠)溶解,再用超滤管超滤浓缩至一定体积以备柱层析使用。用10mmol/L磷酸钾缓冲液(含0.1mol/L氯化钠)预平衡DEAESephadex A-25层析柱,上样,以10mmol/L磷酸钾缓冲液(pH6.8,含0.1~0.3mol/L氯化钠)梯度洗脱,流速为0.7mL/min,每3min收集1管,测定每管在280、620nm处的吸收值。
1.2.3 藻蓝蛋白光谱分析 用UV-2450分光光度计进行吸收光谱全波长扫描,F-4500荧光分光光度计扫描荧光光谱。
1.2.4 SDS-PAGE电泳 采用垂直板不连续电泳系统,分离胶浓度为15%,浓缩胶浓度为5%。样品在浓缩胶中电泳电压为80V,进入分离胶后电压为120V;剥胶后,以0.1%考马斯亮蓝R-250染色,用含30%甲醇的10%乙酸脱色。
1.2.5 藻蓝蛋白得率和纯度测定方法 根据Alka等[4]采用的方法测定藻蓝蛋白含量:[PC]=(A620-0.7A650)/7.38;藻蓝蛋白得率(Y)计算方法:Y=[PC]a×Va×100/([PC]b×Vb);藻蓝蛋白纯度以A620/A280表示;式中:[PC]代表藻蓝蛋白的浓度(mg/mL),A620、A650分别代表藻蓝蛋白溶液在 620、650nm处的吸光度,a、b分别代表所进行的纯化步骤所得藻蓝蛋白溶液和藻蓝蛋白粗提液,V代表溶液体积。
2 结果与分析
2.1 壳聚糖亲和沉淀条件的优化
壳聚糖由于末端氨基质子化,是一种对pH相当敏感的聚合物,在pH小于6.5时可溶解,但pH大于6.5时,壳聚糖能与一般带负电荷的蛋白质产生较强的吸附作用而沉淀[6],可以通过调节pH使壳聚糖与杂质蛋白亲和沉淀,进而达到分离纯化目的蛋白的最佳效果。溶液的pH及壳聚糖加入量的控制是壳聚糖亲和沉淀纯化藻蓝蛋白的关键,因此有必要对亲和沉淀条件进行摸索和优化。由图1可知,在藻蓝蛋白粗提液中加入0.33%(w/w)壳聚糖时,调节溶液pH至6.9,就可有效纯化藻蓝蛋白,纯度由0.93提高至1.3,而藻蓝蛋白的得率可达95%。当pH>6.9时,藻蓝蛋白纯度和得率均有下降趋势,溶液颜色也由亮蓝色逐渐转为较灰暗的蓝色。壳聚糖与蛋白质之间主要是静电作用,即根据它们酸碱性、极性的差异,通过离子间的吸附和脱吸附而将电解质各组分分开[7]。溶液pH越高,壳聚糖与蛋白质之间的吸附作用越强烈,此时选择性吸附越差。当pH为6.9时,壳聚糖与一部分杂质蛋白吸附沉淀,而与藻蓝蛋白之间的静电作用较弱,使大部分藻蓝蛋白仍保留在溶液中,从而起到纯化的作用。由图2可知,溶液pH为6.9时,仅加入0.29%的壳聚糖,就可达到提高藻蓝蛋白纯度的效果,纯度可由粗提液的0.93提高至1.52,而藻蓝蛋白的得率仍可维持在90%以上。因此,要根据所纯化的目标物来确定pH和壳聚糖加入量。与传统的硫酸沉淀法相比,壳聚糖沉淀法耗时短,只需几分钟即可达到与硫酸铵法[8]相当的效果,而且产品得率高,条件温和,不易造成蛋白质变性。

图1 pH对藻蓝蛋白纯度和得率的影响注:壳聚糖浓度0.33%(w/w)。
2.2 活性炭吸附条件的优化
活性炭(粉炭)有巨大的比表面积,其成本低,使用方法简单,且不会影响提取物的生物活性。目前,国内使用活性炭进行脱色、除味等方面的报道较多,而用活性炭纯化藻蓝蛋白的研究未见报道。由于活性炭具有很强的吸附能力,处理条件的不同,对纯化效果及产品回收率具有较大影响。实验中发现用活性炭处理藻蓝蛋白粗提液5min,即可达到纯化藻蓝蛋白的效果,而延长处理时间,不但不能使纯度进一步提高,反而对藻蓝蛋白的得率影响较大,因此本实验选择活性炭处理时间为5min,并进一步确定活性炭加入量对纯化效果的影响。由图3可知,随着活性炭加入量的增加,藻蓝蛋白纯度可达到一个最大值,而蛋白得率则逐渐下降。综合考虑得率和纯度两个因素,确定最佳活性炭加入量为80g/L,此时藻蓝蛋白纯度可由1.52提高至2.7,得率为85%。活性炭吸附可以除去色素及部分低分子量蛋白,所得溶液为清亮的蓝色,为进一步提高藻蓝蛋白纯度奠定基础。与DEAE-52纤维素柱层析法[9]相比,纯化效果相当,但该法具有成本低、操作简便快捷、产品回收率高等优势。

图3 活性炭浓度对藻蓝蛋白纯度和得率的影响
2.3 DEAE-Sephadex A-25柱层析分离
DEAE-Sephadex系列柱料是研究者常采用的纯化藻蓝蛋白的填料之一,但一般需要多种色谱串联使用,才能获得高纯度藻蓝蛋白[10-11]。采用上述所确定的最佳条件纯化藻蓝蛋白,所得藻蓝蛋白纯度为2.78。将所得蛋白溶液超滤浓缩至一定体积,上样后,以磷酸钾缓冲液洗脱,结果见图4。经紫外可见分光光度计检测发现,目标组分藻蓝蛋白主要集中在第一洗脱峰,第二洗脱峰主要为别藻蓝蛋白,同时含有少量藻蓝蛋白。合并A620/A280>4.0的洗脱液,超滤管浓缩脱盐后,紫外可见分光光度计检测表明所得藻蓝蛋白纯度(A620/A280)为4.3,符合国际认可的高纯度藻蓝蛋白要求[12](A620/A280>4.0)。由此可见,经过壳聚糖沉淀和活性炭吸附后,一步色谱法即可获得高纯度藻蓝蛋白,减少了色谱填料的费用。与纯化藻蓝蛋白常用的羟基磷灰石吸附技术相比,DEAE-Sephadex A-25色谱法具有流速快、回收率高等优点。此外,因藻蓝蛋白在第一洗脱峰即能够分离出,可以节省洗脱时间,提高纯化效率。

图4 藻蓝蛋白经DEAE Sephadex A-25凝胶层析洗脱曲线
2.4 藻蓝蛋白光谱特性
由图5可知,纯化后的藻蓝蛋白在620、348、280nm附近有特征吸收峰,在620nm处有藻蓝蛋白的最大特征吸收峰。280nm处的吸收峰为蛋白中芳香族氨基酸的吸收,一般由酪氨酸和色氨酸残基的苯环引起的光吸收,360nm处的较弱吸收峰可能是来自蛋白中二硫键的光吸收。如果藻蓝蛋白变性,其荧光会减弱或消失,因此把荧光光谱作为鉴定藻蓝蛋白活性的指标之一。由图6可知,在643nm处有藻蓝蛋白特征荧光发射峰(激发波长为590nm),与国内外文献报道一致[13-14],可见分离得到了具有活性的藻蓝蛋白。
2.5 SDS-PAGE电泳
将纯化各步骤所得的藻蓝蛋白进行SDS-PAGE电泳,由图7可知,经壳聚糖和活性炭处理后,杂质蛋白逐渐被除去,经过DEAE Sephadex A-25柱层析分离后的藻蓝蛋白可达到电泳级别纯度,藻蓝蛋白样品在14ku和20ku之间出现两条带,与文献报道符合[15],为α和β亚基,大小分别为16.5ku和17.6ku。
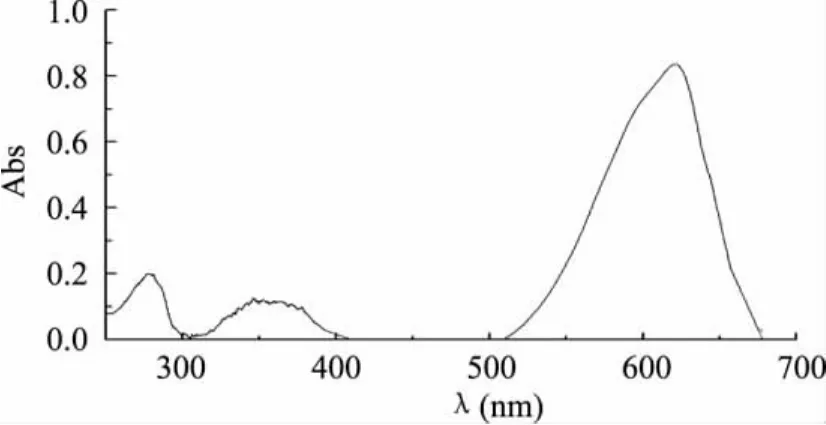
图5 纯化后藻蓝蛋白的紫外-可见吸收光谱图
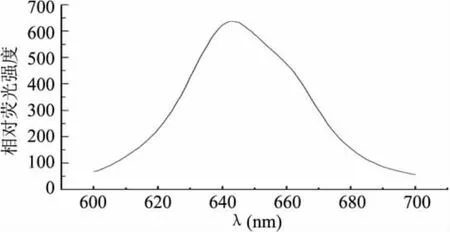
图6 纯化后藻蓝蛋白的荧光发射光谱图
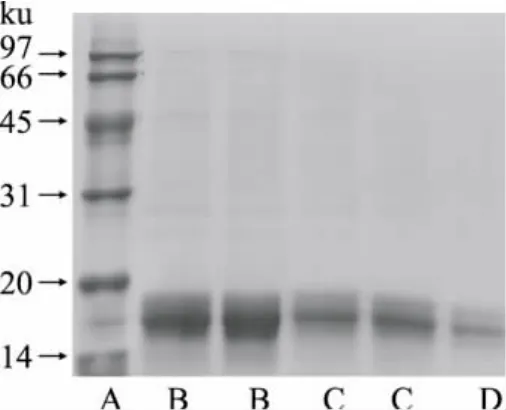
图7 SDS-PAGE电泳图
3 结论
针对当前藻蓝蛋白纯化成本高和商品价格贵的现状,开发出一套高效简便的藻蓝蛋白纯化技术。本方法主要操作参数为:藻蓝蛋白粗提液中加入0.29%壳聚糖,调节pH至6.9,搅拌5min后,离心弃沉淀,向上清液中加入80g/L活性炭吸附5min,离心,超滤浓缩上清液,采用DEAE Sephadex A-25柱层析法,以10mmol/L磷酸钾缓冲液(pH6.8)+0.1~0.3mol/L氯化钠梯度洗脱得高纯度藻蓝蛋白(纯度达4.3)。与传统方法相比,壳聚糖亲和沉淀-活性炭吸附-DEAE Sephadex A-25柱层析法具有五个优点:a.纯化步骤少,前处理简便;b.能耗小,无需超声破碎及高压均质;c.成本低,所用活性炭和壳聚糖价格便宜,一步色谱法减少了填料成本;d.耗时短,无需硫酸铵沉淀步骤,整个过程只需2d即可完成;e.操作简便,具有规模化应用的潜力。
[1]陶冉,位正鹏,崔蓉,等.藻类色素蛋白的资源开发和应用研究[J].食品工业科技,2010,31(4):377-379.
[2]AMPARO R,CYNTHIA V,RUPERTO B,et al.Large-scale isolation and purification of C-phycocyanin fromthe cyanobacteria Anabaenamarina using expanded bed adsorption chromatography[J].J Chem Technol Biotechnol,2010,85:783-792.
[3]CHIU H F,YANG S P,KUO Y L,et al.Mechanisms involved in the antiplatelet effect of C-phycocyanin[J].Br J Nutr,2006,95:435-440.
[4]ALKA G,JAYASHREE K.Isolation of C-phycocyanin from Synechococcus sp.,(Anacystis nidulans BD1)[J].J Appl Phycol,2009,10:92-94.
[5]KALYANI M,MUNISHWAR N G,IPSITA R.Affinity-Based Strategies for protein purification[J].American Chemical Society,2006,34:99-104.
[6]TYAGI R,KUMAR A,SARDAR M,et al.Chitosan as an affinity macroligand for precipitation of N-acetyl glucosamine binding proteins/enzymes[J].Iso Purif,1996(2):217-226.
[7]夏金兰,李二平,聂珍媛,等.硅藻土和壳聚糖纯化藻蓝蛋白及产品性质研究[J].天然产物研究与开发,2006,18(6):905-909.
[8]李春霞,吴淑贤,蔡春尔,等.条斑紫菜藻红、藻蓝蛋白逐级放大的纯化工艺[J].中国生物工程杂志,2010,30(1):67-72.
[9]杨芳,郭振江,白燕,等.藻蓝蛋白原位还原Ag(Ⅰ)与纳米Ag(0)形成动态过程的谱学研究[J].光谱学与光谱分析,2007,27(1):23-27.
[10]CHEN T F,WONG Y S,ZHENG W J.Purification and characterizationofselenium-containingphycocyanin from selenium-enriched Spirulina platensis[J].Phytochemistry,2006,67:2424-2430.
[11]REISFL A,MENDES A,LOBO - FERNANDES,et al.Production,Extraction and Purification of Phycobiliproteins from Nostoc sp[J].Bioresource Technology,1998,66:181-187.
[12]GANAPATHI P,CHETHANA A,SRIDEVI S A,et al.Method to obtain C-phycocyanin of high purity[J].Journal of Chromatography A,2006,1127:76-81.
[13]NIELS T E.Production of phycocyanin—a pigment with applications in biology,biotechnology,foods and medicine[J].Appl Microbial Biotechnol,2008,80:1-14.
[14]BOUSSIBA S, RICHMOND A E.Isolation and characterization of phycocyanins from the blue-green alga Spirulina platensis[J].Arch Microbial,1979,120:155-159.
[15]王广策,邓田,曾呈奎.钝顶螺旋藻C-藻蓝蛋白和异藻蓝蛋白能量传递模型的构建[J].科学通报,2000,24(2):22-25.
New method for efficient separation and purification of C-phycocyanin
LIAO Xiao-xia,ZHANG Xue-wu
(College of Light Industry and Food Science,South China University of Technology,Guangzhou 510640,China)
An efficient method was developed for the purification of C-phycocyanin(C-PC),which involved three steps:chitosan affinity precipitation,activated charcoal absorption and DEAE Sephadex A-25 chromatography.As compared with conventional methods,this method was cheap,time-saving and easy to operate.The purity(A620/A280)of C-phycocyanin obtained after chitosan-activated charcoal treatment was increased from 0.93 to 2.78,which could be improved to 4.3 after being subjected to DEAE Sephadex A-25 chromatography.Analyzed by SDS-PAGE electrophoresis,phycocyanin migrated as two bands corresponding to its two subunits(α and β)and the molecular weights were 16.5ku and 17.6ku,respectively.The absorption spectra and fluorescence emission specra of purified protein showed peaks at 620nm and 643nm,respectively,which was characteristic of C-phycocyanin.
C-phycocyanin;chitosan;activated charcoal;purification
TS254.1
B
1002-0306(2011)06-0273-04
2010-06-03
廖晓霞(1986-),女,硕士,研究方向:天然活性蛋白质研究。基金项目:广东省教育部产学研结合项目(2009B090300271)。

