对强碱弱酸盐溶液酸碱性的探究
王光荣
(蚌埠学院应用化学与环境工程系,安徽 蚌埠 233030)
对强碱弱酸盐溶液酸碱性的探究
王光荣
(蚌埠学院应用化学与环境工程系,安徽 蚌埠 233030)
为了解强碱弱酸盐溶液的酸碱性,运用酸碱质子理论进行理论分析,并使用pH计对该类盐溶液的pH值进行验证。结果表明,强碱弱酸盐溶液浓度C=0.10mol/L时,一元强碱与一元弱酸生成的正盐溶液均呈碱性;一元强碱与多元弱酸生成的酸式盐中,偏向于给予质子(H+)的强碱弱酸酸式盐溶液呈酸性,偏向于接受质子(H+)的强碱弱酸酸式盐溶液呈碱性;一元强碱与多元弱酸生成的正盐水溶液均呈碱性。
强碱弱酸盐;酸碱性;探究
强碱弱酸盐是强碱和弱酸反应生成的盐,关于强碱弱酸盐水溶液的酸碱性,在我国全日制高中化学教材中是这样阐述的:“在一般情况下,强碱弱酸盐的水溶液呈碱性……”[1],这里所说的“一般情况下”是指什么情况?该类盐的水溶液是否都呈碱性?针对该问题,笔者运用酸碱质子理论对强碱弱酸盐水溶液的酸碱性进行理论分析,并使用pH计对这类盐溶液的pH值进行验证。
1 强碱弱酸盐水溶液pH值计算
1.1一元强碱与一元弱酸完全中和生成正盐水溶液
该类盐在溶液中只能接受质子(H+),例如,NaAc、HCOONa、C6H5COONa、NaF等。现以浓度C=0.10mol/L的NaAc溶液为例,对该类正盐溶液的酸碱性进行分析。
已知,HAc的解离常数为KHAc=10-4.74,NaAc水解反应式为:


式中,Kb为Ac-的解离常数;Kw为水的离子积。
由于:


同理可以算出其他一元强碱与一元弱酸完全中和生成正盐的水溶液的pH值,运用归纳法可以得出一个普遍性结论,即一元强碱与一元弱酸完全中和生成正盐水溶液均呈碱性。
1.2一元强碱与多元弱酸生成的盐水溶液
1)强碱弱酸酸式盐 该类盐在溶液中既能给予质子(H+)又可以接受质子(H+),属于两性物质,具体包括2类盐:①偏向于给予质子(H+)的强碱弱酸酸式盐。②偏向于接受质子(H+)的强碱弱酸酸式盐。
以0.10mol/L NaH2PO4溶液的pH值计算为例,对①类酸式盐溶液的酸碱性进行分析。已知H3PO4的解离常数Ka1=10-2.12,Ka2=10-7.20,Ka3=10-12.36,NaH2PO4为两性物质,其给质子(H+)能力强于接受质子(H+)的能力。
由于:


图1 磷酸溶液中各种存在形式的分布系数与溶液pH的关系曲线
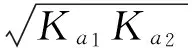
以0.10mol/L Na2HPO4水溶液pH值计算为例,对②类酸式盐溶液的酸碱性进行分析。Na2HPO4也是两性物质,但是其受质子(H+)能力强于给质子(H+)的能力。由于:

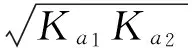
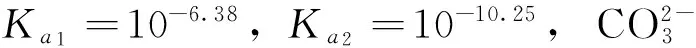

由于Kb1≫Kb2,可按一元弱碱计算。
又由于:


2 强碱弱酸生成的盐的水溶液pH值的测定
分别配制0.10mol/L的各种强碱弱酸盐溶液100.00ml,使用pHS-2C型酸度计对其pH值进行测定,并将测定结果与计算值进行比较,结果如表1所示。

表1 各种强碱弱酸盐溶液pH值计算值与测定值比较
由表1可知,一元强碱与一元弱酸完全中和生成正盐水溶液呈碱性;一元强碱与多元弱酸生成的酸式盐中,偏向于给予质子(H+)的强碱弱酸酸式盐溶液呈酸性,偏向于接受质子(H+)的强碱弱酸酸式盐溶液呈碱性,对于一元强碱与多元弱酸生成的正盐水溶液呈碱性。
[1]人民教育出版社化学室.全日制普通高级中学化学教科书[M].北京:人民教育出版社,2005.
[2] 华东理工大学分析化学教研组.分析化学[M].北京:高等教育出版社,2010.
[编辑] 李启栋
10.3969/j.issn.1673-1409.2011.11.017
N4
A
1673-1409(2011)11-0052-03

