卡托普利对MC3T3-E1细胞增殖、分化及Ⅰ型胶原mRNA表达的影响
刘钰瑜,姚卫民,徐道华,崔 燎
卡托普利(captopril,CPT)属于血管紧张素Ⅰ转换酶抑制药,通过作用于肾素—血管紧张素—醛固酮(renin-angiotensin aldosterone system,RAAS)系统,阻断血管紧张素Ⅱ的强烈缩血管作用而抗高血压。RAAS在心血管疾病与骨质疏松之间可能存在着相关联的分子机制。体内外实验发现CPT具有抗骨质疏松作用,可增加维甲酸性骨质疏松小鼠股骨的骨钙和骨羟脯氨酸的含量,对去卵巢大鼠的生物力学性能有改善作用,也有促进成骨细胞分化的作用[1-2],但目前关于ACEI能否用于骨质疏松的防治尚无定论。本实验通过体外细胞培养,观察CPT对成骨细胞样细胞增殖、分化和Ⅰ型胶原mRNA表达的作用,为探讨CPT的防治骨质疏松作用提供进一步体外实验依据。
1 材料与方法
1.1 试剂和仪器 DMEM培养基(Gibco公司);胰蛋白酶、MTT、前列腺素E2(Sigma公司);卡托普利标准品(ALEXIS公司);碱性磷酸酶检测试剂盒(北京中生生物公司)、Access RT-PCR试剂盒(Invitrogen公司)。NAPCO二氧化碳恒温培养箱(5420-1,Precision Scientific美国);XD-101倒置相差显微镜(江南光电股份有限公司);酶标仪:Bio-ELX-800型,USA;9600Gen Amp PCR System(美国PE公司);DYY-5型稳压稳流电泳仪,WD-9403C型紫外分析仪(北京六一仪器厂)。RT-PCR选用β-肌动蛋白(β-actin)为内参照,引物由上海生物工程公司合成,序列见Tab 1。
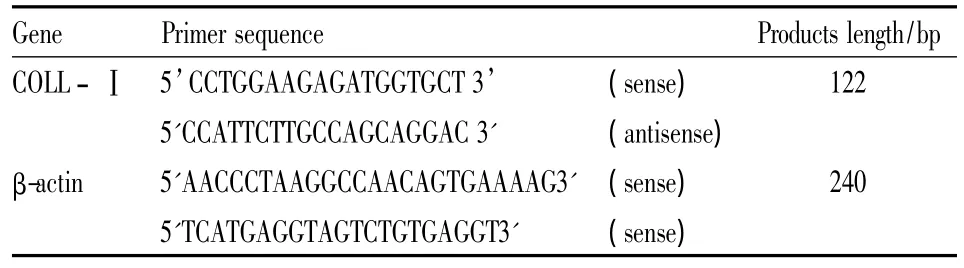
Tab 1 Primer sequence of COLL-Ⅰand β-actin
1.2 方法
1.2.1 MTT法测定MC3T3-E1细胞的增殖 细胞以2×104/cm2的密度接种入96孔板,第一孔为空白调零。细胞接种24h后加入不同浓度的卡托普利,使终浓度分别是:10-12、10-11、10-10mol·L-1;阳性对照组用前列腺素E2(终浓度是10-7mol·L-1);同时以溶剂作为对照组。于加药后12、24、36 h进行检测,实验结束前4 h加20 μl的MTT(5 g·L-1),继续在37℃,5%CO2条件下孵育4 h,吸取培养液后加二甲基亚砜0.15 ml,振摇至结晶完全溶解,于酶标仪检测其吸光度,检测波长570 nm,参考波长630 nm。
1.2.2 PNPP法测定MC3T3-E1细胞碱性磷酸酶(ALP)活性 细胞接种24 h后加药,加药方法同前。于药物作用d 3、d 5、d 7测定细胞碱性磷酸酶含量。测定时,去掉培养液,PBS冲洗,然后加入碱性磷酸酶检测试剂盒中新鲜配制的底物100 μl,37℃放置0.5 h,然后用0.1 mol·L-1的 NaOH 100 μl终止反应,在酶标仪于405 nm波长下测定OD值。样品OD值在ALP标准曲线上读取酶活性值(U·L-1)。
1.2.3 逆转录聚合酶链反应(RT-PCR)测定Ⅰ型胶原mRNA的表达 细胞按2×104·cm-2接种于6孔板,24 h后加入不同浓度的药物,卡托普利的终浓度为 10-13、10-12、10-11、10-10mol·L-1,前列腺素E2的终浓度是10-7mol·L-1。培养7 d后,按照TRIzol试剂盒说明进行总RNA的抽提。反应条件为50℃逆转录30 min,94℃预变性2 min,94℃变性30 s,54℃退火 30 s,70℃延伸 45 s,35 个循环,最后一个循环72℃延伸8 min。PCR产物于2%琼脂糖凝胶电泳,溴化乙锭染色,紫外灯下观察并拍照。以Bandscan程序对图片行总灰度扫描,与对应的β-actin的电泳带总灰度的比值为半定量结果(相对值)。1.3统计学处理 计量资料以±s表示。SPSS11.0软件行方差分析并进行Bonferroni组间比较。
2 结果
2.1 卡托普利对MC3T3-E1细胞增殖的影响 用不含血清的培养液培养细胞,随着培养时间的延长,各组细胞数目逐渐下降。与对照组相比,在24 h,卡托普利10-12和10-11mol·L-12个浓度可促进细胞的增殖。在36 h,卡托普利10-12和10-11mol·L-1浓度仍可促进细胞的增殖,但作用不如24 h明显。与对照组相比,前列腺素E2在用药后36 h对细胞增殖有明显的促进作用。见Tab 2。
Tab 2 Effects of captopril on cell growth in MC3T3-E1 cells(±s,n=8)

Tab 2 Effects of captopril on cell growth in MC3T3-E1 cells(±s,n=8)
*P <0.05,**P <0.01 vs control
Group 12 h 24 h 36 h Control 0.197±0.023 0.130±0.008 0.116±0.017 PGE210-7mol·L-1 0.218±0.017 0.159±0.009 0.169±0.015**Captopril 10-12mol·L-1 0.196±0.016 0.171±0.013** 0.148±0.014*Captopril 10-11mol·L-1 0.220±0.018 0.201±0.018** 0.172±0.019**Captopril 10-10mol·L-10.201±0.015 0.161±0.019 0.128±0.019
2.2 卡托普利对 MC3T3-E1细胞碱性磷酸酶(ALP)活性的影响 用含1%胎牛血清的培养液培养细胞随着培养时间的延长,各组细胞ALP含量逐渐增高,在d 5时达最高值,随后下降。与对照组相比,卡托普利在d 3和d 5能提高细胞碱性磷酸酶活性。在d 3,卡托普利10-11和10-10mol·L-1两个浓度可提高细胞碱性磷酸酶活性。在d 5,卡托普利10-11mol·L-1浓度仍可提高成骨细胞碱性磷酸酶活性,但作用不如3 d时明显。与对照组相比,前列腺素E2在d 3至d 5对细胞碱性磷酸酶活性均有明显的提高作用,见Tab 3。
2.3 卡托普利对MC3T3-E1细胞Ⅰ型胶原(Type I Collagen,COLL-Ⅰ)基因表达水平的影响 与对照组相比,加药后7 d,10-7mol·L-1前列腺素和10-12mol·L-1~10-10mol·L-1浓度的卡托普利可促进MC3T3-E1细胞表达COLL-Ⅰ,其中10-11mol·L-1浓度的卡托普利有较强的促进COLL-Ⅰ表达的作用,但是该作用较阳性药物前列腺素弱,见Fig 1。
Tab 3 Effects of captopril on the ALP activities(U·L-1)in MC3T3-E1 cells(±s,n=8)
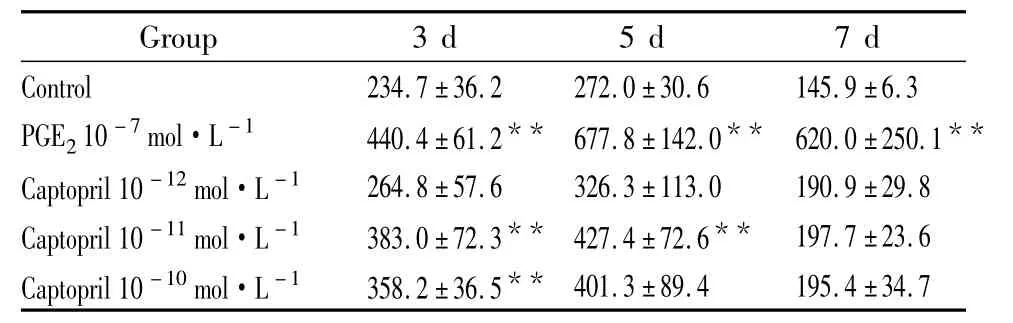
Tab 3 Effects of captopril on the ALP activities(U·L-1)in MC3T3-E1 cells(±s,n=8)
**P<0.01 vs control
Group 3 d 5 d 7 d Control 234.7±36.2 272.0±30.6 145.9±6.3 PGE210-7mol·L-1 440.4±61.2** 677.8±142.0** 620.0±250.1**Captopril 10-12mol·L-1 264.8±57.6 326.3±113.0 190.9±29.8 Captopril 10-11mol·L-1 383.0±72.3** 427.4±72.6** 197.7±23.6 Captopril 10-10mol·L-1 358.2±36.5**401.3±89.4 195.4±34.7

Fig 1 Effects of captopril on the COLL-ⅠmRNA expression in MC3T3-E1 cells
3 讨论
目前研究表明高血压与骨质疏松密切相关,很多心血管疾病的患者,往往同时伴有骨质疏松,所以我们在使用心血管系统药物治疗这些人群心血管疾病的同时,须注意到药物对骨量的影响。在临床用药中也发现很多作用于心血管系统的药物有改变骨量的作用,并影响到病人骨折的发生率。RAAS在心血管疾病与骨质疏松之间可能存在着相关联的分子机制。在转基因小鼠实验看到,表达人类肾素基因的小鼠肾素高表达后,小鼠血压正常,但是由于RAAS的激活,导致骨量减少,所以认为该系统对骨骼系统的影响,导致骨质疏松的发生甚至可不依赖于高血压的发生而独立出现[3]。体内实验证实成骨细胞和破骨细胞都可以合成和表达血管紧张素转化酶、血管紧张素受体等RAAS的各组分[4],虽然骨骼系统局部的RAAS对骨量的影响还没有完全阐明[5],但体外实验已经证实血管紧张素Ⅱ可以抑制成骨细胞的分化和骨形成[6]。目前一般认为RAAS可调节骨吸收,血管紧张素Ⅰ和血管紧张素Ⅱ被认为是强烈的骨吸收促进剂,一些血管紧张素转化酶抑制药通过减少血管紧张素Ⅱ的生成减少骨吸收,而且体外实验研究表明这类药物抑制骨吸收的作用并不是直接地抑制破骨细胞,而是通过作用于成骨细胞,从而发挥抑制破骨细胞作用的[7]。体内实验中我们发现血管紧张素转化酶抑制药卡托普利(5 mg·kg-1·d-1)能改善老年去卵巢大鼠的生物力学性能[1],卡托普利(6.25 mg·kg-1·d-1)可增加维甲酸性骨质疏松小鼠股骨的骨钙和骨羟脯氨酸的含量[2]。为进一步探讨卡托普利的促成骨作用,本实验观察卡托普利对成骨样细胞的作用,并与阳性药物前列腺素E2进行比较。成骨细胞(osteoblast)是骨形成过程中最重要的功能细胞,它不仅分泌骨基质参与成骨,同时也参与破骨细胞骨吸收功能的调节,因此在骨代谢过程中起着极为重要的作用。结果显示前列腺素E2可促进MC3T3-E1细胞增殖,前列腺素E2是一个已被公认的促进成骨细胞增殖的工具药[8],可通过激活蛋白酶 C,促进 DNA合成[9]。卡托普利有类似前列腺素E2的促进MC3T3-E1细胞增殖的作用,成骨细胞数量的不断增加可以产生丰富的胶原,从而通过钙化基质的形成产生更多的骨组织。卡托普利除刺激细胞增殖外,还可促进碱性磷酸酶的表达。碱性磷酸酶的表达是成骨细胞分化的主要特征之一,是成熟成骨细胞的标志,其活性的高低可反映成骨细胞的成熟状况,还在新骨形成中发挥着钙结合蛋白的作用。卡托普利可促进细胞表达碱性磷酸酶,说明其有促进成骨细胞分化的作用。前列腺素E2也有很强的促进碱性磷酸酶表达的作用。有研究表明低浓度的前列腺素E2可通过促进cAMP的合成提高ALP的活性[10]。卡托普利对成骨细胞Ⅰ型胶原基因的表达有促进作用,Ⅰ型胶原蛋白是成骨细胞分化的特征之一,是构成骨骼有机基质的主要成分,占骨有机基质90%以上,Ⅰ型胶原在成骨细胞增殖早期已经开始表达,并随着基质成熟而逐渐增加,其表达与骨形成活性密切相关。在矿化期大量形成的Ⅰ型胶原可作为羟基磷灰石结晶的异质晶核,在生物矿化中起一定作用,从而维持骨组织的完整和强度。有研究表明前列腺素E2对胶原合成有促进作用[11],本实验用前列腺素E2作为阳性药也证实了这点,同时提示卡托普利对Ⅰ型胶原基因表达也有促进作用,但比前列腺素E2弱。
综上所述,本实验初步证实卡托普利有促进成骨细胞样细胞增殖、分化和促进Ⅰ型胶原基因表达,为卡托普利用于骨质疏松的防治提供体外实验的依据。
[1]Liu Y Y,Yao W M,Wu T,et al.Captopril improves osteopenia in ovariectomized rats and promotes bone formation in osteoblasts[J].J Bone Miner Metab,2011,29(2):149-58.
[2]陈 方,吴 铁,崔 燎,等.卡托普利抗小鼠维甲酸性骨质疏松的作用探讨[J].中国药理学通报,2002,18(5):572-575.
[2]Chen F,Wu T,Cui L,et al.A study on captopril antagonized osteoporosis induced by retinoic acid in mice and its dose-response effects[J].Chin Pharmacol Bull,2002,18(5):572-5.
[3]Asaba Y,Ito M,Fumoto T,et al.Activation of renin-angiotensin system induces osteoporosis independently of hypertension[J].J Bone Miner Res,2009,24(2):241-50.
[4]Izu Y,Mizoguchi F,Kawamata A,et al.AngiotensinⅡtype 2 receptor blockade increases bone mass[J].J Biol Chem,2009,284(8):4857-64.
[5]Nakagami H,Osako M K,Shimizu H,et al.Potential contribution of action of renin angiotensin system to bone metabolism[J].Curr Hypertens Rev,2007,3(2):129-32.
[6]Schurman S J,Bergstrom W H,Shoemaker L R,et al.AngiotensinⅡreduces calcium uptake into bone[J].Pediatr Nephrol,2004,19(1):33-5.
[7]Hatton R,Stimpel M,Chambers T J.Angiotensin Ⅱ is generated from angiotensin I by bone cells and stimulates osteoclastic bone resorption in vitro[J].J Endocrinol,1997,152(1):5-10.
[8]Tang L Y,Kimmel D B,Jee W S,et al.Functional characterization of prostaglandin E2inducible osteogenic colony forming units in cultures of cells isolated from the neonatal rat calvarium[J].J Celllul Physiol,1996,166(1):76-83
[9]Chyun Y S,Raisz L G.Stimulation of bone formation by prostaglandin E2[J].Prostaglandins,1984,27(1):97-103.
[10]Hakeda Y,Nakatani Y,Hiramatsu M,et al.Inductive effects of prostaglandins on alkaline phosphatase in osteoblastic cells,clone MC3T3-E1[J].J Biochem(Tokyo),1985,97(1):97-104.
[11]Raisz L G,Fall P M,Gabbitas B Y,et al.Effects of prostaglandin E2on bone formation in cultured fetal rat calvariae:role of insulinlike growth factor-I[J].Endocrinology,1993,133(4):1504-10.

