聚乙烯醇-海藻酸钙固定化柚苷酶
雷生姣,王可兴,吕晓燕,潘思轶*
(华中农业大学 食品科学技术学院,湖北 武汉 430070)
生物工程作为新技术革命的前沿发展领域,将在人类社会的可持续发展中发挥重要作用,而酶的固定化及酶促反应是最具发展前景的生物技术工程[1]。固定化酶技术除具有酶催化反应特性外,还能在一定程度上解决酶稳定性和重复利用等问题,可适应工业化批量生产的要求。作为生物催化剂,固定化酶已被广泛应用于化学、制药以及食品工业,因而固定化酶载体的开发和利用显得尤为重要[2]。聚乙烯醇(PVA)是一种新型的固定化载体,具有机械强度高、稳定性好、价格低廉等优点,但由于其具有极强的附聚性,使得其凝胶在制备凝胶珠体时比较困难,不易成型。另一种被广泛应用的固定化酶载体——海藻酸钙凝胶含水率高,成形简单容易,但其网络的孔隙尺寸太大且凝胶珠机械强度较差,重复使用率不高。如果将两者进行优势互补,采用复合法制备凝胶,则复合凝胶能满足优质固定化载体的要求[3]。
柚苷酶(EC3.2.1.40)具有α-L-鼠李糖苷酶和β-D-葡萄糖苷酶的活性,是一种胞外酶,在pH2.5~6.0具有实用活性,40℃以下活性较高[4]。用于生产柚苷酶的真菌主要为曲霉属和青霉属。2000年,Zverlov等[5]将编码α-L-鼠李糖苷酶的基因进行克隆并导入埃希氏大肠杆菌(Escherichia coli)中,该基因在埃希氏大肠杆菌中成功的进行了表达。重组技术使得柚苷酶更易获得且更经济,在食品工业和制药工业将获得更大的用途。柚苷酶中的α-L-鼠李糖苷酶能将柑橘汁中的苦味物质——柚皮苷水解为鼠李糖和普鲁宁(苦味约为柚皮苷的三分之一),而普鲁宁在β-D-葡萄糖苷酶的作用下能被水解成柚皮素(无苦味)和葡萄糖。国外已有一些报道将柚苷酶固定在不同的载体上后应用于柑橘汁的脱苦[6-8]和增加葡萄酒的风味[9],并取得了一定的效果。我国对柚苷酶的研究起步较晚,且主要集中在对柚苷酶产生菌的选育与筛选上[10-12],对其在食品工业中的应用研究较少,对其固定化的研究处于起步阶段。
本实验以聚乙烯醇和海藻酸钙为载体,戊二醛为交联剂,采用延时包埋法[13],制备性质稳定的固定化柚苷酶聚乙烯醇凝珠。针对该载体的结构特点,对固定化酶载体制备条件的优化进行考察,同时对固定化酶与游离酶的性质进行比较研究,为固定化柚苷酶的工业化应用提供参考。
1 材料与方法
1.1 材料与试剂
柚苷酶(CAS 号:9068-31-9)、柚皮苷(HLPC 98%)美国Sigma-Aldrich公司;聚乙烯醇((1750±50)u)、一缩二乙二醇(DEG)(化学纯) 国药集团化学试剂有限公司;海藻酸钠(化学纯) 上海化学试剂分装厂。
1.2 仪器与设备
S-3000N型扫描电镜 日本Hitachi公司;UV-7504型紫外-可见分光光度计 上海光谱仪器有限公司;410A型pH计 美国Thermo Orion公司;HHS-型恒温水浴锅 国华电器有限公司;恒温振荡器 金坛市杰瑞尔电器有限公司。
1.3 方法
1.3.1 柚苷酶活力的测定
游离酶活力测定[14]:5mL具塞试管中加入0.6mL底物柚皮苷(500μg/mL)和0.3mL醋酸缓冲液(0.2mol/L,pH4.0),在60℃的恒温水浴锅中保温5min后立即加入0.1mL柚苷酶液(2.0mg/mL),置入60℃的恒温振荡器(150r/min)中准确反应 30min;取出反应液,添加4mL蒸馏水和4.9mL体积分数90%的一缩二乙二醇 (DEG),40℃恒温水浴锅中预热3~5min,再加入4.0mol/L NaOH 0.1mL,充分摇匀,在水浴锅中保温发色10min;取出注入1cm比色皿内,用紫外分光光度计在420nm波长处测定吸光度,通过柚皮苷标准曲线计算酶活力。以0~250μg/mL 柚皮苷为标准溶液,测定420nm波长时的吸光度,制作标准曲线。同时以0.1mL醋酸缓冲液代替酶液作对照,以缓冲液作空白。
固定化酶活力测定:方法与游离酶活力测定基本相同,只需将酶液用1g固定化酶凝珠代替,将0.3mL缓冲液添加至0.4mL即可,其他均相同。
酶活力定义(U):在测定条件下(60℃,pH4.0),每分钟消耗1μg柚皮苷所需的酶量为一个酶活力单位。
游离酶或固定化酶相对活力是指在同组实验中以活力最高的为100,与其余的游离酶或固定化酶的活力之比,以百分数表示。
1.3.2 固定化酶凝胶颗粒的制备
按9.0g/100mL的PVA和1.0g/100mL的海藻酸钠比例配制100g载体溶液,待溶液完全冷却后,加入体积分数2.0%的戊二醛,充分混匀,置室温下交联3h。在延时交联后的载体中加入10mL(2.0mg/mL)的酶液,充分混匀后于15℃的恒温振荡器(150r/min)中吸附10h,再用5mL注射器均匀地注入4.0g/100mL的硼酸和0.5g/100mL的CaCl2溶液中形成3~5mm的凝珠,于4℃冰箱中固化1h后,用蒸馏水润洗3次;最后置于-40℃的冰柜中冻存30min,4℃冰箱中解冻,如此往复循环3次后[15],用滤纸吸干凝珠表面的水分,存放于4℃冰箱中冷藏待用。
1.3.3 游离酶与固定化酶的酶学性质研究
在最佳固定化条件下,制得PVA-海藻酸钠固定化柚苷酶,按照酶活力测定方法,分别测定游离酶与固定酶的酶活。将底物柚皮苷溶液配制成不同pH值的醋酸-醋酸钠缓冲液(pH2.8~5.2),分别向不同pH值的底物溶液中加入游离酶或固定化酶,60℃反应30min后测定酶活力,确定游离酶与固定化酶的最适pH值;将游离酶与固定化酶分别置于不同温度(30~80℃)的水浴锅中反应30min后,取样测定酶活力,确定游离酶与固定化酶的最适反应温度;将游离酶或固定化酶与不同质量浓度底物柚皮苷溶液作用,测定反应初速度,用Lineweaver-Burk 双倒数作图法求出酶的Km值;将游离酶与固定化酶分别在60℃的水浴锅中保温不同的时间后,取样在最适反应温度下测定酶活力,比较游离酶与固定化酶的温度耐受性;将固定化酶与底物柚皮苷溶液反应完成后,取出用0.2mol/L的醋酸-醋酸钠缓冲液(pH4.0)洗涤至无反应产物残留,重新装入新鲜底物溶液,测定固定酶活力,以此进行多次水解循环来测定固定化酶的重复使用性。
1.3.4 PVA-海藻酸钠固定化柚苷酶
配制9.0g/100mL聚乙烯醇和1.0g/100mL海藻酸钠载体溶液100g,待溶液完全冷却后,按不同固定化方法制备固定化酶,具体如下:将100g载体溶液平均分成4份,其中两份不加戊二醛,两份按2%比例(占总体积)加入戊二醛;再分别将一份未加戊二醛和一份添加了戊二醛的载体溶液置室温下自交联3h;另两份即刻加入2.5mL(2.0mg/mL) 的酶液,再按固定化酶凝胶颗粒的后续制备方法制备固定化酶;自交联的载体溶液交联3h后,即刻加入2.5mL(2.0mg/mL)的酶液,同样按固定化酶凝胶颗粒的后续制备方法制备固定化酶。按酶活力测定方法测定固定化酶的相对活力。
2 结果与分析
2.1 固定化酶工艺条件优化
2.1.1 PVA-海藻酸钠固定化柚苷酶方法的确定

图1 不同固定化方法对酶活力的影响Fig.1 Effect of different immobilization methods on activity of naringinase
由图1可知,采用添加戊二醛和延时交联的包埋方法制备的固定化酶活力较高。这主要是因为戊二醛是一种双功能交联剂,有二个醛基,可以使PVA-海藻酸钠分子内和分子间相互形成交联,同时也可以使酶交联在载体上。适宜的戊二醛使得PVA-海藻酸钠分子能形成稳定的网络结构,提高酶的固定化率。所以,在优化固定化条件时,确定载体的交联时间为3h和较适宜的戊二醛体积分数为2.0%。
2.1.2 不同质量浓度PVA-海藻酸钠配比对固定化作用的影响
按表1中的PVA-海藻酸钠的配制不同质量浓度的混合载体溶液,再按1.3.2节方法不改变其他条件制备固定化酶凝珠,按固定化酶活力测定方法测定酶的相对酶活力。

表1 PVA-海藻酸钠浓度对固定化酶活力的影响Table 1 Effect of PVA-alginate concentration on activity of immobilized naringinase
由表1可知,以9.0g/100mL的PVA溶液固定化柚苷酶时,固定化酶的相对酶活力较高,且凝珠易成型,珠体光洁、圆整,并具有适中的凝胶强度;当PVA质量浓度过低时,凝珠成型时间较长,且不易成型,凝胶强度也较弱;但当PVA质量浓度过高时,由于溶液黏度较高,凝珠不易成球,而且推压针筒时感到非常费力,有严重的拖尾现象。海藻酸钠的质量浓度同样也影响着酶的固定率,海藻酸钠质量浓度过高时,溶液的黏度较高,不利于凝珠的成型,固定化酶的相对酶活力也有所下降,这主要是因为较多的海藻酸钙导致了固定化颗粒内部孔径的减少,影响底物柚皮苷与酶的接触及产物的传质;当海藻酸钠质量浓度过低时,形成的凝胶强度较低。因此,按9.0g/100mL的PVA与1.0g/100mL的海藻酸钠配比制备载体时,固定化酶的相对酶活力最高,此条件下固定化有利于酶活力的发挥和产物的传出。
2.1.3 固化液CaCl2质量浓度对固定化酶活力的影响
按1.3.2节的方法,其他固定化条件不变,分别加入不同质量浓度的固化液CaCl2溶液,制备固定化酶凝珠,按固定化酶活力测定方法测定酶的相对活力,结果如图2所示。

图2 CaCl2质量浓度对固定化酶活力的影响Fig.2 Effect of CaCl2 concentration on activity of immobilized naringinase
实验过程中,固化液中4.0g/100mL硼酸的量是过量的[16],因此不需要进行优化,但CaCl2的质量浓度对固定化酶活力的影响较大。当CaCl2质量浓度过低时,制备的凝胶颗粒较软,形成的凝胶网状孔径比较大,截留的酶较少,在水解柚皮苷过程中易损坏,影响水解的效率;当其质量浓度过高时,由于过多的Ca2+使网状孔径过小,且导致了载体部分孔径的被堵塞,使得固定化酶的相对酶活力降低。1.0g/100mL CaCl2所制作的固定化酶凝珠易成型,形状均匀、具有弹性,无拖尾现象,且制备的固定酶的相对酶活力最高。因此,固化液中选择1.0g/100mL为最佳的CaCl2质量浓度。
2.1.4 酶液质量浓度对固定化效果的影响
按1.3.2节的方法,其他固定化条件不变,分别加入不同质量浓度的柚苷酶溶液,制备固定化酶凝珠,按固定化酶活力测定方法测定酶的相对酶活力,结果如图3所示。酶液质量浓度在0.5~2.0mg/mL时,随着酶液质量浓度的增大,固定化酶的相对酶活力快速增加。当酶液质量浓度增至2.0mg/mL时,固定化酶的相对酶活力开始缓慢增加。即对于柚苷酶来说,酶液质量浓度的最佳值为2.0mg/mL。这是因为当酶液质量浓度变大时,单位质量载体上固定的酶也就增加,相对酶活力随之就增加;但是当酶液质量浓度增大至一定程度时,载体上吸附的酶量逐渐达到平衡,此时酶的相对活力就相对增加缓慢;另外,当载体对酶的吸附量达到饱和时,有些酶分子进入载体深处,底物扩散相对困难,使酶分子发挥作用的能力减弱。因此,选择2.0mg/mL的酶液,进行固定化。

图3 酶液质量浓度对固定化酶活力的影响Fig.3 Effect of enzyme concentration on activity of immobilized naringinase
2.1.5 酶交联时间对固定化酶活力的影响
按1.3.2节的方法,其他固定化条件不变,改变固定化酶的吸附时间,制备固定化酶凝珠,按固定化酶活力测定方法测定酶的相对酶活力,结果如图4所示。

图4 酶交联时间对固定化酶活力的影响Fig.4 Effect of crossing time on activity of immobilized naringinase
本实验固定化酶的方法采用交联与包埋结合法。由于该载体表面及内部为多孔结构,分子在载体内部的扩散反应需要一定时间。从图4可知,固定化时间在1~10h内,时间越短,酶的固定化率越低;但超过10h,随着时间的延长,酶的固定率逐步下降。这是因为如果固定化时间太长,交联程度高,形成的凝胶网状结构太紧密,就会影响到酶促反应时的反应速率,检测到的固定化酶的活力就会下降。因此选择固定化酶的吸附时间为10h,就能获得较多活力。
2.2 固定化酶的扫描电镜(SEM)
在最佳的固定化条件下得到固定化柚苷酶,在扫描电镜下观察载体横截面。湿的PVA-海藻酸钠微球经SEM观察前要进行如下几步处理:1)用0.1mol/L PBS(pH7.2)清洗3次(每次20min)后,在室温下用体积分数1%四氧化锇固定2.5h,然后再用0.1mol/L PBS(pH7.2)清洗3次(每次30min);2)将清洗后的材料分别用体积分数为30%、50%、70%、90%、100%的乙醇逐级脱水3次(每次30min),再用乙酸异戊酯-乙醇体积比为1:1的混合溶液代换1次,体积分数100%的乙酸异戊酯代换1次(30min);3)将充分脱水后的样品放入CO2临界点干燥仪(HCP-2型)中干燥,干燥后的微球经离子溅射仪(EikoIB-5)镀金膜后SEM观察拍照,加速电压为20kV。
对固定化酶而言,载体结构直接影响着固定化酶的活性。多孔且具有较高比表面积的高分子微球,被认为是固定化酶的理想结构。由图5可看出,载体孔结构内外相连,表面存在大量孔径50nm左右的孔结构,具有较大比表面积。因而酶固定在载体上后,酶分子被束缚在有限的空间结构内,使得酶分子无法自由变构,从而保持了酶的活性[17]。

图5 PVA-海藻酸钠固定化柚苷酶的SEM图(×5000)Fig.5 SEM of the surface configuration of immobilized naringinase with PVA-sodium alginate (×5000)
2.3 游离酶与固定化酶的酶学性质
2.3.1 游离酶与固定化酶的最适pH值
在不同pH值的0.2mol/L的醋酸缓冲溶液中,测定游离酶和固定化酶的相对活力。由图6可知,该固定化酶与游离酶的最适pH值均为4.0,说明PVA-海藻酸钠固定化柚苷酶后对酶反应的最适pH值没有影响。当pH值低于4.0时,游离酶的相对酶活力较固定化酶高,但pH值大于4.0后,固定化酶的活力下降缓慢,游离酶的活力下降迅速;同时,固定化酶对pH值的敏感度较游离酶低,适应的范围比较广。

图6 游离酶与固定化酶的最适反应pH值Fig.6 Optimal reaction pH of free and immobilized naringinase
2.3.2 游离酶与固定化酶的最适温度

图7 游离酶与固定化酶的最适反应温度Fig.7 Optimal reaction temperature of free and immobilized naringinase
从图7可知,固定化酶与游离酶在温度30~70℃范围内相对酶活力随温度升高而增大,在70℃时,相对酶活力均达到最大。这表明柚苷酶固定化后对其最适温度没有影响。但温度高于70℃后,由于PVA在高温下能溶解,因此固定化酶的使用温度不能高于此温度;游离酶在温度高于70℃时,相对酶活力迅速下降,因此也不适宜在此温度范围内使用。因而,固定化酶与游离酶的最适温度均为70℃。
2.3.3 游离酶与固定化酶的动力学行为
酶经过固定化后,酶蛋白质的结构会发生一定程度的变化;同时由于载体的影响,与底物的亲和力也会发生改变。图8为游离酶与固定酶的Lineweaver-Burk曲线,并求得固定化酶及游离酶的Km分别为4.263mmol/L和 2.747mmol/L。由此可知,固定化酶的Km值高于游离酶。Km大,表示酶与底物的亲和力小,反之,表示酶与底物的亲和力大。这说明柚苷酶经过PVA-海藻酸钠载体固定化后,其与底物的结合能力变弱。这可能是因为载体所带电荷和底物所带电荷相同时,他们之间产生了排斥作用;又或是因为酶经过固定化后产生了立体障碍或扩散阻力,从而导致Km值升高。

图8 游离酶与固定化酶的Lineweaver-Burk曲线Fig.8 Lineweaver-Burk curve of free and immobilized naringinase
2.3.4 游离酶与固定化酶的热稳定性

图9 游离酶与固定化酶的热稳定性Fig.9 Thermal stability of free and immobilized naringinase
由图9可知,固定化酶与游离酶在60℃时保温90min以内相对酶活力均没有明显的降低,保温时间超过90min后游离酶活力迅速下降,而固定化酶活力下降缓慢。当保温时间达到150min时,游离酶相对活力仅为30.87%,而固定化酶相对活力高达72.84%,这表明固定化酶在60℃时的热稳定性明显高于游离酶。因此,酶和高分子载体结合后,结构变得牢固,酶的构相被固定,即使受热,酶蛋白链也难以伸展,酶蛋白的高级结构得以维持,所以固定化酶的稳定性显著提高。
2.3.5 固定化酶的重复使用性
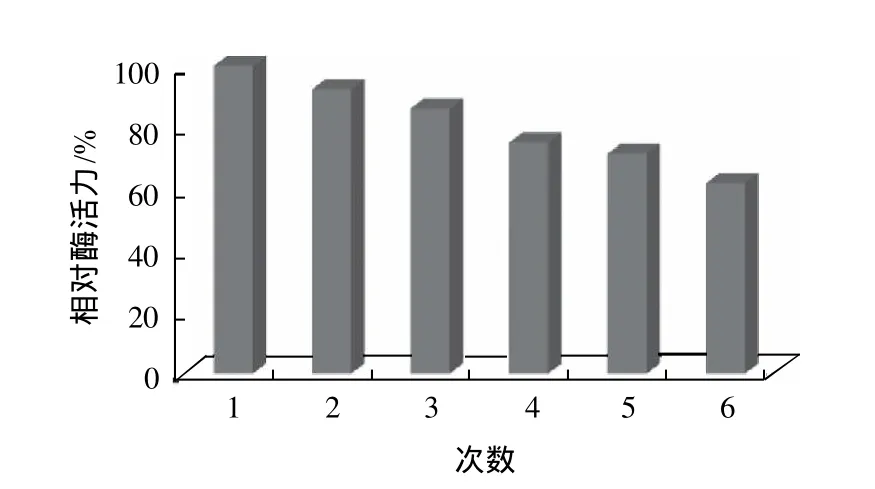
图10 固定化酶的操作稳定性Fig.10 Stability of immobilized naringinase
以第一次测得的酶活力为100,计算各自相对酶活力,结果如图10所示,经过重复使用6次后,固定化酶的相对酶活力仍保持为60%左右。这表明柚苷酶经过固定化后具有良好的重复使用性,这为固定化柚苷酶应用于果汁脱苦提供参考。
3 讨 论
聚乙烯醇和海藻酸钠来源丰富、无毒、化学性质比较稳定,是性能良好的固定化酶载体,具备规模生产的条件。海藻酸钠溶液可以与Ca2+离子反应形成凝胶,凝胶可以在室温或任何高于100℃的温度条件下形成,加热也不融化;而聚乙烯醇在硼酸溶液中形成的凝胶孔隙较大。结合它们的优点制备的固定化酶载体,易于底物与酶的接触和产物的自由流出,同时利用交联剂——戊二醛提供的醛基,使PVA-海藻酸钠分子内和分子间形成交联,提高了酶的催化效率。固定化酶凝珠内部具有规则的通孔结构,具有很大的内表面积,能有效地包埋、截留柚苷酶,并且有利于底物和产物的扩散。结果表明:9.0g/100mL的聚乙烯醇与1.0g/100mL的海藻酸钠配比时,固定化酶的相对酶活力较高,催化效果较好。柚苷酶经过固定化后,热稳定性和操作稳定性提高了;重复使用6次,相对酶活力仍可保持60%。
[1] 李晔. 酶的固定化及其应用[J]. 分子催化, 2008, 22(1): 86-96.
[2] 王坤. 固定化酶在工业中的应用[J]. 山东理工大学学报, 2006, 20(5):107-110.
[3] 袁定重, 张秋禹, 侯振宇, 等. 固定化酶载体材料的最新研究进展[J].材料导报, 2006, 20(1): 69-72.
[4] 雷生姣, 潘思轶. 柚(皮)苷酶的研究进展[J]. 食品科学, 2009, 30(19):314-318.
[5] ZVERLOV V, HERTEL C, BRONNENMEIER K, et al. The thermostable alpha-L-rhamnosidase rama of clostridium stercorarium: biochemical characterization and primary structure of a bacterial alpha-L-rhamnoside hydrolase, a new type of inverting glycoside hydrolase[J].Molecular Microbiology, 2000, 35(1): 173-179.
[6] EKEROGLU G S, FADILOGLU S, GOGUS F. Immobilization and characterization of naringinase for the hydrolysis of naringin[J]. Eur Food Res Technol, 2006, 224(1): 55-60.
[7] PURI M, MARWAHA S S, KOTHARI R M, et al. Biochemical basis of bitterness in citrus fruit juices and biotechnological approaches for debittering[J]. Crit Rev Biotechnol, 1996, 16(2): 145-155.
[8] SOARES N, HOTCHKISS J. Naringinase immobilization in packaging films for reducing naringin concentration in grapefruit juice[J]. Journal of Food Science, 1998, 63(1): 61-65.
[9] PRAKASH S, SINGHAL R S, KULKARNI P R. Enzymatic debittering of Indian grapefruit (Citrus paradasis) juice[J]. J Sci Food Agric, 2002,82(4): 394-397.
[10] 汪钊, 毛富根. 柚苷酶产生菌的选育及发酵条件研究[J]. 微生物学通报, 1995, 22(1): 18-22.
[11] 卢建明, 张晨, 刘志伟. 产柚苷酶菌株的初步筛选[J]. 广州化工, 2005(3): 15-16.
[12] 陈玲, 涂国全. 透明圈法筛选柚苷酶高产菌株[J]. 江西科学, 2007,25(1): 27-29.
[13] 李花子, 土建龙, 文湘华, 等. 聚乙烯醇-硼酸固定化方法的改进[J].环境科学研究, 2002, 15(5): 25-27.
[14] DAVIS D W. Determination of flavonones in citrus juice[J]. Analytical Chem, 1947, 19(7): 46-48.
[15] BUSTO M D, MEZA V, ORTEGA N, et al. Immobilization of naringinase from Aspergillus niger CECT 2088 in poly (vinyl alcohol) cryogels for the debittering of juices[J]. Food Chemistry, 2007, 104(3): 1177-1182.
[16] 普利锋, 赵刚, 土建龙. 几种交联剂对PVA固定化活性污泥的活性比较[J]. 清华大学学报, 2004, 44(12): 1603-1605.
[17] 马光辉, 王平, 苏志国. 纳米科学与酶[J]. 工业生物技术专刊, 2009(5): 49-54.

