应用流式细胞技术快速定量检测UHT奶产品中的微生物*
孙晓霞,赵占民,刘道亮,张峻峰
(河北出入境检验检疫局,河北石家庄,050051)
应用流式细胞技术快速定量检测UHT奶产品中的微生物*
孙晓霞,赵占民,刘道亮,张峻峰
(河北出入境检验检疫局,河北石家庄,050051)
采 用基于单个活细胞的新型荧光标记技术,精确区分UHT奶样品中的活菌细胞与死细胞以及其他大颗粒物质,并应用流式细胞技术(flow cytometry,FCM)对UHT奶产品进行微生物快速定量检测。通过与传统的平板计数检测方法进行比对,结果表明,FCM方法的检测范围为101~107CFU/mL,远远高于平板计数法。2种方法的计数结果相关性分析表明,在一定菌液浓度范围内,FCM方法的定量结果与平板计数法线性相关良好,且对不同类型菌种都能精确标记定量,是更为快速、准确的检测方法。
流 式细胞术,UHT奶,微生物,定量检测
流式细胞术(flow cytometry,FCM)是20世纪70年代起源于细胞生物学领域的一门新兴技术,目前已广泛应用于临床医学诊断和基础医学研究等领域[1-2],但是在食品安全监测方面尚在起步阶段。
流式细胞术的荧光染剂一般分为膜渗透性、膜非渗透性和膜电位敏感性等3种,对活菌和死菌、大颗粒物质难以进行标记区分[3]。本实验采用新型标记技术,以市售UHT奶为实验材料,模拟产品在生产、流通环节中受到微生物污染的情况下,利用流式细胞技术进行快速检验,并将实验结果与传统平板检验方法进行了比对。同时在检测产品中人为添加了细菌、酵母菌以及霉菌的模式或代表菌株,证明通过采用流式细胞术的2个核心技术:荧光标记及流式细胞仪检测平台[4],能够对检测材料中的活菌进行精确定量。
1 材料与方法
1.1 UHT奶产品
为了对比不同品牌的UHT奶成分是否会对实验结果造成影响,研究中选购了当地市面上较常见、销量较大的6种品牌产品进行实验。

表1 本研究中所用UHT奶产品
1.2 试验菌株
研究中所采用的大肠杆菌为细菌的模式菌株,同时也是食品受到污染后最常存在的肠道致病菌,它与金黄色葡萄球菌分别代表了常见食品致病菌中的革兰氏阴性菌与革兰氏阳性菌。枯草芽孢杆菌代表了乳产品中常见的芽孢杆菌。酿酒酵母作为酵母菌的模式菌株,也是食品中广泛存在的。黑曲霉是存在于环境和食品原料中的常见霉菌代表菌株。具体见表2所示。

表2 本研究中所用菌株
1.3 仪器设备
流式细胞分析仪(BactiFlow ALS系统,法国AES),离心机(Sigma3K15,德国Sigma),生化培养箱(LRH-150B,中国广东),涡旋混合器(MS1,德国IKA),超纯水仪(KL-UP-UN-10,中国台湾艾柯)。浊度计(ZDY-Ⅱ,上海复星佰珞)。
1.4 培养基和试剂
FCM基础试剂:
(1)ChemSol S 50X(code:300-R3106-01),鞘液,用于分析过程中清洗或做保护液。
(2)Dilunt R(code:400-R6008-01)和CSR(code:300-R4095-01),用于减少游离荧光。
(3)Isored(code:300-R3709-01),隔离空气中的氧气。
(4)Cleaning5(code:300-R3107-02)清洗液,在分析过程中清洗进样口。
(5)Cleaning3(code:300-R3064-01)清洗液,用于每天试验结束后清洗系统。
FCM检测试剂:
(1)Standard G(code:300-R5095-01),细菌标准液(标准荧光珠子),日常控制试剂。
(2)Standard A(code:300-R5068-01),霉菌与酵母菌标准液(标准荧光珠子),日常控制试剂。
(3)ChemSol B26/1(code:400-R2702-02),标记缓冲液。
(4)ChemChrome V26(code:400-R1006-01),细菌标记底物。
(5)CS26 A(code:400-R4105-01),标记细菌时减少背景荧光(含内标物)。
CS26 B(code:400-R4106-01),用于优化标记过程。在使用前和CS26 A混合,混合液仅限于当天使用。
(6)CSV(code:400-R4102-01),标记霉菌与酵母菌时减少背景荧光,含内标物。
(7)CS13(code:400-R4108-01)减少非特异性标记。
(8)ChemChrome V8(code:400-R1002-01),霉菌与酵母菌标记底物。
以上试剂均购自法国的AES公司。
培养基:营养肉汤,平板计数琼脂,孟加拉红培养基,PDA液体培养基。均购自北京陆桥公司。
1.5 荧光标记
常用的FCM荧光染料通常存在着不能进入完整细胞膜或不能区分标记活细胞和死细胞,消除背景干扰等问题。本研究中采用ChemChrome V26荧光标底物标记细菌,ChemChrome V8荧光标记底物标记霉菌和酵母菌。样品分装到试管中上机后,仪器自动抽取并分装底物进行标记。底物中均含有非荧光的二聚体底物,只有具膜完整性的活菌细胞中才存在的酯酶才能将非荧光二聚体底物中的酯键切断,形成单聚体与活细胞结合而发出绿色荧光,这样就避免了样品内死菌细胞和其它大颗粒物质的干扰。标记后的样品悬液被包裹在鞘液中经过喷嘴高速喷出,形成一条狭窄的分析流,确保细胞逐个通过激光聚焦的测量区,进而由光敏元件测量每个细胞或颗粒产生的荧光信号强度,从而获得各种信号参数,并由数字处理器进行分析,对样品中的活菌进行精确定量[5]。整个标记过程由仪器自动完成。
1.6 试验方法
1.6.1 不同产品的荧光背景检测
为了确定不同产品成分组成是否在用FCM方法检测时会产生不同的荧光背景,并消除其对本研究中定量结果的干扰,首先对不同样品进行荧光背景检测。在无菌条件下打开产品包装,用灭菌移液管吸取10 mL样品于无菌试管中,每种样品取4个平行,做好荧光标记后立即放入样品槽中,开始程序,仪器会以机械手臂操控进样探头,自动依次从各待测试管中吸取1 mL样品上机检测。
1.6.2 自然增菌快速检测
为了模拟UHT奶产品在生产、流通、货架等真实环境中受到微生物污染的情况,本研究中将所购奶产品在无菌条件下开封取样,先利用FCM进行快速检测,同时以传统的平板计数法作为对照,以确定样品是无菌的。将样品在无菌环境中打开包装,然后暴露于自然空气中放置24 h。这时样品已受到环境中微生物污染并大量繁殖。为了保证检测的模拟真实性,以增菌后的样品为母液,以未开封的同类无菌样品为稀释液进行10倍数的梯度稀释,共做8个梯度,并立即上机检测。同时每个梯度各取1 mL于无菌平皿中,倾注高压灭菌后冷却到45℃的计数培养基,混匀凝固后于37℃下培养48h计数,各做3个平行[6]。
1.6.3 人为添加标准菌株的确证试验
将表2中所列菌种分别活化并在各自适宜的培养基上转接培养2代后,挑取细菌单菌落接种于灭菌后的10 mL营养肉汤管中于37℃培养24 h,制成菌悬液,经浊度计测定菌液浓度为1×109~5×109CFU/mL;挑取霉菌和酵母菌接种于灭菌后的PDA液体培养基中于25℃培养48h,制成菌悬液,经浊度计测定菌液浓度分别约为3×108CFU/mL和6×107CFU/mL。以无菌操作,各取1 mL上述菌悬液,分别添加到9 mL无菌的UHT奶样品中,振荡混匀作为待检样品,并依次做10倍比梯度稀释,共做8个梯度,将其放置于流式细胞分析仪样品槽内上机检测,同时用灭菌移液器吸取每稀释度样品于无菌平皿中,分别倾注计数琼脂培养基(细菌)和孟加拉红培养基(酵母菌和霉菌)作计数培养,各做3个平行[7]。
1.6.4 结果分析
将FCM方法的检测结果与平板计数方法结果进行比对,并进行相关性分析。
2 结果与讨论
2.1 背景测定
研究中采用的6种品牌的UHT奶样品无菌开封后经FCM法检测结果如下所示。
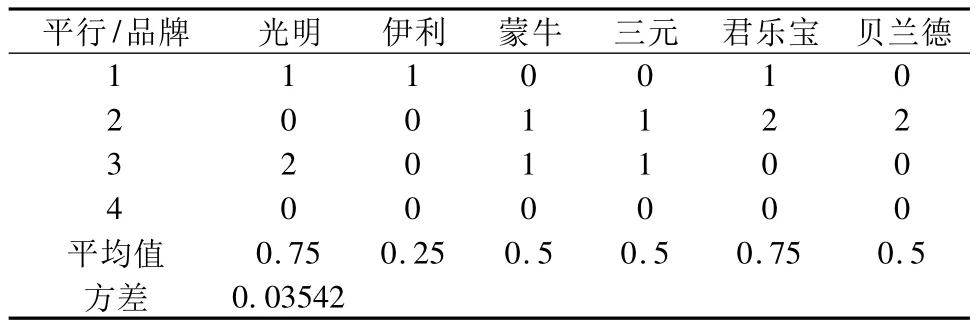
表3 FCM法测定不同品牌样品背景
从表3可以看出,各品牌样品的检测值均小于1 CFU/mL,证明通过新方法标记,均未产生太大的荧光背景,即本方法可以很好地排除样品中大颗粒物质的干扰。各样品的平均值方差为0.035 42,小于0.05,即各样品检测结果之间差异不显著,可以选择一种产品继续后面的实验内容。本研究中选择了伊利UHT奶作为后面的实验材料。
2.2 自然增菌检测
实验结果如表4所示。从2种检验方法的定量结果中可以看出,在样品菌液浓度从104~107CFU/mL,应用FCM方法可以对样品进行精确定量,且各重复之间重现性很好;而平板计数法则因为超出了计数范围而无法定量。在样品菌液浓度从101~103CFU/mL,2种检测方法均可以进行定量检测,且各自重复之间的重现性很好。说明FCM方法采用激光读取荧光值,数字处理系统自动计数,不受人工读数能力的限制,在检测限上大大优越于传统的平板计数法;且不受样品背景干扰,可以将未处理的成品样本直接上机检测,大大简化了微生物检验步骤。
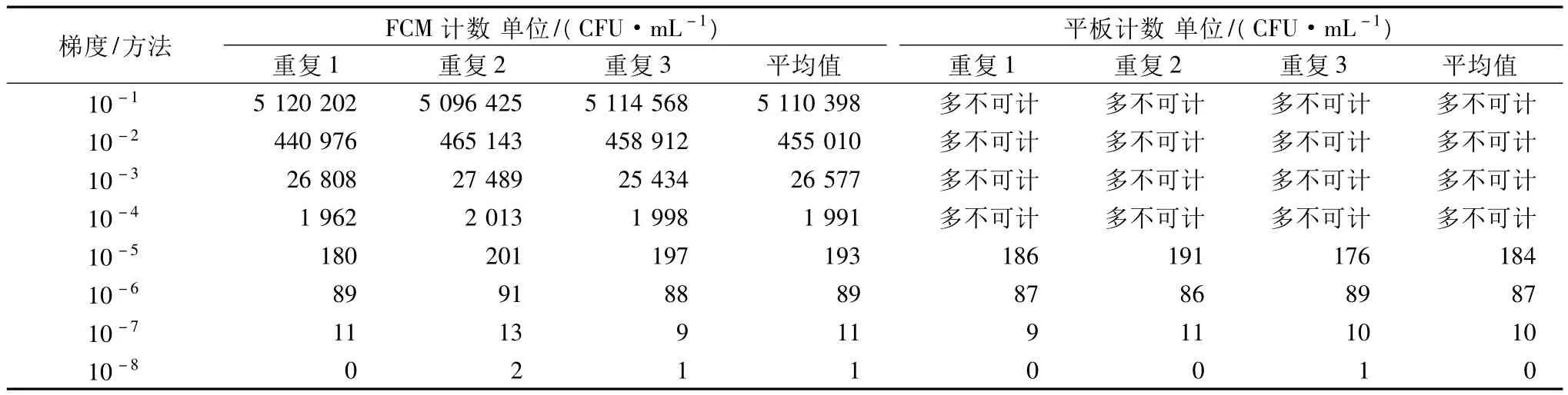
表4 自然增菌检测
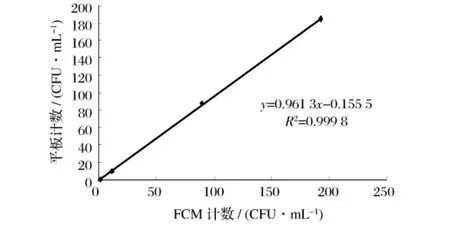
图1 自然增菌实验FCM计数法与平板计数法相关性分析
以FCM检测方法与平板计数方法的定量结果平均值为对象进行相关性分析,结果如图1所示。2种检测方法的定量结果呈线性相关,相关系数为0.999 8,说明两者结果高度符合。回归斜率为0.961 3,说明FCM方法的定量结果要略高于平板计数结果。该现象的原因是因为平板计数方法要依靠人工读数,可能会因人为因素而影响结果,而流式细胞仪的自动检测平台计数精确度要高于人工读数。并且样品中的受损微生物细胞可能会因为恢复较慢而不能在限定的培养时间内生长形成单一菌落,从而影响计数结果;而基于荧光标记计数的FCM检测方法则不存在这个问题[8-9]。
2.3 人为添加标准菌株验证实验
在本部分实验中,样品中添加的各种标准菌株用FCM法均能精确计数,计数范围从101到107CFU/mL,且梯度性很好(见表5)。而平板计数法的计数范围只能从101到103CFU/mL。说明在本研究中采用的FCM检测方法可以对革兰氏阳性菌、革兰氏阴性菌、芽孢杆菌、酵母菌和霉菌都进行荧光标记和准确计数。将每种菌株的两种检测方法都在计数范围内的计数结果进行相关性分析,结果如图2所示。
检测大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌的两种方法结果相关系数均为1,说明2种方法检测细菌的计数结果高度相关。酿酒酵母和黑曲霉菌2种方法检测结果的相关系数均在0.99以上,说明2种方法对酵母菌和真菌的检测结果也高度相关。从而验证了FCM法对UHT奶样品中各种微生物进行 定量检测的结果准确性[10-11]。
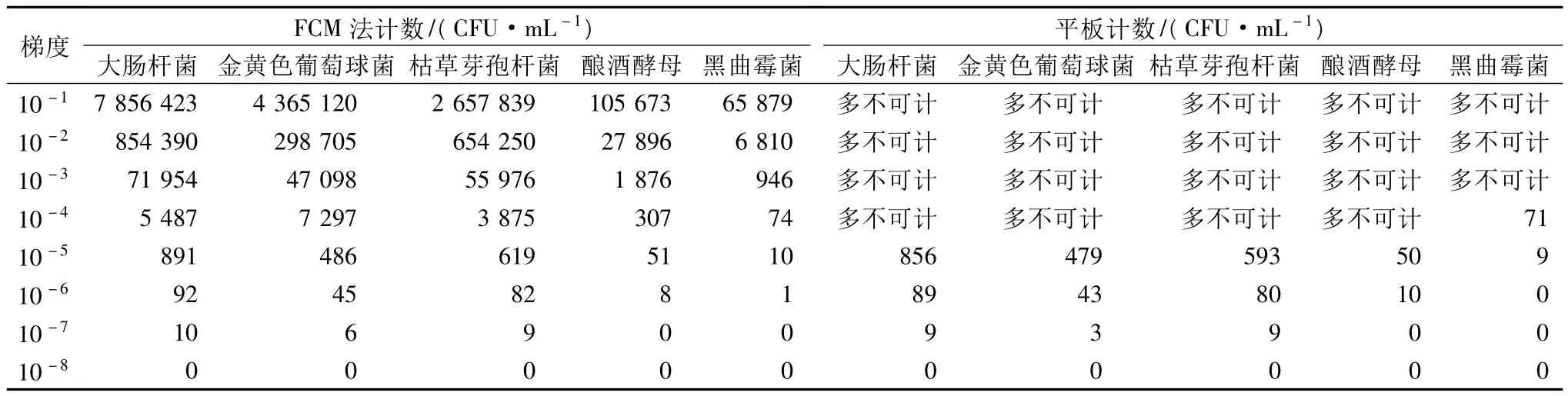
表5 人为增菌计数结果
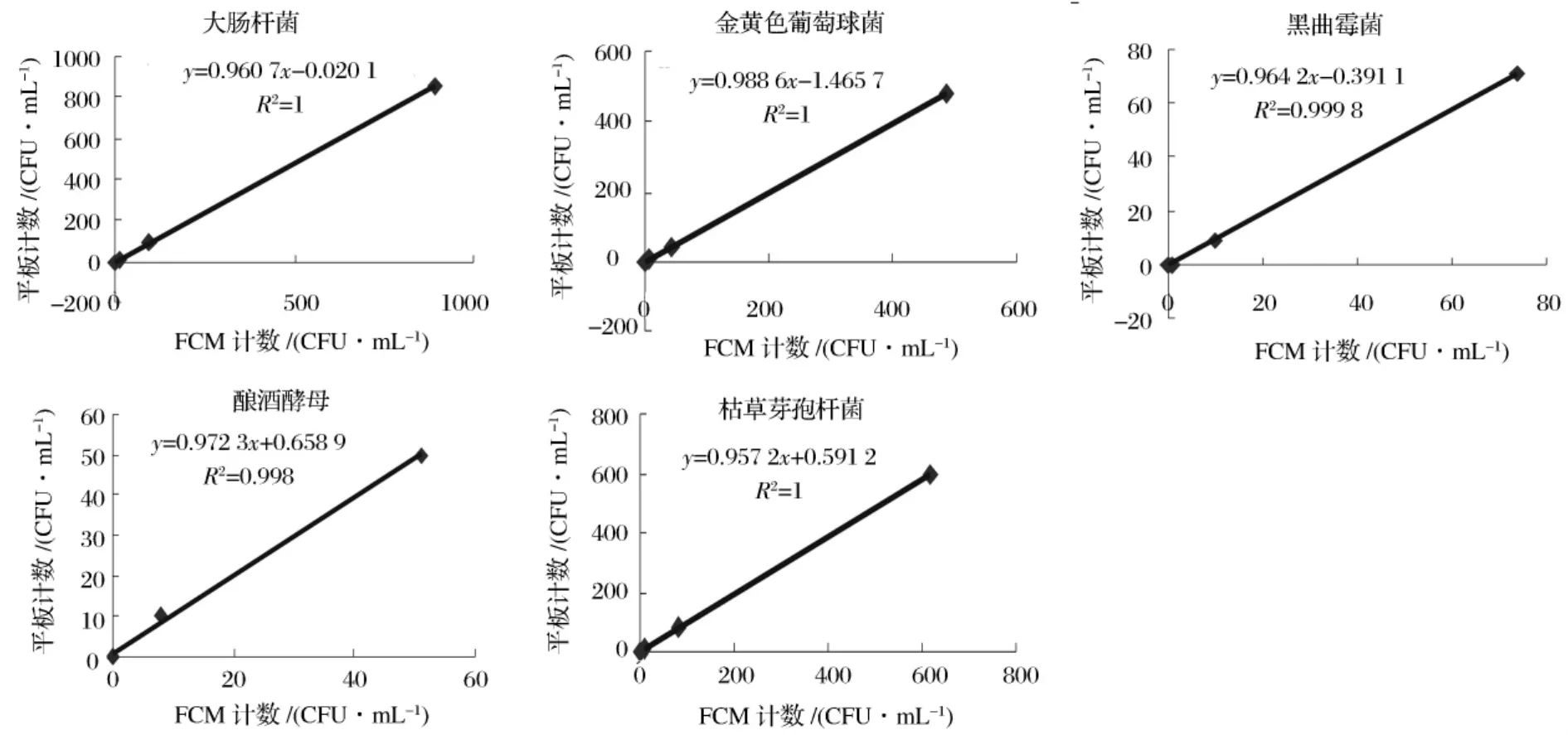
图2 人为添加标准菌株实验2种定量方法结果的相关性分析
3 结论
在食品卫生监管过程中,检验人员在几分钟或几个小时内向产品管理者提供微生物的分析结果,能够对生产、运输和库存环节的微生物污染进行及时有效的控制而产生巨大效益,同时也大大降低了食品安全事故的发生率。目前,微生物检测方法根据生物发光原理已经发展到能在几分钟得到结果[12],但由于分析所需敏感性的限制并不能提供计数,因此应用于卫生监测存在着局限性。
本研究采用非荧光底物对单个可见活细胞进行特殊标记,每个细胞将被流式细胞仪系统的超敏感信号放大器检测和计数。在这个系统中,荧光信号将被实时监测,并通过尖端软件进行分析以区分被标记的活细胞和其它非微生物的大颗粒物质以及死细胞。利用FCM进行样品分析是完全自动化的,每小时能提供40~50个处理结果,效率远远高于传统的平板计数法检测[13]。而且省去了前处理和后继培养步骤,比传统的平板计数法检测周期缩短了24~120 h[14]。并且通过与平板计数法的比对实验,验证了FCM检测方法的准确性。
FCM检测技术具有2大特点:计数和分选。本试验中仅是对FCM技术应用于UHT奶产品的微生物安全定量监测方面进行了初步研究。在进一步研究中可利用FCM分选技术实现对同一样品里的不同微生物或细胞进行定性和分选提取。该技术在食品安全监管方面有着广大的应用前景。
[1] 杨怀德,张才军,李秀义,等.流式细胞术在微生物学中的应用[J].医学综述,2006,12(13):825-827.
[2] 李庆,马筱玲,李柏青.流式细胞术在临床细菌学检测中的应用[J].国外医学临床生物化学与检验学分册,2002 ,23(6):344-345.
[3] Patkar A,Vijayasankaran N,Urry D W,et al.Flow cytometry as a useful tool for process development:rapid evaluation of expression systems[J].J Biotechnol,2002 ,93(3):217-229.
[4] 张艺.流式细胞仪构成与工作原理[J].医疗设备信息,2005,20(8):25-26.
[5] Lionnel L,Jean-Louis D.Sterility test in UHT milk[J].Aes Chemunex,2006,10:1-9.
[6] GB 4789.2-2010[S].食品微生物学检验 菌落总数测定.
[7] GB 4789.15-2010[S].食品微生物学检验 霉菌和酵母计数.
[8] 谢小梅,许杨.流式细胞术[J].中国生物工程杂志,2003,23(9):100-104.
[9] Jones D L,Brailsford M A,Drocourt J L.Solid-phase,laser-scanning cytometry:a new two-hour method for the enumeration of microorganosms in pharmaceutical water[J].Pharmacopeial Forum,1999,25(1):7 626 -7 645.
[10] 肖安风,周祥山,周利,等.应用流式细胞术检测毕赤酵母的细胞活性[J].微生物学通报2006,33(6):22-26.
[11] 张波,陈君,卢启威,等.应用流式细胞术对啤酒酵母在含油酸培养基中生长的定量研究[J].现代仪器,2008(2):17-20.
[12] John P Nolan,Loretta Yang.The flow of cytometry into systems biology[J].Briefings in Functional Genomics and Proteomics,2007,6(2):81-90.
[13] Kacmar J,Zamamiri A,Carlson R,et al.Single-cell variability in growing Saccharomyces cerevisiae cell populations measured with automated flow cytometry[J].Biotechnol,2004,109(3):253 -268.
[14] Van Poucke S O,Nells H J.A 210-min solid phase cytometry test for the enumeration of Escherichia coli in drinking water[J].Journal of Applied Microbiology,2000,89:390-396.
[15] Thusitha S Gunasekera,Paul V Attfield,Duncan A V,et al.A flow cytometry method for rapid detection and enumeration of total bacteria in milk[J].Applied and Environmental Micorbiology,2005,66(3):1 228 -12 321.
[16] Winson M K,Davey H M.Flow cytometric analysis of microorganisms[J].Methods,2000,21:231 -240.
Quantitatively Detect Microorganism in UHT Milk Rapidly by Using Flow Cytometry
Sun Xiao-xia,Zhao Zhan-min,Liu Dao-liang,Zhang Jun-feng
(Hebei Entry-Exit Inspection and Quanrantine Bureau,Shijiazhuang 050051,China)
In this research we distinguish the live cells,dead cells and other large particles accurately in the UHT milk samples using a new Fluorescence Labeling Technique basing on single live cell,and quickly detect microorganism quantitatively by using flow cytometry.Comparison with traditional plate counting method shows that the detection range of FCM is 101~107CFU/mL,far above that of plate counting method.Correlation analysis of the results of the two methods shows that within certain concentration range of bacteria solution,the results of FCM and plate counting method are linear,and FCM is a more accurate and rapid detection method for different types of microorganism.
flow cytometry,UHT milk,microorganism,quantitatively detect
硕士,工程师。
*国家质检总局科技计划项目(No.2009IK174)
2010-04-16,改回日期:2010-12-10

