体外培养猕猴穆勒细胞经诱导可表现出视网膜前体细胞特征
郭祥玉, 金立方, 纪少珲, 魏强, 牛昱宇, 季维智
(中国科学院昆明动物研究所 灵长类研究中心, 云南省动物生殖生物学重点实验室, 云南 昆明 650223)
体外培养猕猴穆勒细胞经诱导可表现出视网膜前体细胞特征
郭祥玉, 金立方, 纪少珲, 魏强, 牛昱宇, 季维智*
(中国科学院昆明动物研究所 灵长类研究中心,云南省动物生殖生物学重点实验室,云南 昆明650223)
近年来的研究发现, 鸡、大鼠和人视网膜中的穆勒胶质细胞(muller cell)在一定条件下,可显示出视网膜干/前体细胞的功能。但是, 有关人类近亲猕猴穆勒细胞的研究尚未见报道。该研究首先使用基础培养基(DMEM+10%FBS)建立猕猴的穆勒细胞系, 其表达GS、vimentin、CRALBP和EGFR等穆勒细胞标记, 不表达GFAP,与人的穆勒细胞基因表达相似而与啮齿类差异较大。穆勒细胞经神经干细胞培养基培养一周后可表达pax6、nestin、sox2、otx2、six6和six3等视网膜干细胞标记, 继续使用视黄酸诱导, 部分细胞可分化为神经元细胞,这说明猕猴的穆勒细胞在体外诱导条件下,可去分化为视网膜前体细胞, 有望成为视网膜疾病细胞替代疗法的一种细胞来源。
猕猴; 视网膜干细胞; 穆勒细胞; 视网膜疾病
神经退行性视网膜疾病,如青光眼、视网膜色素变性、老年性黄斑变性等是目前的高致盲性疾病(Wallace, 2007), 其共同病理特征是部分视网膜神经细胞的病变死亡, 临床上尚无有效的治疗手段。干细胞具有分化的多能性, 被认为可分化为与病变细胞相应的细胞类型并取而代之, 从而治愈疾病。因此, 使用视网膜干细胞治疗上述眼疾是一种具有良好发展前景的治疗策略。
穆勒细胞是视网膜中广泛存在的一类放射状胶质细胞, 主要起支撑视网膜结构, 为视网膜神经元和血管提供代谢支持的作用, 同时还具有防止感光细胞过分向视网膜下生长的作用(Limb et al, 2002)。在发育上, 穆勒细胞和视网膜其他神经细胞具有共同的祖细胞。近年来研究发现, 在成年的鸡(Fischer & Reh, 2001)和大鼠(Ooto et al, 2004)中, 视网膜被NMDA药物损伤后,穆勒细胞会显著增殖,部分表达视网膜干细胞抗原, 并可迁移至损伤部位分化成相应的细胞。啮齿类动物(Das et al, 2006; Wan et al, 2007)穆勒细胞已被成功分离在体外培养,并被证实其确实具有视网膜前体细胞的属性, 具有一定自我更新能力且可分化成视网膜特异的神经元。人的穆勒细胞虽然在体外条件下也可被诱导去分化, 但是其去分化后更与神经干细胞相似(Lawrence et al, 2007)。
啮齿类动物的视网膜的生理结构、功能与人类差异较大, 而非人灵长类动物的视网膜与人类极为相似, 是研究视网膜疾病的理想模型(West et al, 2009)。目前, 关于非人灵长类穆勒细胞的研究还未见报道。本研究首次建立了猕猴穆勒细胞系, 分析了猕猴穆勒细胞体外培养条件下的基因表达情况,使用神经干细胞培养体系诱导穆勒细胞去分化为视网膜前体细胞, 并进一步诱导分化出神经元细胞。
1 材料和方法
1.1 试验动物
猕猴眼球来自于中国医学科学院昆明生物医学研究所用于生产疫苗的不同年龄段的成年健康猕猴(n=30), 这些猕猴从未用于其他的实验。
1.2 穆勒细胞的分离培养
眼球先用含有青霉素和链霉素的PBS清洗并剪除周边组织, 然后在角膜缘后1 cm左右处进行环切, 将眼球后缘部分浸入含有0.25%胰蛋白酶(sigma)+1%胶原酶的DMEM/F12溶液中, 放置在37 ℃ 1 h。最后用眼科镊小心地将神经视网膜剥离出来(图1A), 注意避免色素上皮的污染。剥离出来的视网膜先用剪刀剪碎, 然后用含有0.25%胰蛋白酶+1%dispase的DMEM/F12在37 ℃消化0.5 h。消化好的细胞用含10%胎牛血清+EGF(10 ng/mL)的DMEM培养基以105/mL浓度悬浮, 最后接种至明胶处理好的培养皿中。
1.3 诱导穆勒细胞去分化及再分化
将传代培养贴壁后的穆勒细胞培养基更换为无血清培养基:DMEM/F12+N2 supplement+FGF2 (20 ng/mL)+EGF(20 ng/mL), 此后隔天更换半量培养基。细胞传代使用胰蛋白酶消化, 按1∶3的比例传至上代细胞的条件培养基中。在无血清培养条件下培养一周后进行视网膜干细胞标记检测。使用无血清培养基培养一周后改换为神经分化培养基(DMEM/F12+1%FBS+50 mmol/L RA)进行诱导分化,培养4周后进行分化检测。
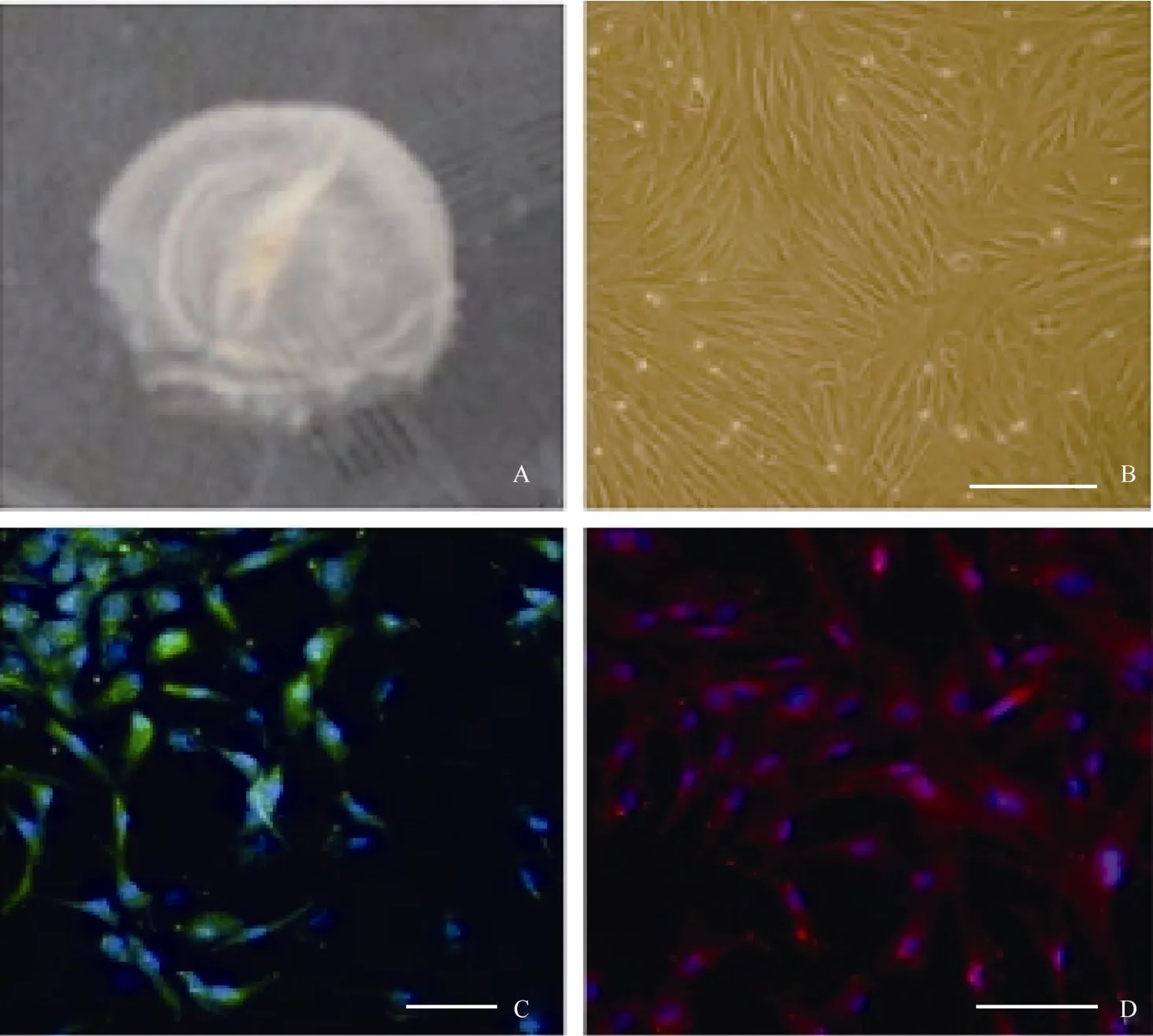
图1 穆勒细胞体外培养及免疫荧光检测Fig.1 Immunofluorescence test for in vitro cultured muller cell
1.4 细胞免疫荧光染色
PBS冲洗细胞3次,4%多聚甲醛室温下固定15~20 min;PBS冲洗细胞3次, 0.4%Triton X-100透膜10 min(仅对细胞内蛋白);随后再次用PBS 冲洗细胞3次,5%~10%羊血清室温封闭30 min。细胞在一抗中室温孵育2 h或4 ℃过夜。PBS洗3次后加入FITC-或PE/Texas Red(Santa Cruz)连接的二抗,室温孵育1 h。用Hochest 33258进行细胞核染色。以添加二抗, 而不添加一抗的细胞作为阴性对照组,检测二抗的假阳性情况。使用的一抗包括:Glutamate synthetase(1∶600, sigma)、vimentin(1∶400, Dako)、Pax6(1∶600, Abcam)、nestin(1∶600, chemicon)、otx2(1∶600, chemicon)免疫标记的细胞在激光共聚焦扫描显微镜(Zeiss, LSM 510 META)下进行检测。
1.5 逆转录-多聚酶链式反应(reverse transcriptionpolymerase chain reaction, RT-PCR)
根据厂家提供的实验步骤, 用Trizol试剂(Invitrogen, Calsbad, CA)从培养的细胞中直接提取总RNA。用DNaseI消化总RNA中可能含有的基因组DNA, 去除DNA的污染。
逆转录反应:在20 μL体系(1× reverse transcription buffer, 0.5 mol/L dNTPs, 50 pmol oligo dT primer, 20 U RNase inhibitor, 5 U reverse transcriptase)中加入1 μg总RNA, 在PCR仪(MJ Research, Watertown, MA)上42 ℃保温1.5 h后65 ℃继续保温 10 min。PCR反应:在25 μL的PCR体系(10× PCR reaction buffer, 1.5 mmol/L MgCl2, 0.5 mmol/L dNTPs, 0.4 μmol/L 正反向引物, 1.25 U rTaq DNA聚合酶)中加入1 μL RT产物(表1)扩增25~35个PCR循环(95 ℃,30 s, 52~60 ℃,30 s, 72℃,30 s)以保证PCR反应仍然处于线形扩增阶段,随后在72 ℃延伸5 min。PCR反应所用引物见表2, 所有的RT-PCR试剂均购于Takara (Takara, Dalian, China)。PCR产物在2% 琼脂糖胶上电泳后,用溴化乙锭(ethidium bromide)染色, 以管家基因GAPDH为标准, 用Quantity-One软件(Bio-Rad)通过电泳条带的强弱程度, 评价基因表达量的高低。

表1 PCR反应体系Tab. 1 PCR reaction system
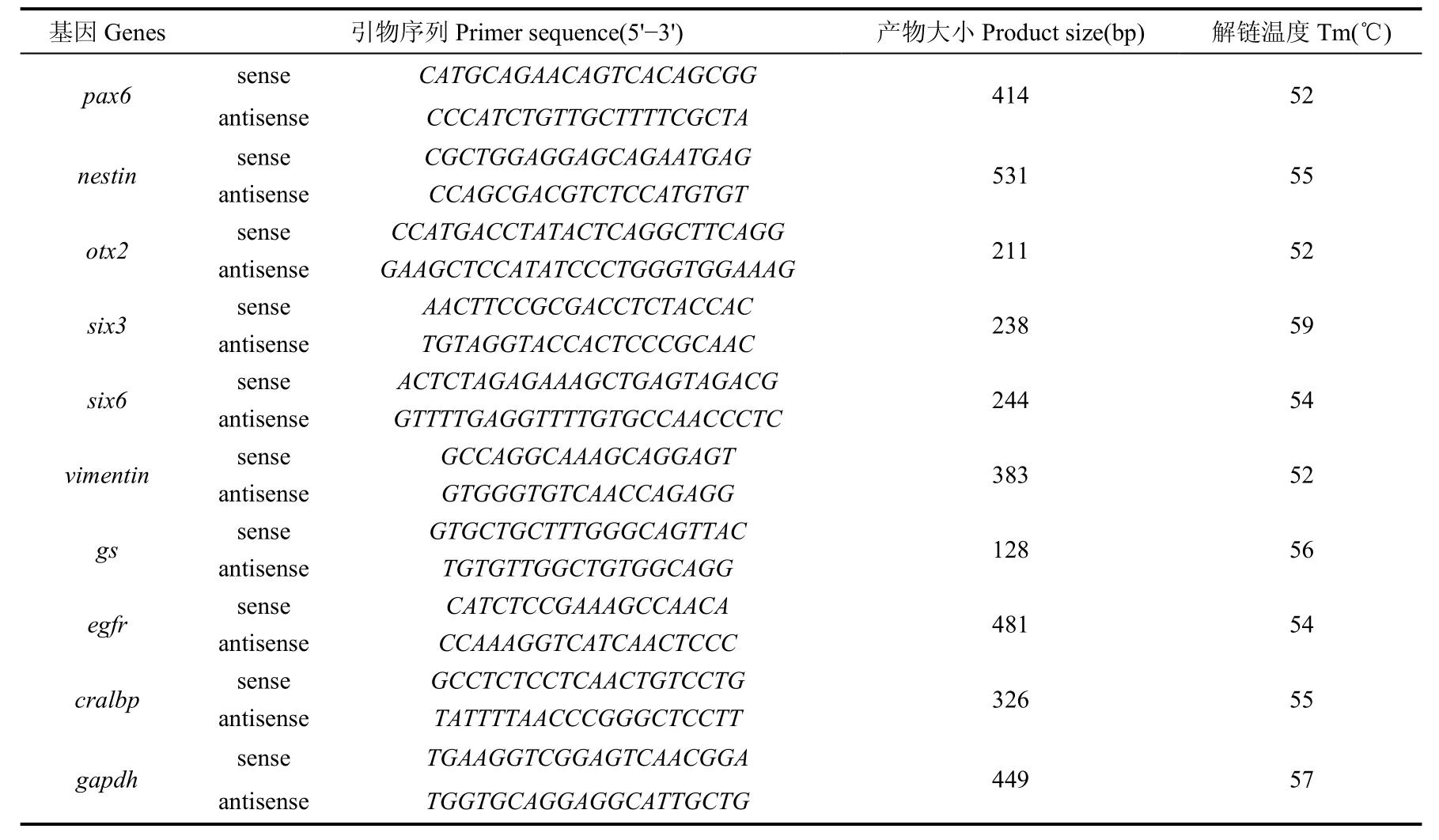
表2 PCR引物信息Tab. 2 Primer information for PCR
1.6 统计分析
统计数据以平均值±标准误 (Mean±SD) 进行表示。统计分析采用SPSS 10.0软件进行One-Way ANOVA分析。P<0.05限定为差异显著。
2 结 果
2.1 猕猴穆勒细胞系的建立及基因表达特征
在含有10%FBS的培养条件下, 接种48 h细胞开始贴壁生长, 穆勒细胞单层贴壁生长, 呈成纤维细胞样, 分裂周期约为24 h。体外传代可达30次以上。我们从13个猴子中建立12株细胞系(92.3%)。使用免疫荧光和RT-PCR的方法分析第3、15和30代细胞, 发现穆勒细胞稳定表达GS[(99.3±0.5) %], vimentin[(97.7±2.1)%), EGFR和CRALBP等穆勒细胞特征基因(图1C, D;图2)而少有GFAP的表达。同时, 检测视网膜干细胞标记基因发现, 在含10%FBS的培养条件下, 穆勒细胞不表达pax6、nestin,、sox2、otx2、six6、six3等视网膜干细胞标记(图3; 图4A, B, C)。我们的结果说明,猕猴穆勒细胞可在体外大量扩增且属性较为稳定。
2.2 穆勒细胞去分化为视网膜前体细胞
据研究报道, 成年哺乳动物, 包括人的穆勒细胞一定条件下在体内外可去分化视网膜干细胞。第3、15、30代培养的猕猴穆勒细胞贴壁后,我们将培养基更换为含有FGF2、EGF、N2 supplemnt的无血清培养基。培养一周后, 免疫荧光染色检测发现穆勒细胞开始表达pax6、nestin、otx2等视网膜干细胞标记基因(图4 A, B, C), RT-PCR的检测同时也验证了上述视网膜干细胞基因的表达, 而且six3和six6两个视网膜发育相关基因也有表达, 而穆勒细胞相关基因GS、vimentin、EGFR和CRALBP的表达出现了显著的下降(图3)。但是, 随着细胞的传代,视网膜干细胞标记基因的表达会出现明显下降(数据未显示)。该结果证明,体外培养的猕猴穆勒细胞可诱导去分化为视网膜干细胞, 但较难长时间维持在视网膜干细胞的状态。
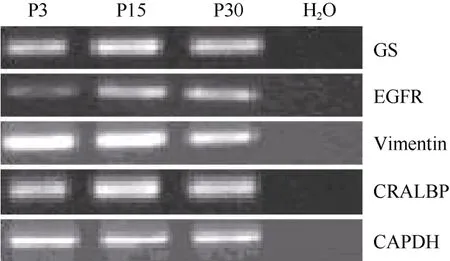
图2 不同代数穆勒细胞基因表达的RT-PCR分析Fig.2 RT-PCR analysis of gene expression of muller cells at different passage
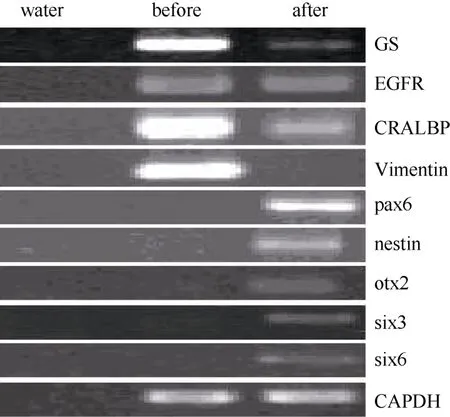
图3 穆勒细胞特征基因及视网膜干细胞基因在神经干细胞培养基诱导前后表达差异Fig.3 Expression switch of muller cell specific genes and retinal stem cell genes after induction
2.3 去分化后的穆勒细胞向神经细胞分化
干细胞的一个重要标准是具有分化的多能性(West et al, 2009)。猕猴穆勒细胞经神经干细胞培养基培养一周后, 使用含有1%FBS和30 mmol/L视黄酸的DMEM/F12培养基诱导培养3周后发现, 有部分细胞分化成神经元 (图4D), 但是使用免疫荧光染色法未检测到有视网膜特异类型的神经细胞形成, 该结果说明猕猴的穆勒细胞可以跨谱系分化为神经元细胞, 但是能否分化成特异的视网膜神经元需要进一步研究。
3 讨 论
本研究成功建立了猕猴穆勒细胞系, 该系可在体外长期传代并保持属性的稳定。表达GS、vimintin、EGFR、CRALBP; 而不表达GFAP, 这与人的穆勒细胞基因表达特征相似(Limb et al, 2002),而与大鼠(Birnbach et al, 1994)和猫(Lewis et al, 1988)的有所不同。另外, 穆勒细胞与视网膜中的星形胶质细胞在外形和基因表达方面都非常相似, 而且我们的细胞分离方法使得培养的细胞有可能混杂有星形胶质细胞。星形胶质细胞与穆勒细胞的主要区别是星形胶质细胞表达GFAP且不表达CRALBP, 我们建立的细胞系表达CRALB;而不表达GFAP。 因此, 我们建立的细胞系是穆勒细胞而不是星形胶质细胞。
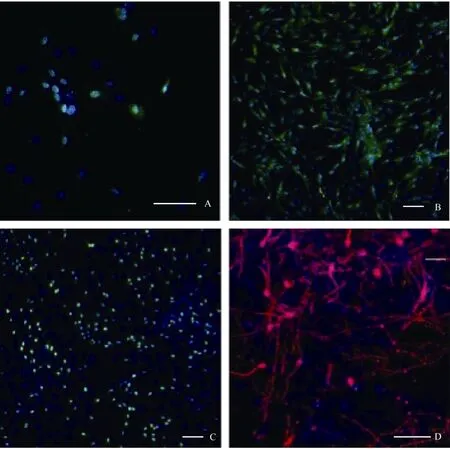
图4 诱导去分化及再分化后相关基因的免疫荧光检测Fig.4 Immunofluorescence test for gene expression after induction and redifferentiation
穆勒细胞是视网膜中最后分化出的细胞类型,有学者认为穆勒胶质细胞是视网膜干细胞进入静息状态的一种存在形式, 当有生理需要的时候穆勒细胞就会又返回到视网膜干细胞的状态(Agathocleous & Harris, 2009)。在鸡(Fischer & Reh, 2001)和大鼠的试验中视网膜在受损伤的情况下, 穆勒细胞可起到视网膜干细胞的作用。体外分离培养的啮齿动物(Das et al, 2006; Wan et al, 2007)和人(Lawrence et al, 2007)的穆勒细胞也具有一定视网膜干细胞特征。我们分离培养的猕猴穆勒细胞同样在诱导条件下可去分化, 与人的穆勒不同的是猕猴的更多的表达视网膜干细胞的基因, 而人的则更倾向于去分化为神经干细胞。
虽然猕猴的穆勒细胞在体外去分化的过程中可表达多种视网膜干细胞基因, 但是神经干细胞培养基并不能长期维持穆勒细胞去分化为视网膜干细胞的状态。这可能是由于培养条件不够理想, 仅能诱导其去分化而不能抑制其再分化造成的, 同时说明猕猴的穆勒胶质细胞与其他物种的穆勒细胞一样具有可塑性, 研究优化诱导和培养条件可为发育生物学研究及临床应用提供良好的平台。
Agathocleous M, Harris WA. 2009. From progenitors to differentiated cells in the vertebrate retina[J]. Ann Rev Cell Dev Biol,25: 45-69.
Birnbach CD, Jarvelainen M, Possin DE, Milam AH. 1994. Histopathology and immunocytochemistry of the neurosensory retina in fundus flavimaculatus[J]. Ophthalmology,101: 1211-1219.
Das AV, Mallya KB, Zhao X, Ahmad F, Bhattacharya S, Thoreson WB, Hegde GV, Ahmad I. 2006. Neural stem cell properties of Muller glia in the mammalian retina: regulation by Notch and Wnt signaling[J]. Dev Biol,299: 283-302.
Fischer AJ, Reh TA. 2001. Muller glia are a potential source of neural regeneration in the postnatal chicken retina[J]. Nat Neurosci,4: 247-252.
Lawrence JM, Singhal S, Bhatia B, Keegan DJ, Reh TA, Luthert PJ, Khaw PT, Limb GA. 2007. MIO-M1 cells and similar muller glial cell lines derived from adult human retina exhibit neural stem cell characteristics[J]. Stem Cells,25: 2033-2043.
Lewis GP, Kaska DD, Vaughan DK, Fisher SK. 1988. An immunocytochemical study of cat retinal Muller cells in culture[J]. Exp Eye Res,47:855-868.
Limb GA, Salt TE, Munro PM, Moss SE, Khaw PT. 2002. In vitro characterization of a spontaneously immortalized human Muller cell line (MIO-M1) [J]. Invest Ophthalmol Vis Sci,43: 864-869.
Ooto S, Akagi T, Kageyama R, Akita J, Mandai M, Honda Y, Takahashi M. 2004. Potential for neural regeneration after neurotoxic injury in the adult mammalian retina[J]. Proc Natl Acad Sci USA,101: 13654-13659.
Wallace VA. 2007. Stem cells: a source for neuron repair in retinal disease[J]. Can J Ophthalmol,42: 442-446.
Wan J, Zheng H, Xiao HL, She ZJ, Zhou GM. 2007. Sonic hedgehog promotes stem-cell potential of Muller glia in the mammalian retina[J]. Biochem Biophys Res Commun,363: 347-54.
West EL, Pearson RA, MacLaren RE, Sowden JC, Ali RR. 2009. Cell transplantation strategies for retinal repair[J]. Prog Brain Res,175: 3-21.
Rhesus monkey (Macaca mulatta) muller cells exhibit retinal stem/progenitor cell featuresin vitro
GUO Xiang-Yu, JIN Li-Fang, JI Shao-Hui, JI Wei-Zhi*
(Yunnan Key Laboratory for Animal Reproductive Biology, Kunming Institute of Zoology, the Chinese Academy of Sciences, Kunming 650223, China)
Recent evidences indicate that retinal muller cells exhibit retinal progenitor characteristics under certain condition in chick, rat and human. However, there is no report on nonhuman primate, a close relative to human. In this study, we first established a muller cell line of rhesus monkey expressing GS, vimentin, CRALBP, EGFR, barely GFAP, which resemble the expression profile of human muller cells, differ from that of rodent. Expression of pax6, nestin, sox2, otx2, six6, and six3 was detected after one week culture in neural stem cell medium. Further culture with retinoic acid induced some cells differentiate toward neuron. These results suggest that primate muller cell is capable of dedifferentiating to retinal progenitors, which may serve as a potential cell source for cell therapy to treat retinal degenerative diseases.
Rhesus monkey; Retinal stem cells; Muller cell; Retinal degenerative diseases
Q813.11; Q959.848; R774.1
A
0254-5853-(2011)06-0611-06
10.3724/SP.J.1141.2011.06611
2011-05-10;接受日期:2011-10-20
科技部重大专项(2009ZX09501-028);云南社会科技发展计划(2007GH);中科院知识创新工程重大项目(KSCX1-YW-22)
∗通讯作者(Corresponding author),Tel/fax: 86-0871-5139413, E-mail: wji@mail.kiz.ac.cn
- Zoological Research的其它文章
- A phylogeny of the Tylototriton asperrimus group (Caudata: Salamandridae) based on a mitochondrial study: suggestions for a taxonomic revision
- 体细胞核移植生产绵羊转hALR基因囊胚
- 上海市南汇东滩围垦后海岸带湿地冬春季水鸟生境选择
- 杭州湾及钱塘江河口水鸟群落组成、季节动态及种间相关性分析
- 云南新平哀牢山西黑冠长臂猿分布与群体数量
- Histological and immunocytochemical study of deferens ducts in the Chinese rat snake (Zaocys dhumnades)

