小剂量氢氯噻嗪肠溶片的制备及体外释放度测定
江苏省南通大学附属东台医院(224200) 蔡伟 李健 姜曜 张美和 纪冬霞
小剂量氢氯噻嗪肠溶片的制备及体外释放度测定
江苏省南通大学附属东台医院(224200) 蔡伟 李健 姜曜 张美和 纪冬霞
目的 制备小剂量氢氯噻嗪肠溶片,并对其体外释放度进行测定。方法 选用适宜的辅料制备氢氯噻嗪片芯,用Ⅱ号丙烯酸树脂为肠溶包衣材料制备肠溶片,采用紫外分光光度法测定氢氯噻嗪肠溶片的含量和释放度。结果 在包衣增重6%,包衣转速20~30r/min,热处理时间为2小时时,制备的肠溶衣在盐酸溶液中2小时不裂片不崩解,在磷酸钠缓冲液中释放度符合2005版中国药典要求。结论 采用该工艺制备氢氯噻嗪肠溶片,方法可行,重现性好,制备的肠溶片在盐酸溶液中和磷酸缓冲液中的释放度符合2005版中国药典标准。
氢氯噻嗪 肠溶片 释放度
氢氯噻嗪为中效排钠利尿剂,用于治疗原发性高血压已有40余年的历史[1],具有作用温和、无耐药性、毒副反应小及加强其它降压药物降压效果等优点[2]。主要不良反应包括:低钾血症,干扰肾小管尿酸排泄,糖耐量降低、血糖、尿糖升高,脂代谢紊乱等,而这些不良反应大多数与剂量有关[3]。有研究表明,小剂量与大剂量氢氯噻嗪相比,有同样的降压效果,都能降低总的心脑血管事件和总病死率,但只有小剂量氢氯噻嗪能降低冠脉事件的发生[4-6]。因此,国内外高血压防治指南多推荐使用小剂量噻嗪类利尿剂[7]。为满足患者的需求,国内已有制成25mg的氢氯噻嗪缓释片、氢氯噻嗪-β-环糊精包合物、氢氯噻嗪分散片等报道。本研究结合临床诊疗指南,考虑到氢氯噻嗪片水溶性差、味微苦、对胃肠道有刺激作用以及稳定性差等问题,研制规格为每片12.5mg的氢氯噻嗪肠溶片。
1 仪器与试药
1.1 仪器 ZPS8型旋转式压片机(上海天祥健台制药机械有限公司),DBL-3多功能制粒包衣机(重庆广厦干燥设备工程公司),RCZ-6B型溶出度仪(上海黄海药检仪器厂),UV-2401型紫外分光光度计(日本岛津)。
1.2 试药 氢氯噻嗪对照品(中国药品生物制品检定所,批号:100309-200910),氢氯噻嗪(常州制药厂有限公司,批号:091009,纯度:99.98%),交联聚维酮(PVPP)、低取代羟丙纤维素(LHPC)、交联羧甲基纤维素钠(CCNa)、微晶纤维素(湖洲展望药业有限公司),丙烯酸II号树脂(上海运宏化工制剂辅料技术有限公司),硬脂酸镁(上海元越化工有限公司),羟丙甲基纤维素(上海试剂分装站),聚维酮(PVP)、滑石粉(广西龙胜华美滑石粉开发有限公司)。
2 氢氯噻嗪肠溶片的制备
2.1 片芯的制备
2.1.1 崩解剂的选择 根据崩解剂吸水后的溶胀性能指标(即膨润度)进行选择,选取PVPP、CCNa、LHPC3种常用崩解剂,通过测定其膨润度来考察吸水后的溶胀性能。称取适量崩解剂,置量筒中,振摇平整,读取体积,然后加适量水于量筒中,搅匀,常温下摆放24小时后,读取膨胀后的水合体积。水合体积与干燥的崩解剂体积之比即为膨润度。试验结果见表1。

表1 不同崩解剂的膨润度
由实验结果得知,PVPR的膨润度最大,说明其膨胀能力在3种崩解剂中最强,因此选择其为片芯的崩解剂。
2.1.2 崩解剂用量的确定 制备含崩解剂PVPR分别为1%、2%、3%、5%的片芯,再包肠溶衣,测定肠溶片的释放度,结果见图1。由图1可见,崩解剂为1%、2%时,主药释放慢,45分钟时药物的释放度不符合药典标准,崩解剂在3%以上时,释放度均大于标示量的70%。故崩解剂的用量为3%。

图1 崩解剂剂量对药物释放的影响
2.1.3 填充剂的选择 各种填充剂对片芯崩解时间的影响是:微晶纤维素崩解时间为139.6秒,硫酸钙平均崩解时间为196.4秒,糊精平均崩解时间为223.5秒。提示微晶纤维素在稀碱中溶解并溶胀,具有良好的流动性和可压性,崩解时间较短,药物易于分散,故选择微晶纤维素作为填充剂。
2.1.4 粘合剂的选择 分别以羟丙甲纤维素(HPMC)、PVP为粘合剂制备片芯,考察两者的崩解时间,结果平均崩解时间为115.6秒,PVP平均崩解时间为135.7秒。再分别考察肠溶片的释放度。结果显示,以HPMC为粘合剂的片芯崩解快,肠溶片释放度比以PVP为粘合剂的肠溶片释放度高。所以确定以HPMC为粘合剂。
2.1.5 片芯的制备 根据最终处方,片芯的规格为100mg,将处方量氢氯噻嗪、PVPP、微晶纤维素、HPMC过100目筛3次,搅拌均匀,PVP为粘合剂,用湿法制颗粒,再过16目筛制粒,于55℃处干燥,过18目筛整粒,加适量硬脂酸镁混匀,选用冲头直径6mm,硬度70N,压制成片芯。
2.2 肠溶片的制备
2.2.1 选择与配制包衣材料 片芯包肠溶衣,包衣材料选用Ⅱ号丙烯酸树脂,PEG-6000为增塑剂,滑石粉为抗粘剂。将Ⅱ号丙烯酸树脂用85%乙醇溶解制成5%树脂溶液,将滑石粉和苯二甲酸二乙脂、聚山梨醇等混匀、研磨加入Ⅱ号丙烯酸树脂溶液中,加入色素混匀后,慢速搅拌20分钟,用120目筛滤过除去颗粒,得到包衣液。
2.2.2 包衣增重 根据辅料性能和肠溶片剂型的要求,在片芯表面上应覆盖一定厚度的肠溶包衣,才能抵御较长时间胃酸(0.1mol/L)的侵蚀。制备包衣增重分别为2%、4%、6%、8%时,考察制剂的释放度,其结果见图2。
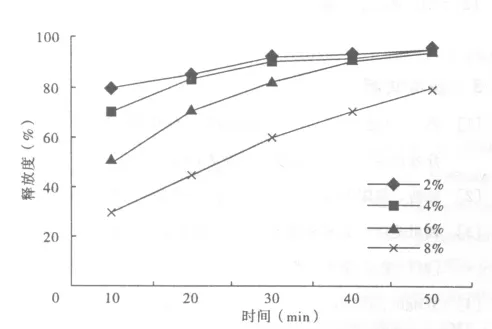
图2 不同包衣增重对药物释放的影响
实验结果分析表明,包衣增重为2%、4%时,有部分片剂在人工胃液中产生裂片,不能达到肠溶片的要求。包衣增重为8%时,片剂在人工胃液中崩解时间过长,释放度减小。最后本实验选取包衣增重为6%。
2.2.3 包衣锅转速 考察包衣锅转速分别为10r/min、20r/min、30r/min、40r/min时制成的药物的释放度。当包衣锅转数为10r/min时,片芯无法正常滚动,影响包衣效果。当转速为20~30r/min时,肠溶片的释放度符合药典要求。
2.2.4 片剂烘干时间 将同一批次的片剂包肠溶衣后,分别放入烘箱中2小时、4小时、6小时,让包衣材料形成致密的衣膜。考察在不同烘干时间下肠溶片的释放度。结果提示,烘干处理2小时已能形成致密的薄膜衣,达到肠溶的要求,所以最后的烘干时间为2小时。
2.2.5 包衣程序 将片芯放置于包衣锅内旋转,包衣过程中持续吹入热空气,片芯预热,包衣液进入喷枪,均匀喷晒向包衣锅内。喷雾速率1mL/min;雾化压力0.2MPa;包衣锅转数20-30r/min;包衣温度35℃左右;包衣增重6%;包衣结束后放置于35℃左右的烘箱中烘干2小时即得。
2.2.6 批间重现性 以最终工艺和处方连续制备3批样品,进行体外释放度测定,考察批间重现性。结果:制备的肠溶片在人工胃液中2小时无裂片或崩解,检测出氢氯噻嗪含量均<标示量的10%;在磷酸盐缓冲液中(人工肠液)释放度均>70%,符合2005版药典要求,批间重现性好。
3 含量测定与体外释放度测定
3.1 含量测定
3.1.1 测定波长的选择 分别将氢氯噻嗪、氢氯噻嗪肠溶片和辅料制作成溶液,滤过。在200~400nm波长范围内进行紫外线扫描,主药在波长273m处有最大吸收,而辅料在此波长基本无吸收,故选择273nm为测定波长。
3.1.2 标准曲线的绘制 精密称取氢氯噻嗪12.5mg溶于100mL的容量瓶中,加稀盐酸定容。分别量取1.0mL、2.0mL、4.0mL、6.0mL、8.0mL、10.0mL置于10mL容量瓶中,用稀盐酸稀释至刻度,在波长273nm处测定吸收度。以吸收度(A)对药物浓度(C)进行回归分析,得到方程A=0.0630C+0.0047。氢氯噻嗪检测线性范围为100~400μg/mL(r=0.999,n=6)。
3.1.3 精密度试验 按线性范围内分别配制高、中、低3种浓度的氢氯噻嗪溶液,按上述方法测定吸收度,计算实际浓度。同日内测定日间精密度(RSD),再连续3日分别测定RSD。结果日内RSD=0.41%(n=3),日间RSD=0.65(n=3)。
3.1.4 加样回收率试验 分别配制高、中、低3种浓度氢氯噻嗪溶液,加入适量的辅料,测定吸收度,求加样回收率。结果平均回收率为100.18%,RSD=0.62%(n=3)。
3.1.5 氢氯噻嗪肠溶片含量测定 取20片本品,除去包衣层,研细。精密称取适量(约相当于氢氯噻嗪12.5mg)置100mL量瓶中,加盐酸溶液(24→1000)适量,使溶解、滤过,精密量取滤液5mL,置另一100mL量瓶中,用盐酸溶液稀释至刻度,摇匀,在273nm波长处进行紫外线扫描,测定吸光度。计算含量。
3.2 释放度测定
3.2.1 盐酸中释放量 量取0.1mol/L 盐酸溶液750mL,注入每个溶出杯,加温使溶液温度保持在(37±5)℃,调整转速为100r/min并保持稳定,取6片12.5mg氢氯噻嗪肠溶片投入转篮中,开动仪器运转2小时,立即在取样点吸取适量溶液,并在30秒内经0.8um的微孔滤膜滤过,滤液按含量测定的方法进行测定,计算每片在盐酸中的释放量。
3.2.2 缓冲液中释放量 在溶出杯中加入0.2mol/L磷酸钠溶液250mL(必要时用2mol/L盐酸溶液或氢氧化钠溶液调节pH值至6.8±0.05),转速温度不变,依法操作,分别于10分钟、20分钟、30分钟、45分钟、60分钟时,取液滤过,并补加相同体积的缓冲液。滤液按含量测定的方法进行测定,计算每片在缓冲液中的累积释放量。
4 结论与讨论
经多次实验验证,12.5mg的氢氯噻嗪肠溶片在0.1mol/L盐酸溶液中2小时不崩解,在0.2mol/L磷酸钠溶液中每片的释放量均大于标示量的70%。
采用紫外分光光度法测定氢氯噻嗪的释放度和含量,操作简便,结果准确,可用于氢氯噻嗪肠溶片的质量控制。
目前临床上常用的氢氯噻嗪都是普通片剂,且规格是10mg、25mg、50mg[8],在治疗原发性高血压时,指南均推荐小剂量12.5mg。氢氯噻嗪与血管紧张素转换酶抑制剂(ACEI)、ARBEH、β受体阻滞剂、钙通道阻滞剂(CCB)联合用药时,也推荐小剂量[9]。患者服用10mg的氢氯噻嗪,剂量偏小,不符合治疗指南的要求,而服用12.5mg时需要将25mg的片剂掰开,易导致服用剂量不准确和服用依从性不高。小剂量肠溶片具有良好的疗效和性价比,为满足患者的需求,应尽快研制出规格为每片12.5mg的氢氯噻嗪肠溶片。
[1]蔡伟,李健,姜曜,等 .不同剂量氢氯噻嗪治疗原发性高血压的疗效观察[J].中国医院药学杂志,2011,2:57
[2]徐浩 .临床用药须知[M].天津:天津电子出版社,2005:950
[3]四川美康医药软件研究开发有限公司 .药物临床信息参考[M].重庆:重庆出版社,2008,1035
[4]Wright JM.Choosing a first-line drug in the management of elevated blood preasure:what is the evidence?1:Thiazide[M].CMAJ,2000,163:57
[5]Wright JM,Lee CH,Chambers GK.Systematic review of antihypertensive therapics:does the evidence assist in choosing a first-line drug[J].CMAJ,1999,161:25
[6]Weir MR,Flack JM,applegate WB.Tolerablility,safety,and quality of life and hypertensive therapy:the case for low-dose diuretics[J].Am Jmed.1996,101:83
[7]王文 .中国高血压防治指南(2009 年 基 层 版).http://www.365heart.com
[8]中国药典 .二部[S].2005,407
[9]中华医学会心血管病学分会高血压学组 .利尿剂治疗高血压的中国专家共识[J].中华高血压杂志,2011,03:217
The preparation and the release in vitro determination of small dosage of hydrochlorothiazide entericcoated tablets
Cai Wei,Li Jian,Jiang Yao,et al.The Dongtai Hospital of Nantong University,Dongtai,224200,China.
Objective Manufacturing small dosage of hydrochlorothiazide enteric-coated tablets and determining its release in vitro.Method Choosing condign accessories to manufacture hydrochlorothiazide tablets,and selecting the model No.II acrylic acid polymers as enteric-coating material to produce enteric-coated tablets,and then,mensurating the contains and the release rate of hydrochlorothiazide enteric-coated tablets with the uv-speetrophotometric method.Result The manufactured enteric-coated tablets,when its coating gains 6%weight and has the rotational speed between 20and 30r/min,and the heat-treatment time reaches 2h,don't split and collapse in the hydrochloric acid solution,furthermore,its release rate in the sodium diphosphate solution meets the standard of the chinese pharmacopoeia 2005edition.Conclusion This technics,introduced to produce the hydrochlorothiazide enteric-coated tablets,is practical and has great reproducibility,moreover,when the produced enteric-coated tablets are put in the hydrochloric acid solution or sodium diphosphate solution,its release rate is up to the standard of the chinese pharmacopoeia 2005edition.
hydrochlorothiazide enteric-coated tablet release rate
(本文编辑 刘社民)
2010年盐城市医学科技科研课题项目:编号YK2010042
- 辽宁医学杂志的其它文章
- 硬膜外阻滞复合静脉全麻在腹腔镜辅助阴式子宫全切术中的应用

